美國 FDA 于 7 月 25 日在網(wǎng)站上發(fā)布了一項關(guān)于抗癲癇藥拉莫三嗪的研究結(jié)果����,藥品審評與研究中心(CDER)的研究人員在健康受試者中比較了仿制拉莫三嗪緩釋(ER)片和品牌 ER 片�,得出結(jié)論仿制藥和品牌藥具有生物等效性(BE)����,解決了人們對拉莫三嗪緩釋制劑品牌藥的仿制替代風(fēng)險的擔(dān)憂。
由于具有廣譜療效和良好的耐受性��,拉莫三嗪是現(xiàn)有抗癲癇藥物中中處方最多藥之一����。FDA 批準的拉莫三嗪仿制口服制劑包括速釋(IR)片、緩釋片(ER)�����、咀嚼片和口腔崩解片��。2016 年由 FDA 資助的臨床研究(EQUIGEN 和 BEEP )證明了仿制藥拉莫三嗪 IR 產(chǎn)品在癲癇患者中的生物等效���。美國癲癇學(xué)會(AES)因此撤銷了 2007 年反對用抗癲癇仿制藥進行臨床替代的協(xié)會聲明�,并在一份聲明中感謝 FDA 批準的仿制藥實現(xiàn)了臨床替代����,在不減損療效的情況下降低了醫(yī)療費用��。
但與速釋制劑相比����,緩釋系統(tǒng)的作用機制更為復(fù)雜�,醫(yī)學(xué)界和患者群體仍然擔(dān)心拉莫三嗪緩釋制劑的仿制藥替代風(fēng)險,因此 FDA 進行了進一步的研究���。
為了解決考慮到藥代動力學(xué)(PK)曲線形狀可能發(fā)生變化的問題��,與可能的受試者內(nèi)變異(WSV)相關(guān)的PK變異�����,F(xiàn)DA研究評估了:(1)在健康受試者全重復(fù) BE 研究中���,仿制和品牌拉莫三嗪 ER 產(chǎn)品的藥代動力學(xué)和 BE,以及(2)此類全重復(fù)研究設(shè)計和 WSV 數(shù)據(jù)是否能更好地支持仿制拉莫三嗪 ER 產(chǎn)品的批準����。在健康受試者中選擇單劑量研究是基于之前的 EQUIGEN 和 BEEP 研究的結(jié)果,在癲癇患者中進行多次給藥的 BE 研究顯示與在健康受試者中的單劑量研究具有可比性的結(jié)果��,并且健康受試者更均勻且對檢測制劑差異更敏感。
此外���,F(xiàn)DA進行了臨床研究以評估 2016 年之前批準的一種規(guī)格(200mg)的仿制拉莫三嗪 ER 制劑���,該產(chǎn)品未經(jīng)體內(nèi)試驗。研究在進食狀態(tài)下進行���,因為在進食條件下(即,較短的 Tmax)���,預(yù)計仿制拉莫三嗪緩釋制劑與品牌藥的 PK 曲線最不同����。
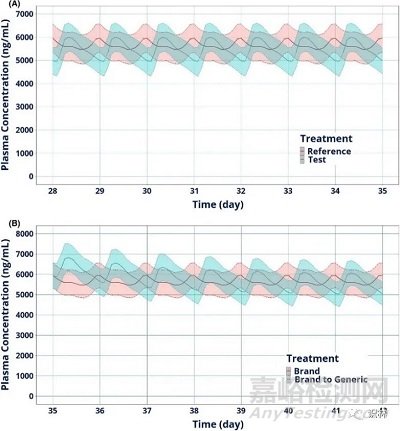
FDA 研究采用隨機���、單次給藥����、完全重復(fù)的交叉研究��,在健康受試者進食條件下證實了仿制拉莫三嗪緩釋片和品牌緩釋片(200mg)的 BE��。仿制藥和品牌拉莫三嗪緩釋片的單劑量顯示出相似的 WSV,并且在健康受試者中安全且耐受性良好����。正如重復(fù)給藥 200 mg 拉莫三嗪緩釋片后的計算機模擬 PK 數(shù)據(jù)所示,仿制藥和品牌 ER 藥品在轉(zhuǎn)換和長期使用仿制藥后預(yù)計將具有生物等效性�。
圖:第五周重復(fù)給藥后的模擬 PK 曲線。品牌藥(參照)和仿制藥(試驗)分別以紅色和藍色表示���。實線時平均血漿濃度���,陰影區(qū)域代表模擬血漿濃度的 95% 置信區(qū)間。
FDA 的這一研究發(fā)現(xiàn)�,加上之前拉莫三嗪仿制 IR 產(chǎn)品的研究結(jié)果,進一步支持了拉莫三嗪口服產(chǎn)品的仿制藥替代�。雖然拉莫三嗪不被認為是一種窄治療指數(shù)(NTI)藥物,但仿制藥和原研藥的 WSV 都很小���,完全符合 FDA 關(guān)于 NTI 藥物的標準�。研究結(jié)果支持了雙向交叉研究設(shè)計的適用性��,以證明拉莫三嗪緩釋制劑的BE和仿制藥替代����。