2023年7月27日,F(xiàn)DA 發(fā)布通知稱將 Abiomed 的微型 Impella 心臟泵收到的病例投訴數(shù)量更新為30起,其中包括 26 起受傷和 4 起死亡病例����。此前 Abiomed 公司曾表示收到 27 份有關(guān) Impella 問題的報告����。
Impella 心臟泵已收到30起病例投訴
本月早些時候��,F(xiàn)DA 宣布一級召回強生子公司 Abiomed 開發(fā)的微型 Impella 心臟泵。根據(jù)FDA 的最新消息����,現(xiàn)已將四人死亡與該產(chǎn)品問題聯(lián)系起來��。
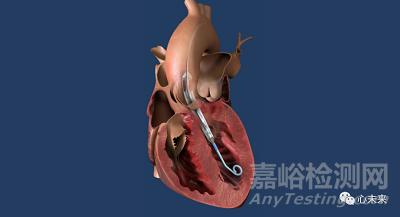
在 7 月 14 日首次發(fā)布的召回公告中����,F(xiàn)DA 詳細(xì)介紹了 Abiomed 的 Impella 裝置(一種導(dǎo)管型心臟泵,插入心臟左側(cè),有助于減輕衰弱心肌的工作負(fù)荷)可能與患者主動脈瓣置換手術(shù)中使用的瓣膜部件碎片發(fā)生碰撞的過程和后果��。
6月中旬��,Abiomed 在發(fā)送給醫(yī)療保健提供者的信函中表示��,公司在之前已經(jīng)接受過主動脈瓣置換術(shù)的患者中����,發(fā)現(xiàn)有 27 例患者 TAVR 植入物外緣的類似支架的支撐物(通常由金屬材料制成����,用于支撐泵的外殼和內(nèi)部機械部件)與 Impella 的旋轉(zhuǎn)葉輪連接��,剪切葉片并導(dǎo)致泵的部分部件斷裂��。
▲圖片源自公司官網(wǎng)(下同)
Abiomed 表示�����,損壞的 Impella 設(shè)備可能會導(dǎo)致嚴(yán)重的血流流失,并可能將碎片散入到患者的血液中����,從而引發(fā)危險狀況��。對于使用尺寸過大或框架擴張不足的 TAVR 瓣膜的患者來說����,發(fā)生碰撞的風(fēng)險更高,因為通向心臟外部的支撐物未與主動脈壁齊平��。
盡管 Abiomed 公司此前指出已收到 27 份有關(guān)該問題的報告(據(jù)稱這些報告病例占自2016年以來所有接受 Impella 系統(tǒng)治療的 TAVR 植入患者的 0.7% 左右),但 FDA 于 7 月 27 日發(fā)布通知����,將該數(shù)字更新為 30 份投訴��,其中26人受傷����,4人死亡。
FDA稱�����,此次召回涉及自 2021 年 5 月以來在美國銷售的近 7900 臺設(shè)備��,包括專為左側(cè)心臟設(shè)計的不同型號和尺寸的 Impella 心臟泵�����,用于微創(chuàng)冠狀動脈手術(shù)�����、心臟直視手術(shù)及治療心臟病發(fā)作后的心源性休克。
FDA 在通知中表示:“Impella 設(shè)備的使用說明文件缺乏對臨床醫(yī)生如何管理 TAVR 患者使用 Impella 的指導(dǎo),也未能描述如果 Impella 與 TAVR 相互作用��,問題可能會以何種方式出現(xiàn)��。”
這些設(shè)備不需要退還給制造商。相反��,F(xiàn)DA 表示��,只要外科醫(yī)生關(guān)注更新的說明并確保心臟泵在重新定位時不發(fā)生旋轉(zhuǎn)�����,Impella 就可以繼續(xù)使用。
此外�����,Abiomed 公司和 FDA 建議臨床醫(yī)生在使用 TAVR 植入物治療患者時����,如果發(fā)現(xiàn)血流流速降低的情況,應(yīng)盡快更換 Impella 心臟泵�����。
回顧 Impella 的兩次召回事件
2023年6月5日��,F(xiàn)DA發(fā)布通知將Abiomed Impella 5.5心臟泵的召回認(rèn)定為一級召回�����,屬于最嚴(yán)重的召回級別。
2022年,強生公司以166億美元收購了Abiomed公司����。Abiomed去年共召回466臺受影響的設(shè)備����,該公司在2021年9月28日至2023年3月6日期間銷售了帶有SmartAssist的Impella 5.5設(shè)備,并于4月17日開始召回����。
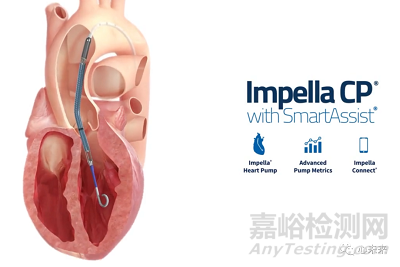
當(dāng)嚴(yán)重心臟病發(fā)作(急性心肌梗死)��、開胸手術(shù)后不到48小時發(fā)生心源性休克��,或因心肌病導(dǎo)致心臟功能不佳時�����,帶SmartAssist的Impella 5.5系統(tǒng)能提供長達14天的支持,以支持心臟泵房��。近期,Abiomed公司收到了該設(shè)備相關(guān)的客戶投訴��,涉及到泵的清洗側(cè)壁上清洗液泄漏��。
▲圖:Impella CP with SmartAssist
如果清洗液出現(xiàn)泄漏,設(shè)備清洗壓力過低��,引發(fā)警報并需要評估����。如果不加以解決����,泄漏問題可能會導(dǎo)致泵停止運行,患者中止治療��。如果泵出現(xiàn)故障�����,處于危急狀況的病人可能會進一步病情加重�����,甚至可能造成嚴(yán)重傷害或死亡��。
根據(jù)FDA的通知�����,Abiomed公司到目前為止報告了179起投訴,3起受傷�����,沒有與這次召回有關(guān)的死亡病例。
2023年7月18日��,Abiomed 的 Impella 在短短幾個月內(nèi)第二次被 FDA 一級召回。6月����,Abiomed 就收到了一份關(guān)于其微型 Impella 心臟泵可能存在血液泄漏的召回報告。此后,在發(fā)現(xiàn)同樣植入了 TAVR 植入物的患者存在潛在安全隱患后��,F(xiàn)DA 對 Abiomed 發(fā)出了第二次召回通知��。
關(guān)于 Abiomed

Abiomed成立于1981年����,總部位于美國馬薩諸塞州,是提供循環(huán)支持和充氧的醫(yī)療設(shè)備的領(lǐng)先提供商�����,也是全球心室輔助血泵(VAD)領(lǐng)域佼佼者��,其生產(chǎn)的Impella心臟泵�����,是唯一獲得美國 FDA 批準(zhǔn)適用于需要高危 PCI 或 AMI 心源性休克等嚴(yán)重冠狀動脈疾病患者的經(jīng)皮心臟泵技術(shù)�����。目前全球使用Impella心臟泵的患者超過15萬�����。
2022年12月22日����,全球醫(yī)療巨頭強生公司宣布已完成對Abiomed����,Inc.的收購��,總收購金額約166億美元����。