摘要
目的:分析«美國藥典»藥包材標(biāo)準(zhǔn)體系概況及其最新進展, 為我國藥包材標(biāo)準(zhǔn)體系的建立與優(yōu)化提供參考�����。
方法:對«美國藥典»藥包材標(biāo)準(zhǔn)體系框架結(jié)構(gòu)與標(biāo)準(zhǔn)內(nèi)容進行解析, 對藥包材產(chǎn)品標(biāo)準(zhǔn)和方法標(biāo)準(zhǔn)����、美國藥包材管理法規(guī)的相互關(guān)系進行比較分析����。
結(jié)果:«美國藥典»藥包材標(biāo)準(zhǔn)體系相對完善, 藥包材評價標(biāo)準(zhǔn)具有鮮明特色, 藥包材標(biāo)準(zhǔn)貫穿藥包材使用全生命周期, 同時藥典論壇定期更新。
結(jié)論:«美國藥典»相對完善的藥包材材質(zhì)標(biāo)準(zhǔn), 產(chǎn)品標(biāo)準(zhǔn)與評價標(biāo)準(zhǔn)相互支撐并貫穿藥包材使用全生命周期, 都對我國藥包材標(biāo)準(zhǔn)體系建設(shè)具有重要參考價值�����。
關(guān)鍵詞
中華人民共和國藥典; 美國藥典; 藥包材; 標(biāo)準(zhǔn)體系
正文
藥包材的質(zhì)量����、安全、使用性能以及藥包材與藥物之間相容性對藥品質(zhì)量有著十分重要的影響。«中華人民共和國藥品管理法»[1]指出, 藥包材應(yīng)當(dāng)符合藥用要求, 符合保障人體健康��、安全的標(biāo)準(zhǔn)����。«國家藥監(jiān)局關(guān)于進一步完善藥品關(guān)聯(lián)審評審批和監(jiān)管工作有關(guān)事宜的公告»(2019年第56號)[2]要求藥包材登記資料中需提供該藥包材及各組件被國家標(biāo)準(zhǔn)及國內(nèi)外藥典、以及相關(guān)國際標(biāo)準(zhǔn)收載的信息�����。國內(nèi)外藥典藥包材標(biāo)準(zhǔn)是我國藥品與藥包材關(guān)聯(lián)審評重要依據(jù)之一����。
目前, 影響較大的國外藥典如«美國藥典»(United States Pharmacopeia, USP)、«歐洲藥典»(European Pharmacopeia, EP)�����、«日本藥局方» (Japanese Pharmacopeia, JP)等均已收載藥包材標(biāo)準(zhǔn)����。
美國食品藥品管理局(FDA)對藥包材采取藥品主文件(drug master file, DMF)的管理模式。DMF是指向FDA提交的一組文件, 共分為Ⅰ��、Ⅱ����、Ⅲ����、Ⅳ��、Ⅴ類5種(Ⅰ類DMF于2000年停止)��。其中, 包裝材料為Ⅲ類DMF�����。FDA的DMF是關(guān)聯(lián)審評的備案管理模式, 我國藥包材也采用關(guān)聯(lián)審評的備案管理模式, 因此研究USP藥包材標(biāo)準(zhǔn)體系架構(gòu)對研究制定中國藥包材標(biāo)準(zhǔn)具有重要借鑒意義��。筆者在本文針對USP[3]的包裝標(biāo)準(zhǔn)體系及其進展進行概述和分析, 以期使我國藥品和藥包材研發(fā)����、生產(chǎn)、使用����、檢驗、審評和監(jiān)管各方更好地了解USP藥包材標(biāo)準(zhǔn)概況, 為關(guān)聯(lián)審評和國家標(biāo)準(zhǔn)體系構(gòu)建提供參考和借鑒, 以期使«中華人民共和國藥典»藥包材標(biāo)準(zhǔn)能夠更好地服務(wù)于審評審批和上市后監(jiān)管, 能夠更好地推動藥包材及藥品行業(yè)高質(zhì)量發(fā)展[4]�����。
1��、USP組織架構(gòu)及藥包材標(biāo)準(zhǔn)制修訂
1.1 USP組織架構(gòu)
第一版USP發(fā)布于1820年�����。美國藥典大會為USP的管理機構(gòu)之一, 通過每5年一次的大會, 大會成員確認USP決議, 并選舉USP理事會和領(lǐng)導(dǎo)USP標(biāo)準(zhǔn)制定專業(yè)委員會的專家委員會��。理事會對組織起著至關(guān)重要的領(lǐng)導(dǎo)作用�����。理事會受托管理USP, 負責(zé)信托監(jiān)督�����、全面聲譽風(fēng)險管理以及與其他USP管理機構(gòu)合作的治理活動; 專家委員會是監(jiān)督USP科學(xué)和標(biāo)準(zhǔn)制定決策的機構(gòu)��。成員由USP大會成員在每5年一次的會議上選舉產(chǎn)生�����。專家委員會是監(jiān)督USP科學(xué)和標(biāo)準(zhǔn)制定決策的機構(gòu)。2020—2025年, USP共設(shè)立了專家委員會29個, 由來自41個國家和地區(qū)的996位專家組成(2021Annual Report)��。其中藥包材標(biāo)準(zhǔn)由通則-包裝與流通(General Chapter-Packaging and Distribution, GCPD)專家委員會負責(zé)�����。
1.2 USP制修訂流程
USP標(biāo)準(zhǔn)的制修訂可由USP員工�����、監(jiān)管方�����、企業(yè)或?qū)W術(shù)機構(gòu)提出, 在提出的同時向USP遞交支持性文件(修訂原因����、技術(shù)資料��、方法學(xué)數(shù)據(jù)等), USP相應(yīng)科學(xué)聯(lián)絡(luò)官對資料審核后提出標(biāo)準(zhǔn)草案, 草案經(jīng)審核在藥典論壇(pharmacopeial forum, PF)上發(fā)布, 向公眾征求意見, 根據(jù)公眾意見對標(biāo)準(zhǔn)做相應(yīng)��、適當(dāng)?shù)恼{(diào)整, 最后標(biāo)準(zhǔn)經(jīng)相關(guān)專家委員會以投票方式(以多數(shù)票通過后)生效����。
1.3 USP版本更新
USP自2021年起不再保留整套藥典的版本號, 而是引入了以文件為中心的方式��。無論單個文件是否正式生效, 都不會再被關(guān)聯(lián)至一個具體的藥典版本, 而是基于單獨的標(biāo)準(zhǔn)本身, 從而使標(biāo)準(zhǔn)的制修訂能更加及時�����、快捷[5]�����。USP是全球第一個采用單個文件為中心的藥典標(biāo)準(zhǔn), 標(biāo)準(zhǔn)更新將不再受限于藥典發(fā)布周期, 而是依據(jù)標(biāo)準(zhǔn)制修訂本身��。
2�����、藥包材標(biāo)準(zhǔn)體系主要內(nèi)容
2.1 USP藥包材標(biāo)準(zhǔn)框架
USP的藥包材標(biāo)準(zhǔn)框架體系, 包括以材料及其容器為主線的通用性標(biāo)準(zhǔn), 如玻璃��、塑料��、橡膠材料和(或)其成品的通用要求, 同時涵蓋了滿足通用要求評價的性能測試方法��。除此之外, USP還設(shè)立了更為廣泛的評價和研究指南性通則[6]�����。
USP凡例介紹了美國藥典/國家處方集(United States Pharmacopoeia/ National Formulary, USP/NF)的解釋和應(yīng)用的基本假設(shè)、定義和默認條件����。另外, 除各論中另有規(guī)定外, USP涉及所有產(chǎn)品都要符合<659>中規(guī)定的包裝和儲存要求。
USP藥包材標(biāo)準(zhǔn)體系中涉及的相關(guān)標(biāo)準(zhǔn), 按照其分別起到的作用, 大致可以分為4類(表1)��。第1類是產(chǎn)品通則, 包括<381><660><661><670>等��。第2類是藥包材通用要求, 如<659>等�����。第3類是性能測定標(biāo)準(zhǔn), 包括保護性功能性生物反應(yīng)性性能等的測試方法, 如<87><88><382><671>等�����。第4類屬于通用信息, 對涉及不同種類藥包材的使用評價完整性評價功能性評價相容性研究評價規(guī)范等內(nèi)容加以說明, 包括<1031><1381><1382><1178><1207><1660><1661><1663><1664>等����。此外, 值得注意的是, 第4類標(biāo)準(zhǔn)是非強制性標(biāo)準(zhǔn)��。
2.2 USP藥包材標(biāo)準(zhǔn)內(nèi)容
USP中涉及藥包材的相關(guān)章節(jié)分布于通用章節(jié)(general chapters)中, 其中又分為通用檢查與測定法(general tests & assays)和通用信息(general information)章節(jié)����。通用檢查與測定法章節(jié)一般屬于強制執(zhí)行的內(nèi)容(除非另有規(guī)定), 包括了對藥包材的通用要求, 以及塑料材料及包裝系統(tǒng)�����、彈性體密封件��、玻璃容器和輔助組件的產(chǎn)品標(biāo)準(zhǔn), 還包括對藥包材功能性的測定方法��。通用信息章節(jié)主要提供對于藥包材生產(chǎn)�����、使用和評價方面的一些指導(dǎo)性意見, 屬于信息類非強制性標(biāo)準(zhǔn)��。
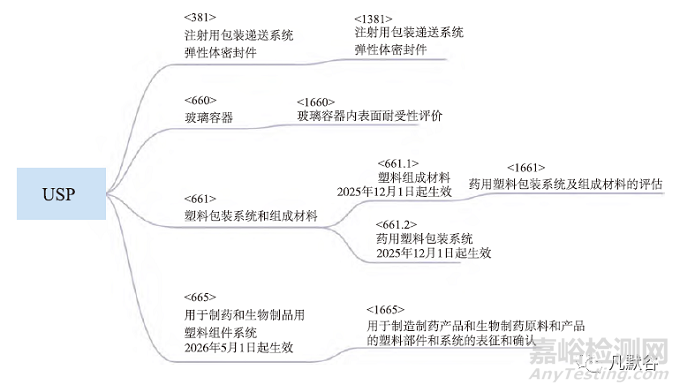
對于彈性體密封件, <381>標(biāo)準(zhǔn)提供了注射用彈性體密封件材料的方法及規(guī)范��。內(nèi)容包含引言����、范圍�����、試樣��、測試步驟(包含生物反應(yīng)性、物理化學(xué)實驗��、功能性的程序和要求)����。USP<1381>主要闡述USP<381>的應(yīng)用及適用性, 在USP<381>中提供的基線要求之外, 彈性體需要符合藥品質(zhì)量風(fēng)險水平的預(yù)期用途及彈性體成分的評估。此外, 值得注意的是將于2025年12月1日生效的USP<382>已公開發(fā)布, 在<382>正式生效之前, 使用<381>中描述的彈性組件功能適用性測試范圍�����。而注射產(chǎn)品用彈性體密封件包裝/輸送系統(tǒng)功能適用性的檢測方法及評估方法可以參考<1382>����。
對于玻璃容器, <660>對安瓿、注射劑瓶����、注射器等玻璃容器提供了檢測方法及規(guī)范。<660>內(nèi)容分為定義�����、特定測試(包含顆粒耐水性�����、內(nèi)表面耐水性, 表面腐蝕測試)�����、雜質(zhì)(砷), 功能性測試(有色玻璃透光率)等����。此外<1660>提供了玻璃容器的類型、生產(chǎn)過程����、內(nèi)表面耐受性影響因素, 同時推薦了內(nèi)表面耐水性的評價方法。

對于塑料包裝系統(tǒng), <661>為用于藥品包裝(藥品�����、生物制劑和膳食補充劑)的塑料制品(材料����、組件和系統(tǒng))提供檢測方法及規(guī)范。<661>內(nèi)容包含引言��、聚乙烯容器����、聚丙烯容器����、聚對苯二甲酸乙二醇酯容器��、測試方法(多重內(nèi)表面反射�����、熱分析����、生物測試、理化測試)等內(nèi)容����。未來, USP塑料包裝系統(tǒng)將目前的<661>章節(jié)細化分為兩個子章節(jié)分為章節(jié)<661.1><661.2>, 對塑料的組成材料、塑料包裝系統(tǒng)分別建立質(zhì)量標(biāo)準(zhǔn), 新的章節(jié)將在2025年12月1日正式生效, 同時<661.1>除原有的聚乙烯����、聚丙烯、聚對苯二甲酸乙二醇酯外, 涵蓋了更多的材料類型, 包含環(huán)烯烴聚合物�����、聚酰胺6、聚碳酸酯��、聚乙烯��、乙烯-乙酸乙烯酯共聚物��、聚丙烯����、聚氯乙烯����、塑化聚氯乙烯等。<1661>為通用信息類章節(jié), 是配套<661>建立塑料材料和容器的評估方法, 同時為<661.1><661.2>的提供補充信息和應(yīng)用說明��。
<665>為生產(chǎn)用塑料組件和系統(tǒng)提供評價方法, 將于2026年5月1日生效��。USP<1665>介紹了塑料組件系統(tǒng)在制藥和生物制品中的評估應(yīng)用方法����。但值得注意的是, <665>雖為USP<1000>以下章節(jié), 但為非強制性標(biāo)準(zhǔn)。
對于生物相容性, <87>主要描述了體外生物反應(yīng)性實驗的檢測方法, 以用于確定直接或間接接觸彈性體��、塑料和其他高分子材料或從被測材料制備的特定提取物接觸后的生物反應(yīng)性�����。<88>主要描述了體內(nèi)生物反應(yīng)性試驗的檢驗方法(包含全身注射試驗、皮內(nèi)試驗��、植入試驗等)��。<1031>主要以USP<87><88>的試驗指導(dǎo)為基礎(chǔ)方法, 為評估藥物容器��、彈性密封件����、醫(yī)療器械和植入物生物相容性研究評價提供指導(dǎo)。
USP中其他方面, <659>提供了包裝定義�����、輔助包裝信息和與有效成分��、輔料和醫(yī)療產(chǎn)品(如藥品����、組合產(chǎn)品, 以及標(biāo)簽和為符合USP要求的膳食補充劑)貯運相關(guān)的包裝、輔助包裝信息和貯存條件的定義和要求����。<670>為用來支持或增強容器封閉系統(tǒng)的輔助包裝組件, 這些組件包括但不限于制藥線圈和容器用干燥劑等����。<671>主要提供用于固體口服制劑和液體口服制劑的包裝系統(tǒng)功能特性的標(biāo)準(zhǔn)��。<1671>配套<671>主要提供了塑料包裝固體口服制劑水蒸氣透過率的評價方法, 包含干燥劑法和水作為替代灌裝溶劑的方法, 同時提出了再包裝的相關(guān)評價指南及術(shù)語定義����。
<1178>提供指導(dǎo)口服固體藥品的重新包裝, 包含從原始容器封閉系統(tǒng)中取出藥物, 并將它們重新包裝到不同的容器封閉系統(tǒng)中進行銷售和(或)進行分發(fā)的相關(guān)要求和定義�����。
<1207><1207.1><1207.2><1207.3>闡述了無菌產(chǎn)品包裝完整性評價的指導(dǎo)原則, 包括泄露原理�����、無菌環(huán)境的控制��、泄露測試技術(shù)�����、密封質(zhì)量測試技術(shù)等, 同時也對相關(guān)的專業(yè)術(shù)語進行定義����。
<1663>闡述了藥用包裝/給藥系統(tǒng)相關(guān)可提取物方法的建立及評估, <1664>闡述了藥用包裝/給藥系統(tǒng)相關(guān)浸出物的評估方法����。此外<1664>的子章節(jié)<1664.1>主要闡述經(jīng)口鼻吸入給藥制劑中可浸出物的評估方法以及一些特定術(shù)語的規(guī)定。
2.3 USP藥包材標(biāo)準(zhǔn)內(nèi)容分析
FDA藥包材指南—容器密封包裝系統(tǒng)指南[3]是FDA藥包材工業(yè)指南, 對藥包材藥學(xué)研究資料提出了框架指引, 對不同類型的包裝系統(tǒng)基于藥包材包裝制劑的風(fēng)險程度和藥包材與藥品相互作用的可能性, 提出了“四性”(即保護性����、功能性、安全性和相容性)評價等相關(guān)要求, 為備案及審評提供了重要參考����。USP通過強制性和信息性的藥包材標(biāo)準(zhǔn)章節(jié)的收載對FDA藥包材指南—容器密封包裝系統(tǒng)指南[7]對藥包材的“四性”從藥典標(biāo)準(zhǔn)層面有著較好的標(biāo)準(zhǔn)對接。
關(guān)注材料容器系統(tǒng)的化學(xué)安全性(圖1)和生物安全性: <660><661>關(guān)注材料本身的類型, 塑料制品通過紅外光譜(infrared spectrophotometry, IR)和差示掃描量熱法(differential scanning calorimetry, DSC)進行鑒定和表征, 玻璃通過顆粒法耐水性進行鑒別分類�����。<381><660><661>(塑料����、彈性體密封件、玻璃材料及容器)關(guān)注物理化學(xué)測試, 結(jié)合產(chǎn)品自身的特點和包裝藥品劑型的風(fēng)險程度, 設(shè)計關(guān)鍵質(zhì)量屬性的項目����。<1381><1660><1661>提供塑料、彈性體密封件����、玻璃化學(xué)評估的方法與要求�����。USP中<1381><1660><1661>3個章節(jié)對材質(zhì)的化學(xué)安全性評價提供了評價方法標(biāo)準(zhǔn)�����。同時, USP關(guān)注材料容器系統(tǒng)的生物安全性: <1031>提供材料浸出物生物相容性評價指南, <87><88>等提供配套檢測方法��。
圖1 USP 材料與材料評估藥包材標(biāo)準(zhǔn)框架
Fig.1 Framework of USP pharmaceutical packaging material standards about material and material evaluation
關(guān)注材料容器系統(tǒng)的功能性評價: 對于彈性體密封件在目前現(xiàn)行有效的USP<381>中涵蓋穿刺力��、穿刺落屑、自密封性3個質(zhì)量控制項目, 但將于2025年12月1日生效的USP<382>將對于USP<381>中涉及的功能性評價內(nèi)容單獨成章, 標(biāo)準(zhǔn)項目涵蓋包裝/交付系統(tǒng)完整性、針頭��、針尖功能適用性��、柱塞功能適用性����、柱塞功能適用性、護帽功能適用性等��。同時, <1382>闡述了彈性體密封件功能適用性評估方法����。
關(guān)注材料容器系統(tǒng)的保護性: 對于無菌產(chǎn)品的完整性, <1207><1207.1><1207.2><1207.3>系列標(biāo)準(zhǔn)為無菌產(chǎn)品完整性評價提供檢測方法選擇和驗證、檢測技術(shù)等指引����。而塑料容器及其部件的功能性的標(biāo)準(zhǔn)和檢驗請參見容器性能檢驗<671>, 對于塑料材質(zhì)功能適用性USP<671>主要提供了用于固體、液體口服劑型的塑料包裝系統(tǒng)的水蒸氣透過率和包裝系統(tǒng)透光率測試等的標(biāo)準(zhǔn)及方法����。
關(guān)注材料容器系統(tǒng)的相容性: <1663><1664><1664.1>對藥品包裝系統(tǒng)的可提取物、浸出物�����、經(jīng)口鼻吸入給藥制劑的浸出物提供研究評價指南��。
3、USP最新進展
USP論壇(pharmacopeia forum, PF)是USP標(biāo)準(zhǔn)建立與修訂的在線信息發(fā)布平臺����。新標(biāo)準(zhǔn)或修訂標(biāo)準(zhǔn)在正式生效前, 通常以提案形式在PF上公示, 每兩個月就擬增修訂藥典標(biāo)準(zhǔn)公開征求意見, 并一般開放90d評議期接受公眾評議。近2年來藥包材標(biāo)準(zhǔn)內(nèi)容陸續(xù)更新(表2)����。PF有效促進了標(biāo)準(zhǔn)的溝通交流與社會共同參與標(biāo)準(zhǔn)制修定。其中<383>為首次修訂, 為用于藥品包裝和生產(chǎn)部件的硫化硅橡膠彈性體提供技術(shù)標(biāo)準(zhǔn), 包含鑒別�����、理化檢查�����、生物反應(yīng)性等項目��。
4����、討論
我國正在加快推進«中華人民共和國藥典»藥包材標(biāo)準(zhǔn)體系的構(gòu)建, 在藥包材標(biāo)準(zhǔn)的制定中, 充分發(fā)揮藥典標(biāo)準(zhǔn)法典的核心作用, 補齊藥典藥包材標(biāo)準(zhǔn)的短板[4], 以下這些方面都可以學(xué)習(xí)借鑒USP的藥包材標(biāo)準(zhǔn)內(nèi)容�����。
我國正在加快推進«中華人民共和國藥典»藥包材標(biāo)準(zhǔn)體系的構(gòu)建, 在藥包材標(biāo)準(zhǔn)的制定中, 充分發(fā)揮藥典標(biāo)準(zhǔn)法典的核心作用, 補齊藥典藥包材標(biāo)準(zhǔn)的短板, 以下這些方面都可以學(xué)習(xí)借鑒USP的藥包材標(biāo)準(zhǔn)內(nèi)容�����。
同時, 我國已加入人用藥品技術(shù)要求國際協(xié)調(diào)理事會(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH), 已實施和正在制修訂的ICH相關(guān)指導(dǎo)原則均將逐步轉(zhuǎn)化落地。因此, 未來«中華人民共和國藥典»相關(guān)章節(jié)與ICH的協(xié)調(diào)勢在必行, 相關(guān)研究和積累也將迫切重要����。其中, ICH Q3是一個非常重要的章節(jié), 主題是關(guān)于雜質(zhì)研究, 目前ICH有4個章節(jié)分別為ICH Q3A、Q3B����、Q3C和Q3D。對于包裝材料雜質(zhì)相關(guān)領(lǐng)域, ICH Q3E藥品和生物制品的可提取物浸出物控制與評估于2019年6月由ICH大會批準(zhǔn), 并正在逐步建立過程中, 雜質(zhì)檢測指南計劃2025年5月完成Step4通過最終指導(dǎo)原則[8]����。ICH Q3E章節(jié)的建立將規(guī)范可提取物浸出物控制與評估方法。而對于可提取物浸出物“現(xiàn)有指南��、藥典和其他涉及可提取物和可浸出物的標(biāo)準(zhǔn)之間缺乏一致性�����、共識和明確性[9]�����。”對比各國藥典, 目前只有USP在<1663><1664><1664.1>等章節(jié)詳述了可提取物浸出物評估方法?�?山梃bUSP, 加強研究可提取物浸出物評價方法標(biāo)準(zhǔn)積累與構(gòu)建, 對接ICH Q3E[10]出臺, 未來逐步完成藥典方法的轉(zhuǎn)化�����。
最后, 目前USP藥包材標(biāo)準(zhǔn)主要集中在玻璃����、塑料、橡膠3類材質(zhì), 金屬藥包材涵蓋高�����、中��、低風(fēng)險藥品劑型, 包含保障藥品保護性的輔助包裝組件等��。金屬類藥包材標(biāo)準(zhǔn)研究基礎(chǔ)弱, 體系不完善, 但也是近期各國藥典關(guān)注的重點領(lǐng)域之一��。2021年, 中美藥典基于互信��、平等����、務(wù)實的合作理念建立了金屬類藥包材標(biāo)準(zhǔn)工作組, 雙方專家共同探討并推進金屬類藥包材標(biāo)準(zhǔn)的建立[11], 通過公開征集參與單位[12]、征求意見建議[13]等方式, 已初步確定«中華人民共和國藥典»金屬類藥包材標(biāo)準(zhǔn)體系規(guī)劃�����。未來, 借鑒USP逐步完善藥包材標(biāo)準(zhǔn)體系的建設(shè), 夯實不同材料的通用要求, 嘗試建立«中華人民共和國藥典»金屬類藥包材通則, 藥典藥包材標(biāo)準(zhǔn)從跟跑到并跑, 并嘗試逐步領(lǐng)跑, 建立起由塑料��、橡膠����、玻璃、金屬的通用要求, 延伸到對陶瓷��、紙類等藥包材的標(biāo)準(zhǔn), 借鑒國內(nèi)外經(jīng)驗, 立足我國國情, 進一步完善藥包材標(biāo)準(zhǔn)框架體系, 構(gòu)建中國藥包材標(biāo)準(zhǔn)體系, 推動藥包材及藥品行業(yè)的高質(zhì)量發(fā)展����。
來源:《醫(yī)藥導(dǎo)報》 2023 年7月第42 卷第7 期