導(dǎo) 讀
本文簡單介紹了PFA的歷史應(yīng)用到如今爆火的心臟消融領(lǐng)域的發(fā)展歷程�,著重介紹了影響PFA作用效果的影響因素�,核心零部件以及系統(tǒng)組成�,最后總結(jié)了PFA在心臟電生理治療的潛在風(fēng)險。
一����、脈沖電場發(fā)展歷程1
脈沖電場消融(pulsed field ablation, PFA)指在非常短的時間內(nèi)(ms、μs���、ns)應(yīng)用間歇性的高強度脈沖電場��,造成細(xì)胞膜電穿孔的不可逆性損傷(IRE)。
該技術(shù)始于上世紀(jì)六十年代食品和水消毒領(lǐng)域�,八十年代初,嘗試應(yīng)用直流電脈沖消融心動過速�,也是該技術(shù)首次用于心臟領(lǐng)域��,由于當(dāng)時對電脈沖的認(rèn)識不足,安全性無法保證而終止����;
Neumann在1982年首先應(yīng)用電穿孔技術(shù)將外生的DNA引入到小鼠的淋巴瘤細(xì)胞內(nèi)。細(xì)胞膜在一定強度的脈沖電場中可以發(fā)生RE����,這一現(xiàn)象隨后被廣泛應(yīng)用于基因工程,藥物篩選和電化學(xué)治療�;
本世紀(jì)初,Davalos教授應(yīng)用脈沖電場成功地破壞了實體腫瘤組織��;
2012年�����,F(xiàn)DA批準(zhǔn)基于高頻脈沖電場的納米刀技術(shù)用于腫瘤治療�。同年,F(xiàn)red首次應(yīng)用脈沖電場技術(shù)和環(huán)形電極對豬的心外膜心肌組織進行消融���,驗證了脈沖電場在心肌組織內(nèi)可以形成連續(xù)的損傷����,脈沖電場造成的損傷深度,足可以實現(xiàn)肺靜脈的隔離����;
2018年,Reddy教授首次在房顫患者中應(yīng)用PFA技術(shù)進行了肺靜脈消融����,15例心內(nèi)膜消融患者即刻成功率100%,每位患者總的PFA時間<60s�����,無嚴(yán)重并發(fā)癥����。
近些年國內(nèi)外公司已經(jīng)基于PFA原理進行大規(guī)模的心臟電生理消融臨床試驗, 2021年初����,F(xiàn)arapulse PFA 系統(tǒng)獲 CE 批準(zhǔn)上市,國內(nèi)也誕生了大量相關(guān)企業(yè)����,對 PFA 的開發(fā)趨于白熱化,技術(shù)也向更加快速化���、精準(zhǔn)化��、整合化的方向發(fā)展��。
二����、脈沖電場消融的影響因素
1.脈沖電場生物學(xué)基礎(chǔ)
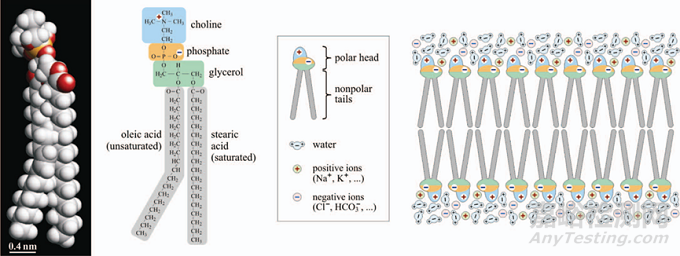
每個生物細(xì)胞都被雙層脂質(zhì)質(zhì)膜包圍�,其中含有多種蛋白質(zhì),用作離子泵或通道�,允許特定分子在細(xì)胞內(nèi)部和外部之間運輸。對于其他物質(zhì)��,細(xì)胞膜充當(dāng)生物屏障���,保護細(xì)胞免受環(huán)境影響�。質(zhì)膜的脂質(zhì)由親水(極性)和疏水(非極性)部分組成��。細(xì)胞與離子泵和通道一起維持質(zhì)膜內(nèi)側(cè)和外側(cè)之間的電勢差����。在真核細(xì)胞中�,靜息跨膜電壓范圍為-40至-70 mV2���。
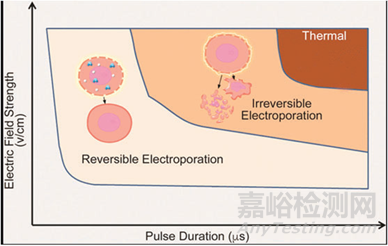
當(dāng)生物膜暴露于足夠高的外部電場可導(dǎo)致其電導(dǎo)率和滲透性快速大幅增加。這種效應(yīng)通常被稱為膜電穿孔。根據(jù)電場的強度對細(xì)胞莫得影響分為可逆電穿孔和不可逆電穿孔���。對于心律失常治療��,目標(biāo)達到不可逆電穿孔狀態(tài)從而阻滯異常電信號的傳導(dǎo)����。
不可逆電穿孔受到多重因素影響���,其中最重要的是電穿孔閾值因細(xì)胞而異,據(jù)報道在 200 至 500 mV 之間。電穿孔效果很大程度上取決于所施加的電穿孔信號的精確再現(xiàn)性���。由于電穿孔過程是由局部電場驅(qū)動的,因此在大多數(shù)情況下輸出電壓是受控的�����。電穿孔信號的特征在于電場強度����、脈沖幅度和持續(xù)時間���、脈沖數(shù)量���、脈沖重復(fù)頻率和換向序列3����。
2.電場強度
電穿孔對組織產(chǎn)生作用的基礎(chǔ)是電場強度����。傳遞的電場越強����,對目標(biāo)組織的影響越大。但隨著電場強度的增加����,產(chǎn)生熱量的風(fēng)險也會增加����,從而導(dǎo)致熱效應(yīng)的轉(zhuǎn)變���。如下圖所示:脈沖越長�����、電壓越大�,造成不可逆?zhèn)蜔釗p壞的可能性就越大4。
3.脈沖數(shù)和脈沖重復(fù)率
增加脈沖數(shù)量和脈沖重復(fù)頻率通常會增加觀察到的總體效果�,但是這種關(guān)系不是完全線性關(guān)系。
目前尚不清楚需要施加的脈沖數(shù)量是否有一個臨界閾值�,但一些單細(xì)胞數(shù)據(jù)提示���,當(dāng)施加超過16個脈沖時�����,通透性或50%細(xì)胞群的死亡沒有顯著差異5。
電穿孔依賴于脈沖重復(fù)率�����,但目前文獻并沒有取得一致的認(rèn)同關(guān)系�����。在一系列體內(nèi)和體外實驗中��,有報道說隨著重復(fù)次數(shù)的增加����,效果會降低或者效果會提高���。
4.脈沖時間
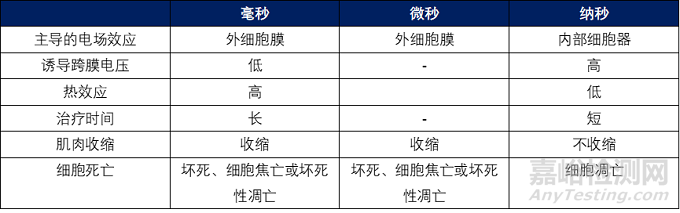
脈沖持續(xù)時間的增加將對細(xì)胞產(chǎn)生更大的電穿孔效應(yīng)���。對于較長的脈沖����,需要較低的電壓來維持相同數(shù)量的電穿孔細(xì)胞,是一種非線性關(guān)系��,特別是當(dāng)持續(xù)時間<1毫秒時,需要更高的電壓才能達到相同的效果���。例如���,當(dāng)電場強度為137 V/cm時����,100 ms脈沖可以導(dǎo)致細(xì)胞電穿孔�����,當(dāng)電場增加到575 V/cm����,100μs 即可導(dǎo)致細(xì)胞電穿孔,當(dāng)電場強度升到10 kV/cm����,獲得相同效果時僅用150 ns脈沖6��。
5.脈沖形狀
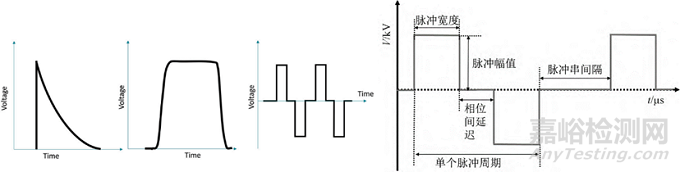
典型的脈沖電場(PEF)系統(tǒng)使用直流 (DC) 電源對電容器充電,然后在高壓開關(guān)的幫助下對電容器進行放電(脈沖)����。PEF有多種脈沖波形,包括方波�����、指數(shù)波、雙相波和正弦波��。方波是醫(yī)學(xué)上最常用的�,并且可以以相對較高的頻率傳送多個脈沖。方波有許多參數(shù)��,包括脈沖持續(xù)時間�、上升和下降時間以及幅度����。雙極高頻脈沖在高頻(高達 1 MHz)下使用多個非常短的脈沖(低至不到一微秒)可以防止肌肉收縮�����,產(chǎn)生有效的損傷的同時還會帶來最小的疼痛或沒有疼痛。
6.電極方向
電極方向相對于消融組織的纖維取向(各向異性)對觀察到的效果具有重要影響�。當(dāng)平行于組織纖維施加類似的電場時,觀察到比垂直于組織施加電場時更大的電穿孔效應(yīng)��。
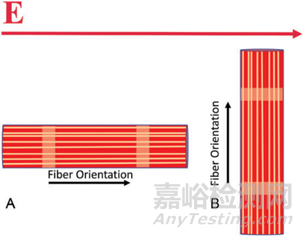
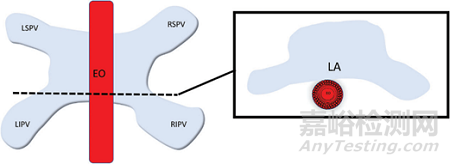
肌纖維的取向也對組織選擇性的優(yōu)勢起作用�。例如���,食道既有縱向肌纖維也有圓形肌纖維����,電場穿透縱向纖維;當(dāng)它到達垂直的圓形纖維時����,收到的 PEF效應(yīng)比較小��。如下圖所示:LA����,左心房;LSPV,左上肺靜脈; LIPV�����,左下肺靜脈; RSPV�,右上肺靜脈; RIPV�,右下肺靜脈�。
7.細(xì)胞選擇特異性7
當(dāng)跨膜電壓達到每個組織或細(xì)胞特有的某個閾值時�����,電穿孔現(xiàn)象就會發(fā)生�。心臟細(xì)胞的 IRE 閾值低于周圍組織的 IRE 閾值����,例如神經(jīng) (3,800 V/cm)、血管平滑肌細(xì)胞或內(nèi)皮細(xì)胞(1,750 V/cm)��。
心臟電穿孔閾值的個體化數(shù)據(jù)源自細(xì)胞研究�����。然而����,不同的非標(biāo)準(zhǔn)化電穿孔方案所應(yīng)用的脈沖參數(shù)(或脈沖參數(shù)定義)不一致以及使用不同的電穿孔發(fā)生器導(dǎo)致數(shù)據(jù)的可比性��、再現(xiàn)性不一致��。大鼠成肌細(xì)胞為 375 V/cm,大鼠心室細(xì)胞為 500 V/cm(導(dǎo)致 80% 細(xì)胞死亡)����,人心肌細(xì)胞為750 V/cm ,和另一個心臟細(xì)胞系為1,250 V/cm�。所以每一個電脈沖消融系統(tǒng)都需要探索其特定模式下的相關(guān)電穿孔參數(shù)����。
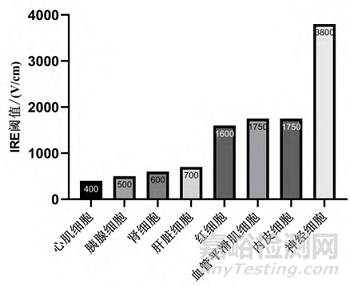
圖 不同類型細(xì)胞的 IRE 閾值
三���、PFA的發(fā)生
脈沖發(fā)生器系統(tǒng)一般由電源���、存儲單元�、快速開關(guān)、觸發(fā)電路�、負(fù)載構(gòu)成。
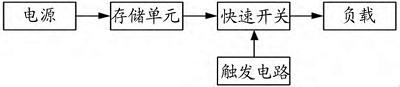
電源能持續(xù)穩(wěn)定地將電能存儲在儲能單元中����,儲能單元存儲足夠的能量后�,控制觸發(fā)電路產(chǎn)生觸發(fā)信號,驅(qū)動快速開關(guān)導(dǎo)通或關(guān)斷���,使儲能單元的能量在一瞬間被釋放,輸出到負(fù)載上形成高壓脈沖8����。
依據(jù)儲能單元不同,脈沖功率技術(shù)中常用的儲能單元可以分為電容型儲能和電感型儲能。典型的納秒脈沖發(fā)生器有9:
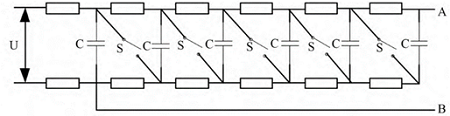
馬克思發(fā)生器( MARX):利用低壓直流電源 U 對電容 C并聯(lián)充電�,再利用開關(guān) S 使所有電容支路串聯(lián)放電��,在AB端輸出高電壓脈沖信號�����。
Blumlein傳輸線(Blumlein Transmission Line):U0 為高壓直流電源��, Ri 為充電電阻����,單根傳輸線長度為 l,特性阻抗為 Z�����, S 為放電開關(guān), R 為負(fù)載電阻�����,其基本工作原理是高壓直流電源經(jīng)過充電電阻將兩個串聯(lián)的傳輸線充電至 U0��。當(dāng)負(fù)載匹配���,開關(guān) S閉合時�,負(fù)載電阻兩端可得到幅值為 U0 的電脈沖�。
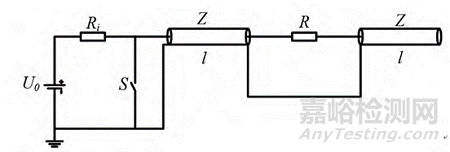
目前臨床上使用的納秒脈沖消融腫瘤設(shè)備也大多是基于這些原理并加以改良而制造的。想要獲得納米級脈沖�����,快速開關(guān)是核心器件既要實現(xiàn)納秒級快速導(dǎo)通和關(guān)斷���,又要能夠承受數(shù)十千伏甚至上百千伏的高壓。納秒脈沖消融腫瘤設(shè)備對快速開關(guān)要求十分嚴(yán)苛����,傳統(tǒng)的開關(guān)器件雖然輸出電壓較高,但體積大���、成本高且壽命有限��。
近年來現(xiàn)代功率半導(dǎo)體技術(shù)的發(fā)展�����,新型半導(dǎo)體開關(guān)器件的開關(guān)速度和耐壓有很大提升�����,給納秒脈沖功率技術(shù)帶來了新的方向����。
四、PFA的潛在風(fēng)險和不良反應(yīng)
脈沖電場作為新的消融能量在心律失常領(lǐng)域展現(xiàn)了安全和高效的優(yōu)勢���,但同時還需要了解和關(guān)注這項技術(shù)目前存在的一些問題�����,包括高電壓的風(fēng)險�、骨骼肌收縮���、微泡現(xiàn)象等��。
1.高電壓的影響
更高的輸出電壓意味著更高的場強和可能更大的損傷范圍����。但是,過大的輸出電壓也會帶來安全性的風(fēng)險:包括出現(xiàn)熱效應(yīng)�、增加骨骼肌的收縮、微泡的形成���,甚至出現(xiàn)電弧�����。
電弧的出現(xiàn)可以造成局部組織的氣壓傷���,電弧還會造成血液在電極表面的結(jié)痂和凝結(jié),影響隨后的消融效果��。因此��,脈沖消融儀在參數(shù)設(shè)置上要有安全上限值�����,手術(shù)中對輸出電壓的調(diào)整不能超過安全上限��。另外��,脈沖消融儀還需要能夠?qū)崟r監(jiān)控是否發(fā)生了電弧���,如果發(fā)生�,需要能夠自動切斷后續(xù)脈沖波的輸出�。
2.骨骼肌收縮
骨骼肌收縮是PFA過程中常出現(xiàn)的伴隨癥狀,尤其是長時程的單相脈沖波消融時����。增加脈沖波的頻率,可以顯著減少骨骼肌的收縮和扭矩����。目前市場上用于房顫的主流脈沖消融儀器多采用高頻雙相脈沖波,采用較短時程的消融10����。
3.微泡現(xiàn)象
脈沖波發(fā)放時可以通過超聲監(jiān)測到微泡的發(fā)生。術(shù)中微泡的形成機制目前還不是非常明確����,可能的機制是血液中氮氣的水解或置換。多個脈沖參數(shù)(電壓����、脈寬等)的改變可以影 響 微泡的形成���。直徑<38μm的氣泡被認(rèn)為會迅速溶解(6-10s)��,不太可能導(dǎo)致腦血流受損11。目前對于PFA過程中微泡的影響��,還缺乏大樣本和長期的隨訪數(shù)據(jù)���,值得進一步探索�。
參考文獻:
[1] 徐劍剛,唐閩,梁明等.脈沖電場消融與細(xì)胞電穿孔:從基礎(chǔ)到臨床[J].中國心臟起搏與心電生理雜志,2022,36(05):404-406.
[2] Hartl S, Reinsch N, Füting A, Neven K. Pearls and Pitfalls of Pulsed Field Ablation. Korean Circ J. 2023 May;53(5):273-293.
[3] M. Rebersek, D. Miklavcic, C. Bertacchini and M. Sack, "Cell membrane electroporation-Part 3: the equipment," in IEEE Electrical Insulation Magazine, vol. 30, no. 3, pp. 8-18, May-June 2014
[4] Maor E, Sugrue A, Witt C, Vaidya VR, DeSimone CV, Asirvatham SJ et al. Pulsed electric fields for cardiac ablation and beyond: a state-of-the-art review. Heart Rhythm 2019;16:1112–20.
[5] Macek-Lebar A, Miklavcic DJR. Cell electropermeabilization to small molecules in vitro: control by pulse parameters. Oncology 2001;35. Retrieved from https://www.radioloncol.com/index.php/ro/article/view/1446
[6] Yao C, Lv Y, Zhao Y, Dong S, Liu H, Ma J. Synergistic combinations of short high-voltage pulses and long low-voltage pulses enhance irreversible electroporation efficacy. Sci Rep 2017;7:15123.
[7] Hartl S, Reinsch N, Füting A, Neven K. Pearls and Pitfalls of Pulsed Field Ablation. Korean Circ J. 2023 May;53(5):273-293.
[8] 吳啟翔,陳永剛,龔立嬌等.納秒脈沖電場腫瘤消融關(guān)鍵技術(shù)研究綜述[J].中國醫(yī)療設(shè)備,2023,38(05):36-43.
[9] 蔡焱. 高壓納秒時域信號源研究[D]. 西安: 電子科技大學(xué), 2019.
[10] Miklavcic D, Pucihar G, Pavlovec M, Ribaric S, Mali M, Macek-Lebar A, Petkovsek M, Nastran J, Kranjc S, Cemazar M, Sersa G. The effect of high frequency electric pulses on muscle contractions and antitumor efficiency in vivo for a potential use in clinical electrochemotherapy. Bioelectrochemistry. 2005 Feb;65(2):121-8.
[11] Douglas YL, Jongbloed MR, Gittenberger-de Groot AC, Evers D, Dion RA, Voigt P, Bartelings MM, Schalij MJ, Ebels T, DeRuiter MC. Histology of vascular myocardial wall of left atrial body after pulmonary venous incorporation. Am J Cardiol. 2006 Mar 1;97(5):662-70.