每個醫(yī)療器械制造商的目標是保持一致的質量,并保證一定水平的安全和有效性�����。為了實現(xiàn)這一點,制造商必須遵守一系列法律�����、標準和法規(guī)�����。遵守所有法規(guī)的目的是確?��;颊?����、用戶和第三方的產(chǎn)品安全�����。證明技術文件符合所有必要的要求是產(chǎn)品在特定市場成功注冊的關鍵��。
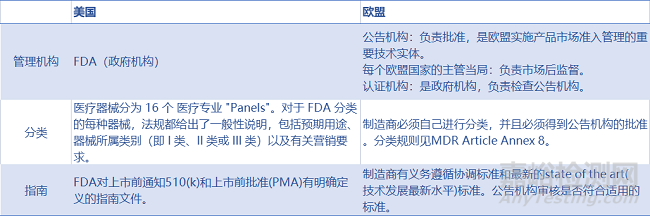
美國食品和藥物管理局(FDA)是美國的一個監(jiān)管機構��,負責批準即將進入美國市場的醫(yī)療器械��。歐盟醫(yī)療器械法規(guī)是由歐盟委員會公布的一套法規(guī)�����,以指導醫(yī)療器械制造商在將醫(yī)療器械投放市場之前符合法規(guī)要求���。FDA法規(guī)和歐盟MDR對各自的市場都是強制性的。
通常情況下���,在美國上市的醫(yī)療器械希望在歐盟市場注冊并銷售其醫(yī)療器械��,反之亦然���。在這種情況下,最大的問題是需了解兩方市場所要求的技術文件和上市路徑的異同�����。今天分別介紹FDA和CE法規(guī)要求的異同��,讓您發(fā)現(xiàn)醫(yī)療器械注冊過程的主要差異��,以及兩類監(jiān)管之間的相似之處���。對于希望在兩個市場上銷售產(chǎn)品的制造商來說���,了解哪些文件可以被兩個市場使用��,以及哪些文件是特定于某個市場的��,是很有幫助的�����!
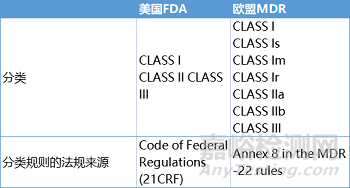
1�����、分類
根據(jù)對病人和/或最終用戶影響的嚴重程度��,每種醫(yī)療器械都被劃分為一定的風險等級��。每個等級都有不同的風險和相應的損害效應�����。
美國FDA和歐盟的《醫(yī)療器械注冊和登記條例》都規(guī)定了醫(yī)療器械的三個基本等級��。醫(yī)療器械分為低風險(I 級)��、中等風險(II 級)和高風險(III 級)��。在歐盟 MDR 中���,還有一些更詳細的子分類�����。
歐盟MDR的醫(yī)療器械根據(jù)MDR Annex 8中規(guī)定的規(guī)則進行分類,其中有22條規(guī)則���,所有醫(yī)療器械都能在這些描述中找到�����,針對醫(yī)療器械分類���,MDCG小組還發(fā)布了MDCG 2021-24“關于醫(yī)療器械分類的指導意見”。例外情況是���,隱形眼鏡等產(chǎn)品以及美容和紋身沙龍的某些器械也受到MDR法規(guī)的監(jiān)管���,盡管它們沒有嚴格定義的醫(yī)療目的。Annex 16提供了關于非醫(yī)療用途器械的更多信息��。
在美國市場,大多數(shù)醫(yī)療器械都可以通過21CFR Parts 862-892 中找到與器械相符的描述���,對器械進行分類�����。
如果一款新產(chǎn)品可以在以上法規(guī)部分中找到產(chǎn)品分類���,那么它可以通過上市前通知(510(k)),也可以通過上市前批準(PMA)�����。如果一款新產(chǎn)品不能根據(jù)21CFR 862-892進行分類�����,則自動被分為III類��,并必須通過上市前批準��。
510(k) 簡單來說就是依據(jù)已有同類產(chǎn)品獲得批準���。這意味著制造商的醫(yī)療器械與市場上已有的另一種醫(yī)療器械相似�����。其基本理念是�����,如果可以證明等同性���,那么產(chǎn)品就與同類產(chǎn)品一樣安全有效。FDA 必須審查 510(k) 并 "批準 "�����,然后制造商才能在美國合法銷售或分銷該產(chǎn)品���,或在美國銷售���。
如果產(chǎn)品屬于 I 類或 II 類,則適用 510(k)��。根據(jù) 21CFR Part 814的規(guī)定��,III 類的醫(yī)療器械必須通過 PMA ��。PMA 是一種監(jiān)管和科學程序,用于驗證醫(yī)療器械的安全性和有效性���。上市前批準的基礎是�����,產(chǎn)品的安全性和有效性在任何時候都有足夠的臨床研究和科學證據(jù)作保證���。如果醫(yī)療器械因尚未上市而無法與任何上游器械進行比較,則該器械將自動被歸入III類���。
2���、審批流程
審批流程是指醫(yī)療器械獲準投放市場的流程,本文為廣大制造商制作了審批流程差異表��,詳細分解歐盟MDR和美國FDA的審評差異��。
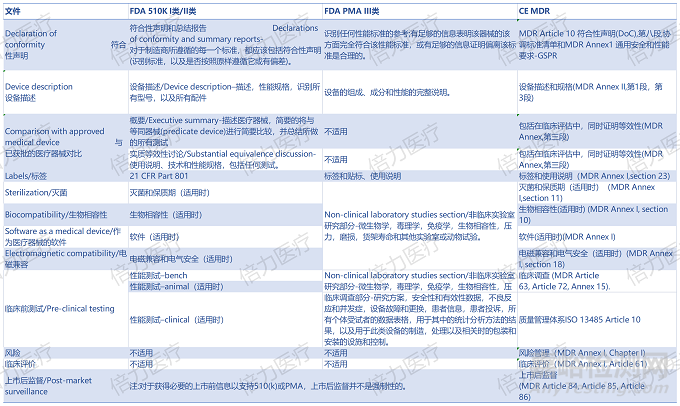
3���、技術文檔
在沒有系統(tǒng)性學習美國和歐盟的醫(yī)療器械法規(guī)時��,大部分人只是對FDA和CE的大致關鍵要素有些了解�����,比如:510K的本質是實質等同���、CE-MDR的法規(guī)本質是滿足法規(guī)的要求�����,臨床數(shù)據(jù)可以選擇等同器械的臨床文獻�����。那如何參照法規(guī)?如何搞懂全套技術文檔到底要什么�����?
注:本表只考慮與醫(yī)療器械直接相關的文件���,不包括申請 FDA 和公告機構所需的任何行政文件���。
FDA和CE的異同總結
大多數(shù)經(jīng)FDA批準的醫(yī)療器械都通過510K路徑獲得上市資格,除了與等同器械對比外,大部分情況下是不用提供臨床信息的��。因此這是和CE-MDR的最大區(qū)別��,在MDR法規(guī)下制造商將在根據(jù)MDR準備臨床評估方面付出很大努力��。
第二大區(qū)別是�����,上市后監(jiān)督不需要獲得FDA的批準���。因此�����,如果這是第一次在FDA注冊醫(yī)療器械���,那么制造商沒有建立上市后監(jiān)督系統(tǒng),而這對歐盟市場是強制性的���。對于在美國的公司�����,他們的產(chǎn)品已經(jīng)在市場上上市一段時間(II類和II類)��,根據(jù)FDA的section 522 ��,建立了a postmarket system�����。