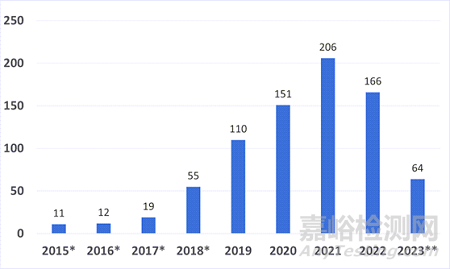
自2015年啟動(dòng)突破性醫(yī)療器械計(jì)劃到截至發(fā)文時(shí)間����,F(xiàn)DA已授予794個(gè)突破性醫(yī)療器械稱號(hào)��,其中786個(gè)來(lái)自CDRH����,8個(gè)來(lái)自生物制品和評(píng)估中心(Center for Biologics Evaluation and Research,簡(jiǎn)稱:CBER)����。
圖 按財(cái)政年度劃分的突破性設(shè)備稱號(hào)數(shù)量
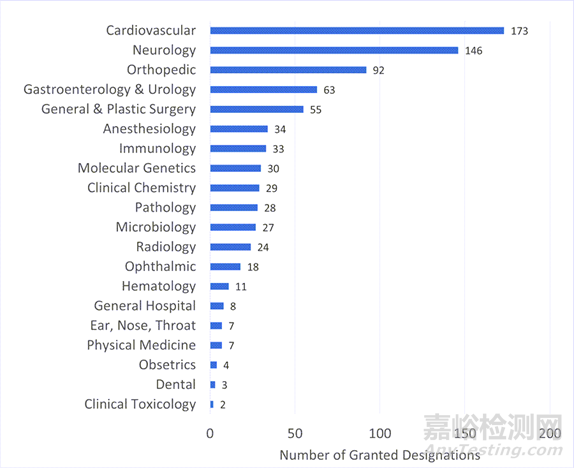
從突破性器械認(rèn)定結(jié)果來(lái)看��,心血管類(lèi)器械獲得認(rèn)定數(shù)量最多��。心血管類(lèi)器械以173個(gè)認(rèn)定數(shù)量領(lǐng)先��,而神經(jīng)病學(xué)小組以146個(gè)緊隨其后��。其他獲得突破性認(rèn)定的器械包括骨科��、消化內(nèi)科和泌尿外科��、普通外科和整形外科等�����。
圖 按臨床小組授予的突破性設(shè)備數(shù)量
FDA的“突破性設(shè)備”事實(shí)上代表了全球醫(yī)療器械創(chuàng)新的頂尖水平����。不過(guò)�����,入選“突破性設(shè)備”名單之后��,距離真正獲批上市還有一段距離。根據(jù)美國(guó)“突破性醫(yī)療器械計(jì)劃”����,截止2023年3月31日,共有67項(xiàng)上市許可��,包括65個(gè)CDRH設(shè)備和2個(gè)CBER設(shè)備����。
2022年全年共有19款“突破性設(shè)備”最終獲準(zhǔn)上市����。

FDA:19個(gè)設(shè)備獲得“突破性醫(yī)療器械”市場(chǎng)授權(quán)!如何才能獲得FDA的“綠色通道”����?
2023年,截至到發(fā)文時(shí)間為止����,共有5款“突破性設(shè)備”最終獲準(zhǔn)上市。
1����、產(chǎn)品名稱:RADIOTHERAPY SYSTEM(生物引導(dǎo)放射療法)
公司名稱:RefleXion Medical
產(chǎn)品介紹:
RefleXion Medical Radiotherapy System(RefleXion醫(yī)療放療系統(tǒng))是RefleXion公司于2022年2月2日獲批De Novo的醫(yī)療器械產(chǎn)品����。RefleXion是一家致力于研發(fā)生物引導(dǎo)放射療法(BgRT) 的癌癥治療公司��,曾研發(fā)出全球第一臺(tái)生物引導(dǎo)放射治療設(shè)備RefleXion X1��。RefleXion 的 SCINTIX ™生物引導(dǎo)放射療法獲得 FDA 批準(zhǔn)����,這是一種適用于早期和晚期癌癥的尖端療法。該技術(shù)嵌入到RefleXion Medical的X1機(jī)器中��,所采用的是PET引導(dǎo)的放射治療�����,不僅能夠?qū)崟r(shí)跟蹤多個(gè)腫瘤的運(yùn)動(dòng)����,甚至在患者呼吸、消化和移動(dòng)時(shí)也能正常發(fā)揮作用����,同時(shí)還能在最大限度地減少對(duì)周?chē)馄式Y(jié)構(gòu)的損害。
除了首次獲得FDA批準(zhǔn)外,Scintix系統(tǒng)還獲準(zhǔn)與最常見(jiàn)的PET示蹤劑——氟脫氧葡萄糖F18(fluorodeoxyglucose F 18)一起使用��。談到未來(lái)計(jì)劃��,RefleXion Medical表示����,他們目前正計(jì)劃對(duì)該技術(shù)進(jìn)行調(diào)整,以期與更廣泛的放射性藥物協(xié)同工作�����,而所有這些藥物都能更好地對(duì)各種類(lèi)型的癌癥作出反應(yīng)��。
2����、產(chǎn)品名稱:實(shí)驗(yàn)室創(chuàng)傷性腦損傷(TBI)血液測(cè)試
公司名稱:Abbott(雅培)
產(chǎn)品介紹:
臨床腦震蕩評(píng)估標(biāo)準(zhǔn)一直未曾改變�����,其臨床醫(yī)生都是利用格拉斯哥昏迷評(píng)分(Glasgow Coma Scale)和CT掃描來(lái)檢測(cè)腦組織損傷或病變�����。進(jìn)行血液檢測(cè)則有助于將不必要的CT掃描次數(shù)減少至40%,從而可能降低醫(yī)療保健系統(tǒng)和患者的成本以及他們?cè)诰驮\室所花費(fèi)的時(shí)間����,以免耽誤最佳治療。實(shí)驗(yàn)室創(chuàng)傷性腦損傷(TBI)血液測(cè)試是首個(gè)商業(yè)可用的實(shí)驗(yàn)室創(chuàng)傷性腦損傷(TBI)血液測(cè)試����,使其在美國(guó)醫(yī)院廣泛使用。這項(xiàng)測(cè)試在雅培的Alinity®i實(shí)驗(yàn)室儀器上運(yùn)行��,將為臨床醫(yī)生提供一種客觀的方法來(lái)快速評(píng)估輕度TBI(也稱為腦震蕩)患者����。
3、產(chǎn)品名稱:ReWalk™ Personal 6.0 外骨骼機(jī)器人
公司名稱:ReWalk
產(chǎn)品介紹:
ReWalk Personal系統(tǒng)使設(shè)備用戶能夠坐����、站、走��、轉(zhuǎn)身����,并能夠上下樓梯。ReWalk 用戶可以獨(dú)立操作系統(tǒng)�����。ReWalk Personal于2014 年獲得了 FDA 的上市許可。它是美國(guó)第一個(gè)獲得此許可的外骨骼�����。電池供電的系統(tǒng)具有輕便�����、可穿戴的外骨骼�����,在髖關(guān)節(jié)和膝關(guān)節(jié)處裝有電機(jī)��。ReWalker 使用其重心的細(xì)微變化來(lái)控制運(yùn)動(dòng)��。系統(tǒng)感測(cè)到上身的前傾����,開(kāi)始第一步��。重復(fù)的身體移動(dòng)會(huì)產(chǎn)生一系列模仿腿部功能性自然步態(tài)的步驟����。

4��、產(chǎn)品名稱:RemeOs™ 創(chuàng)傷螺釘
公司名稱:Bioretec公司
產(chǎn)品介紹:
RemeOs™ 由獨(dú)特的專(zhuān)利生物可吸收金屬合金制成����,由鎂����、鈣和鋅組成,都是人體新骨形成的必需元素����,Zn含量的組成可以控制降解吸收的速度。值得注意的是�����,RemeOs™ 不含任何對(duì)人體有害的材料����,如釔、釓����、釹或任何其他稀土元素 (REE)�����。RemeOs™ 創(chuàng)傷螺釘可以通過(guò)患者身體的自然愈合過(guò)程被新骨吸收和替換�����,無(wú)需在骨折和骨骼愈合時(shí)進(jìn)行植入物移除手術(shù)��。RemeOs™ 創(chuàng)傷螺釘獲得了FDA授予的突破性器械稱號(hào)�����,這不僅驗(yàn)證了該產(chǎn)品的優(yōu)勢(shì)��,也進(jìn)一步表明美國(guó)市場(chǎng)需要傳統(tǒng)金屬植入物的真正替代品��。

5����、產(chǎn)品名稱:MASIMO SAFETYNET OPIOID SYSTEM(阿片劑量監(jiān)測(cè)系統(tǒng))
公司名稱:MASIMO邁心諾醫(yī)療
產(chǎn)品介紹:
阿片類(lèi)藥物是從阿片(罌粟)中提取的生物堿及衍生物��,能緩解疼痛����,但長(zhǎng)期服用可上癮。該產(chǎn)品是業(yè)內(nèi)第一個(gè)通過(guò) FDA 批準(zhǔn)的阿片劑量監(jiān)測(cè)系統(tǒng)����,主要用于檢測(cè)阿片類(lèi)藥物引起的呼吸抑制。它與分布式架構(gòu)相結(jié)合����,可以發(fā)送警報(bào)給患者及其家人、朋友和護(hù)理人員�����。當(dāng)Opioid Halo認(rèn)定患者已經(jīng)服用過(guò)量阿片類(lèi)藥物且可能需要幫助時(shí)��,將自動(dòng)觸發(fā)可能導(dǎo)致派遣EMS(Emergency Medical Services����,緊急醫(yī)療服務(wù))的自動(dòng)健康呼叫。
什么是“突破性設(shè)備計(jì)劃”����?
突破性設(shè)備計(jì)劃(Breakthrough Devices Program) 是美國(guó)食品藥品監(jiān)督管理局(FDA)于2015年4月啟動(dòng)的一種加快醫(yī)療器械開(kāi)發(fā)和審查過(guò)程的“綠色通道”,讓患者能盡快獲得有效診斷或可治療危及生命疾病的醫(yī)療器械�����。
被FDA納入“突破性設(shè)備計(jì)劃”有什么好處?
FDA將被授予“突破性醫(yī)療器械”稱號(hào)的產(chǎn)品提供有關(guān)設(shè)備開(kāi)發(fā)����、臨床試驗(yàn)方案的優(yōu)先權(quán)審查、FDA審核團(tuán)隊(duì)支持以及產(chǎn)品商業(yè)化決策的交流服務(wù)�����。此舉可以大大推動(dòng)創(chuàng)新醫(yī)療器械的上市過(guò)程�����。