摘 要
人工智能/ 機(jī)器學(xué)習(xí)(AI/ML)用于醫(yī)藥產(chǎn)品臨床前、臨床開發(fā)����、生產(chǎn)、上市后監(jiān)測��,有望對醫(yī)藥產(chǎn)品開發(fā)和使用帶來深刻影響�����,同時對制藥行業(yè)和藥品監(jiān)管帶來機(jī)遇和挑戰(zhàn)����。為促進(jìn)相關(guān)領(lǐng)域的監(jiān)管工作,2023 年5 月FDA 發(fā)布《人工智能和機(jī)器學(xué)習(xí)用于藥品與生物制品開發(fā)的討論文件》��。本文通過對討論文件的探討�����,概述了 AI/ML 在藥品開發(fā)過程中的運(yùn)用現(xiàn)狀和潛在用途��,以及FDA 運(yùn)用AI/ML 的經(jīng)驗(yàn)��,并介紹了在藥品開發(fā)過程中運(yùn)用AI/ML 的考量因素��,旨在推動創(chuàng)新技術(shù)在醫(yī)藥產(chǎn)品領(lǐng)域的運(yùn)用,挖掘更多潛在效能��。
The application of artificial intelligence/machine learning (AI/ML) in preclinical, clinical development, manufacturing,and post-marketing surveillance of pharmaceutical products and devices is expected to have a profound impact on drug product development and use, while also posing challenges to the pharmaceutical industry and regulatory bodies. In order to promote regulatory work in related areas, the FDA released the Using Artificial Intelligence & Machine Learning in the Development of Drug & Biological Products: Discussion Paper and Request for Feedback in May 2023. This paper provides an overview of the current status and potential uses of AI/ML in drug development from the perspective of the discussion paper.It also highlights the experience of FDA in using AI/ML and introduces the considerations for using AI/ML in drug development,aiming to promote the application of innovative technologies in the pharmaceutical products field and explore its potential efficacy further.
關(guān)鍵詞
人工智能����;機(jī)器學(xué)習(xí);醫(yī)藥產(chǎn)品�����;開發(fā)
artificial intelligence; machine learning; pharmaceutical product; development
為進(jìn)一步推動相關(guān)領(lǐng)域的監(jiān)管工作�����,2023 年5 月��,美國食品藥品監(jiān)督管理局(FDA)藥品審評與研究中心(CDER)��、生物制品審評與研究中心(CBER)�����、器械與放射衛(wèi)生中心(CDRH)數(shù)字醫(yī)療卓越中心(DHCoE)聯(lián)合發(fā)布《人工智能和機(jī)器學(xué)習(xí)用于藥品與生物制品開發(fā)的討論文件》(Using Artificial Intelligence & Machine Learning in the Development of Drug & Biological Products :Discussion Paper and Request for Feedback)[1]�����,就在藥品、醫(yī)療器械(包括藥械組合產(chǎn)品)開發(fā)中運(yùn)用人工智能和機(jī)器學(xué)習(xí)向利益攸關(guān)方征詢建議��、意見�����。
數(shù)據(jù)采集和生成工具領(lǐng)域快速發(fā)展的技術(shù)創(chuàng)新�����,加上性能強(qiáng)大的信息管理����、交換系統(tǒng)和先進(jìn)的計(jì)算能力�����,有望改變藥品開發(fā)和使用方式[2]��。這一不斷發(fā)展的創(chuàng)新生態(tài)系統(tǒng)��,對制藥行業(yè)和藥品監(jiān)管帶來了獨(dú)特的機(jī)遇和挑戰(zhàn)����,如何抓住機(jī)遇�����、充分發(fā)揮創(chuàng)新潛力�����,更好地服務(wù)公眾�����,成為藥品監(jiān)管機(jī)構(gòu)��、制藥行業(yè)與利益攸關(guān)方共同面臨的問題��。
在整個藥品開發(fā)過程中����,如何充分利用人工智能和機(jī)器學(xué)習(xí)等創(chuàng)新技術(shù)����,需要藥品監(jiān)管機(jī)構(gòu)、制藥行業(yè)與利益攸關(guān)方達(dá)成共識����,建立有效的交流�����、對話��、協(xié)作機(jī)制。根據(jù)國際醫(yī)療器械監(jiān)管機(jī)構(gòu)論壇(IMDRF)人工智能醫(yī)療器械工作組(AIMD WG)N67《 機(jī)器學(xué)習(xí)賦能醫(yī)療器械:關(guān)鍵術(shù)語和定義》(Machine Learning-enabled Medical Devices: Key Terms and Definitions)�����,人工智能(artificial intelligence��,AI)屬于計(jì)算機(jī)科學(xué)�����、統(tǒng)計(jì)學(xué)和工程學(xué)的一個分支��,使用算法或模型來執(zhí)行任務(wù)與機(jī)器學(xué)習(xí)等��,做出決策����,開展預(yù)測[3]。機(jī)器學(xué)習(xí)(machine learning�����,ML)被認(rèn)為是AI 的一個子集,允許ML 算法通過對數(shù)據(jù)的分析來開發(fā)ML 模型����,無需編程經(jīng)驗(yàn)。AI/ML 涉及藥品開發(fā)�����、臨床試驗(yàn)��、生產(chǎn)和上市后安全監(jiān)測等階段[3]����。
《機(jī)器學(xué)習(xí)賦能醫(yī)療器械:關(guān)鍵術(shù)語和定義》中概述的多項(xiàng)AI/ML 科學(xué)與監(jiān)管科學(xué)原則,可能適用于所有醫(yī)藥產(chǎn)品��,包括與藥品一同使用的醫(yī)療器械的開發(fā)(包括但不限于組合產(chǎn)品����、配套器械和補(bǔ)充器械)。討論文件中涉及的醫(yī)療器械�����,包括幫助識別確認(rèn)藥品不良反應(yīng)、幫助定量給藥的醫(yī)療器械�����。
討論文件旨在與包括學(xué)術(shù)團(tuán)體��、研究機(jī)構(gòu)和技術(shù)開發(fā)機(jī)構(gòu)在內(nèi)的利益攸關(guān)方�����,促進(jìn)相互學(xué)習(xí)和討論��。了解認(rèn)識一些涉及相關(guān)技術(shù)運(yùn)用的初步想法和考量因素����,熟悉FDA 現(xiàn)行決策��、舉措����、規(guī)范和適用法規(guī),對新進(jìn)入藥品開發(fā)和人體受試者研究領(lǐng)域的機(jī)構(gòu)尤其有益����。
1�����、 討論文件的主題介紹
討論文件涉及AI/ML 現(xiàn)狀和潛在用途前景����、AI/ML 運(yùn)用的考量因素��、后續(xù)步驟和利益攸關(guān)方參與3 個主題����,分述如下。
1.1 AI/ML 現(xiàn)狀和潛在運(yùn)用前景
FDA 認(rèn)識到AI/ML 具備增強(qiáng)藥品開發(fā)的潛力����,包括有助于為患者更快提供安全有效的藥品;提供更廣泛的藥品可及途徑�����,從而提高健康公平性��;提高制藥質(zhì)量�����;提高藥品安全性;開發(fā)新藥和新藥物類別�����,以及個體化療法��。討論文件提供AI/ML 的用例,突出AI/ML 在整個藥品開發(fā)過程中的潛在影響����,同時概述FDA 對藥品開發(fā)中采用AI/ML 的經(jīng)驗(yàn),列舉可能適用或不適用于FDA 的用例,促進(jìn)共同交流��,確定對未來監(jiān)管清晰度可能有所幫助的領(lǐng)域����。
1.2 AI/ML 運(yùn)用的考量因素
FDA 認(rèn)識到AI/ML 等新興創(chuàng)新技術(shù)的潛在問題和風(fēng)險����,并將分享初步考量,征詢關(guān)于如何幫助確保在藥品開發(fā)過程中負(fù)責(zé)任地使用AI/ML 的建議、意見����。需要制定在不同應(yīng)用場景中使用AI/ML 的通用原則��、標(biāo)準(zhǔn)和規(guī)范�����,探討在將AI/ML 用于藥品開發(fā)活動時可能特別適用的原則和考量����。FDA 認(rèn)識到在藥品開發(fā)中運(yùn)用AI/ML 是多樣化的��,需要仔細(xì)評價�����,考慮具體運(yùn)用環(huán)境。采用基于風(fēng)險的方法來評價和管理AI/ML 的運(yùn)用����,助力創(chuàng)新,保護(hù)公眾健康��。
1.3 后續(xù)步驟和利益攸關(guān)方參與
FDA 重視與所有利益攸關(guān)方相互學(xué)習(xí)和接觸的機(jī)會�����,關(guān)注建立對AI/ML 系統(tǒng)及其在藥品開發(fā)中快速發(fā)展的潛在用途和考慮的共同理解��。為了啟動監(jiān)管機(jī)構(gòu)與利益攸關(guān)方的廣泛對話,關(guān)注相關(guān)議題的各方需要各抒己見��,積極參與��。
2��、 AI/ML 在藥品開發(fā)過程中的運(yùn)用現(xiàn)狀和潛在用途
藥品開發(fā)過程是一個連續(xù)的迭代活動,并不具備嚴(yán)格的線性特征��,但出于簡單起見����,從藥物發(fā)現(xiàn)和臨床研究到上市后安全監(jiān)測和先進(jìn)制藥等藥品開發(fā)的不同階段來描述AI/ML 用途�����。AI/ML還可用于支持藥品開發(fā)的真實(shí)世界數(shù)據(jù)和來自數(shù)字醫(yī)療技術(shù)數(shù)據(jù)處理�����。在不同的藥品開發(fā)用例中��,AI/ML 也同樣面臨挑戰(zhàn)和考量。
2.1 藥物發(fā)現(xiàn)
早期藥物發(fā)現(xiàn)是AI/ML 受到關(guān)注和被采用的主要領(lǐng)域之一����。AI/ML 已用于藥物靶點(diǎn)識別��、選擇和優(yōu)先級確定��,以及藥物發(fā)現(xiàn)的化合物篩選和藥物設(shè)計(jì)中����。
2.1.1 藥物靶點(diǎn)識別�����、選擇和優(yōu)先級確定
藥品開發(fā)早期階段����,通常依賴于初步確定候選藥物所需的適用生物靶點(diǎn)����。以此作為起點(diǎn),可以利用AI/ML 來分析和綜合來自現(xiàn)有科學(xué)研究��、出版物和其他數(shù)據(jù)來源的大量信息�����,識別確定生物靶點(diǎn)和闡明疾病關(guān)系的過程����。來自健康人群和特定疾病患者的可用基因組����、轉(zhuǎn)錄組�����、蛋白質(zhì)組和其他數(shù)據(jù)源的增長�����,為生物靶點(diǎn)的選擇提供重要機(jī)會��。這些數(shù)據(jù)集通常是復(fù)雜的����,來源各異����,可以很好地借助AI/ML 方法[4]����。
在現(xiàn)有驗(yàn)證數(shù)據(jù)的基礎(chǔ)上,AI/ML 可用于挖掘和分析這些大型多組學(xué)和其他數(shù)據(jù)集�����,提供有關(guān)生物靶點(diǎn)的潛在結(jié)構(gòu)和功能�����,預(yù)測相關(guān)靶點(diǎn)在疾病路徑中的作用[5-6]����。盡管在早期靶點(diǎn)識別和優(yōu)先排序中采用AI/ML 有助于提高藥品開發(fā)的效率和效果��,但需要通過后續(xù)研究驗(yàn)證生物靶點(diǎn)在相關(guān)疾病中的作用[4]��。
2.1.2 化合物篩選和設(shè)計(jì)
發(fā)現(xiàn)具有潛力的候選藥物��,通常需要對化合物庫進(jìn)行大量的虛擬或?qū)嶒?yàn)篩選,然后進(jìn)一步完善候選化合物對生物靶點(diǎn)的特異性和選擇性�����。在化合物篩選領(lǐng)域�����,AI/ML 的潛在用途包括預(yù)測化合物化學(xué)性質(zhì)與生物活性�����,并根據(jù)化合物對靶點(diǎn)特異性和親和力預(yù)測潛在療效與不良事件[4,7-8]�����。
AI/ML 也可用于進(jìn)一步闡明藥物- 靶點(diǎn)間的相互作用,提供可能與相同靶點(diǎn)相互作用的藥物類別預(yù)測或類似的作用機(jī)制��,根據(jù)分子已知特征預(yù)測分子毒性��,指導(dǎo)藥物改變用途(drug repurposing)。使越來越多來自各種來源(例如��,電子病歷��、臨床試驗(yàn)登記)獲得的適用的真實(shí)世界數(shù)據(jù)(來自電子病歷�����、登記和數(shù)字醫(yī)療技術(shù))受益����,利用AI/ML 的藥物改變用途,有助于確定先前未知的藥物對疾病路徑的影響[9]����。
此外����,AI/ML 還可以加速從頭藥物設(shè)計(jì)(de novo drugdesign)[10]��。例如����,AI/ML 可用于幫助預(yù)測靶標(biāo)蛋白的三維結(jié)構(gòu),為化學(xué)合成和候選藥對靶標(biāo)的潛在影響提供信息��,包括預(yù)測親和力和潛在毒性[11-13]��。值得注意的是�����,在3D 結(jié)構(gòu)預(yù)測中需要慎重使用AI/ML��,原因在于很多針對藥用開發(fā)的蛋白質(zhì)經(jīng)過密碼子優(yōu)化(伴以多個同義突變)��,對蛋白質(zhì)結(jié)構(gòu)的影響仍處于積極探索中[5,11]��。
2.2 非臨床研究
非臨床研究包括體外和體內(nèi)研究��,旨在進(jìn)一步推動潛在的治療方法進(jìn)入人體臨床研究開發(fā)。新藥開發(fā)過程中的非臨床研究��,可以在開發(fā)的各個階段進(jìn)行:在臨床研究之前����,與臨床開發(fā)同時進(jìn)行,甚至在獲批上市后也可以開展����。非臨床研究包括采用實(shí)驗(yàn)動物開展的藥代動力學(xué)、藥效學(xué)和毒理學(xué)研究;在動物模型中開展的體外和體內(nèi)機(jī)制探索研究��;器官芯片和多器官芯片系統(tǒng)����;細(xì)胞檢測平臺數(shù)據(jù)可利用AI/ML(例如����,計(jì)算建模和模擬技術(shù))來評估毒性、探索機(jī)制模型和開發(fā)體內(nèi)預(yù)測模型[14-18]����。
藥代動力學(xué)(PK)用于描述藥物吸收、分布����、代謝和排泄的時間過程����。藥效學(xué)(PD)探討人體對藥物的生物響應(yīng)��。將PK 和PD 整合到一個模型中��,該模型可以描述當(dāng)使用某種劑量或給藥方案時����,藥物效果將如何隨時間變化。藥品開發(fā)中采用PK/PD 模型已有數(shù)十年歷史�����,包括非臨床和臨床階段[19]��。隨著計(jì)算工具��、技術(shù)以及建模平臺的可用性不斷進(jìn)展����,運(yùn)用基于生理的藥代動力學(xué)(PBPK)和藥代動力學(xué)/ 藥效學(xué)(PBPK-PD)建模也隨之增加[20]。目前正在探索PK/PD 建模采用更多新的AI/ML 算法�����,包括人工神經(jīng)網(wǎng)絡(luò)模型和樹狀模型。遞歸神經(jīng)網(wǎng)絡(luò)是一種常用于分析時間序列數(shù)據(jù)的ML 算法����,可用于高度復(fù)雜的PK/PD 數(shù)據(jù)分析領(lǐng)域,以補(bǔ)充傳統(tǒng)的PK/PD 模型�����,并有可能提高非臨床和臨床應(yīng)用的準(zhǔn)確性[21]�。
2.3 臨床研究
臨床研究通常包括Ⅰ ~ Ⅲ期臨床試驗(yàn)�����,用于評價在研藥品安全性和有效性�。簡化和推進(jìn)臨床研究成為AI/ML 在藥品開發(fā)中最重要的應(yīng)用領(lǐng)域之一。例如�����,采用AI/ML 分析來自干預(yù)性研究(也被稱為臨床試驗(yàn))和非干預(yù)性研究(也被稱為觀察性研究)的大量數(shù)據(jù)�����,用于判斷藥品安全性和有效性。AI/ML 有可能為非傳統(tǒng)試驗(yàn)的設(shè)計(jì)和效率提供參考�����,例如分散式臨床試驗(yàn)�。此外,AI/ML 還可用于從電子病歷�����、醫(yī)保理賠或其他數(shù)據(jù)源提取真實(shí)世界數(shù)據(jù)的試驗(yàn)��;用于分析����、解讀來自數(shù)字醫(yī)療技術(shù)的數(shù)據(jù);用于改善臨床試驗(yàn)運(yùn)行�����,幫助鎖定��、招募參與臨床試驗(yàn)的目標(biāo)患者人群���,提高臨床試驗(yàn)運(yùn)行效率�����。
2.3.1 患者招募
AI/ML 越來越多用于參與者有可能從中受益的新藥臨床試驗(yàn)�。這類臨床試驗(yàn)采用AI/ML 挖掘大量數(shù)據(jù),例如來自臨床試驗(yàn)數(shù)據(jù)庫�����、試驗(yàn)公告��、社交媒體��、醫(yī)學(xué)文獻(xiàn)��、臨床試驗(yàn)登記及電子病歷的結(jié)構(gòu)化與非結(jié)構(gòu)化數(shù)據(jù)�。AI/ML也可用于將個人與試驗(yàn)匹配[22]����。盡管這些算法是在大量的患者數(shù)據(jù)和過去試驗(yàn)的入選標(biāo)準(zhǔn)上訓(xùn)練出來的,但重要的是要確保充分代表可能的人群����。可能使用該藥物人群的代表性(例如�����,性別、種族等)�,建立和采用匹配算法,確認(rèn)在招募過程中實(shí)現(xiàn)了公平入組��。在未來����,這些技術(shù)如果得到適當(dāng)?shù)尿?yàn)證�����,能夠繼續(xù)在匹配個人與研究性治療方面發(fā)揮越來越大的作用。
2.3.2 試驗(yàn)參與者選擇和分層
對于旨在證明藥品和生物制品有效性的臨床研究���,采用富集策略可以幫助選擇試驗(yàn)參與者[23]��。研究者已探索將AI/ML 作為臨床研究的一部分�,根據(jù)基線特征(例如�����,人口統(tǒng)計(jì)學(xué)信息、臨床數(shù)據(jù)��、生命體征��、實(shí)驗(yàn)室�、醫(yī)學(xué)影像數(shù)據(jù)和基因組學(xué)數(shù)據(jù))預(yù)測個體參與者的臨床結(jié)局[24-28]。這種預(yù)測模型可用于臨床試驗(yàn)患者富集(例如�,識別確認(rèn)高風(fēng)險參與者或更有可能對相關(guān)治療產(chǎn)生響應(yīng)的參與者)。AI/ML 算法用于隨機(jī)化之前的患者評估和選擇��,可能會減少變異性并提高研發(fā)效能[29]。
除了用于富集策略外����,如果AI/ML 模型可以在實(shí)施研究性治療之前預(yù)測嚴(yán)重不良事件的概率��,還可通過預(yù)測模型將參與者分層��。根據(jù)對這些嚴(yán)重不良事件的預(yù)測風(fēng)險�����,可將參與者分層為不同小組,然后予以相應(yīng)監(jiān)測�����,或根據(jù)所預(yù)測的不良事件嚴(yán)重程度予以剔除�����。
2.3.3 劑量/ 給藥方案優(yōu)化
AI/ML 可用于描述和預(yù)測給藥后的PK 曲線����。還可在考慮存在混雜因素情況下����,用于研究藥量與響應(yīng)之間的關(guān)系���。這類模型可用于優(yōu)化研究的劑量/ 給藥方案選擇。包括幫助數(shù)據(jù)數(shù)量有限的特殊人群����, 例如��, 針對罕見病患者、兒童和孕婦進(jìn)行劑量優(yōu)化[30-31]����。
2.3.4 參與臨床試驗(yàn)的患者依從性
在臨床試驗(yàn)期間,AI/ML 可以通過工具來監(jiān)測和改善患者依從性���。例如��,通過智能手機(jī)提醒��,或通過智能藥盒和目視確認(rèn)工具實(shí)現(xiàn)電子跟蹤用藥���,以及電子追蹤錯過的臨床診視�,從而觸發(fā)不依從警報(bào)[32]����。在臨床研究中,AI/ML 用于提高用藥依從性的實(shí)例包括數(shù)字生物標(biāo)志物的應(yīng)用����,例如面部���、聲音表達(dá)�����,以遠(yuǎn)程方式監(jiān)測依從性。
2.3.5 患者保持
AI/ML 有可能通過啟用相關(guān)工具�����,例如AI 聊天機(jī)器人�����、語音輔助和智能搜索,改善參與者獲取相關(guān)的試驗(yàn)信息�。AI/ML 也可用于減少參與者負(fù)擔(dān)。通過使用被動數(shù)據(jù)采集技術(shù)���,以及從臨床實(shí)踐或研究中產(chǎn)生的可用數(shù)據(jù)中提取更多信息[33]���。此外,來自數(shù)字醫(yī)療技術(shù)和其他系統(tǒng)的數(shù)據(jù)可用于建立患者檔案�,以潛在地預(yù)測退出和不良事件,確保參與者的保留�����。
2.3.6 臨床試驗(yàn)場所選擇
可利用AI/ML 優(yōu)化臨床試驗(yàn)運(yùn)行��,幫助確定哪些場所具有成功試驗(yàn)的最大潛力����,幫助相關(guān)場所確定流程方面的差距�����。例如,使用相關(guān)算法來評價試驗(yàn)場所的表現(xiàn)�����,并根據(jù)相關(guān)場所的其他試驗(yàn)數(shù)據(jù),幫助確定哪些場所落后于項(xiàng)目進(jìn)度的風(fēng)險可能較高�����。
2.3.7 臨床試驗(yàn)數(shù)據(jù)采集�、管理和分析
(1)數(shù)據(jù)采集。數(shù)字醫(yī)療產(chǎn)品,例如與無線���、智能手機(jī)連接的產(chǎn)品�����、可穿戴設(shè)備�����、植入式器械和攝入式器械����,正越來越多地被用于臨床試驗(yàn)���,用于采集客觀、可量化���、縱向、連續(xù)的生理數(shù)據(jù)。此外����,很多數(shù)字醫(yī)療產(chǎn)品采用AI/ML����,作為數(shù)字醫(yī)療產(chǎn)品內(nèi)嵌算法��,用于從數(shù)字醫(yī)療產(chǎn)品采集生成的數(shù)據(jù),用于預(yù)測慢性疾病病況及其對治療的響應(yīng)[34]�����,或識別確定潛在病癥的新特征[35]�??刹捎肁I/ML 來分析應(yīng)用這些產(chǎn)品對臨床受試者開展的持續(xù)監(jiān)測所產(chǎn)生的大量和多樣化數(shù)據(jù)�����。包括采用AI/ML 來幫助評估通過多個數(shù)字醫(yī)療產(chǎn)品采集的多個具體測量值組合而成的多模態(tài)數(shù)據(jù)和綜合測量值[36]�����。
(2)數(shù)據(jù)管理。AI/ML 可用于一系列的數(shù)據(jù)清理和整理,包括重復(fù)參與者的檢測和缺失數(shù)據(jù)值估算[37]�����,以及協(xié)調(diào)不同藥品開發(fā)項(xiàng)目受控術(shù)語的能力�。在藥品開發(fā)項(xiàng)目中統(tǒng)一受控術(shù)語(controlled terminology)��,受控術(shù)語是與臨床數(shù)據(jù)交換標(biāo)準(zhǔn)協(xié)會(Clinical Data Interchange Standards Consortium ,CDISC) 定義的數(shù)據(jù)集中的數(shù)據(jù)項(xiàng)一起使用的代碼列表和有效值的集合���。受控術(shù)語提供在符合CDISC 的數(shù)據(jù)集中提交給FDA和PMDA 所需的值[38]����。
AI/ML 的使用也可以通過使用監(jiān)督和無監(jiān)督學(xué)習(xí)來大大加強(qiáng)數(shù)據(jù)整合工作,和無監(jiān)督學(xué)習(xí)來幫助整合以各種格式提交的數(shù)據(jù)并進(jìn)行數(shù)據(jù)質(zhì)量評估。此外�����,AI/ML 還可用于通過對個人身份信息的屏蔽和去標(biāo)識來進(jìn)行數(shù)據(jù)整理。信息���,創(chuàng)建元數(shù)據(jù)�����,以及搜索和檢索存儲數(shù)據(jù)�����。這些應(yīng)用有可能提高數(shù)據(jù)的準(zhǔn)確性����,并提高為分析準(zhǔn)備數(shù)據(jù)的速度��。
(3)數(shù)據(jù)分析�����。AI/ML 已用于分析從電子病歷����、醫(yī)保理賠和疾病登記處等來源提取的大量多樣而復(fù)雜的真實(shí)世界數(shù)據(jù)。此外��,目前正在積極探索在預(yù)測性建模和反事實(shí)模擬中使用AI/ML,為臨床試驗(yàn)設(shè)計(jì)提供信息��。例如,虛擬臨床試驗(yàn)(in-silico clinicaltrial)利用計(jì)算建模和模擬來評估候選藥物,采用虛擬隊(duì)列模擬參與者,能夠代表所需參與者群體的真實(shí)變異性[39]�����。AI/ML 能夠在這些情況下�����,幫助評估大量的反事實(shí)模擬�,在開展人體試驗(yàn)前預(yù)測試驗(yàn)結(jié)果�����。
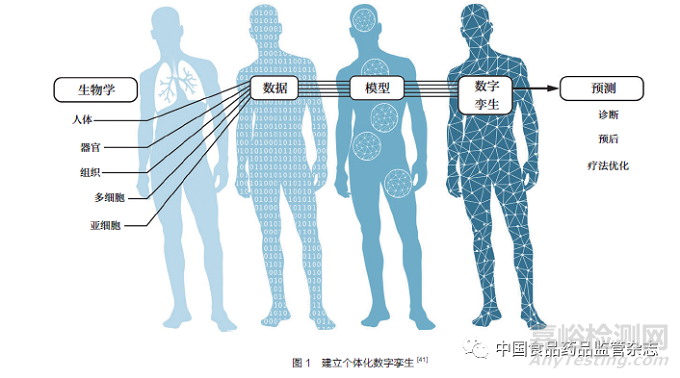
在更具個體化的層面上���,AI/ML 也可用于患者的數(shù)字孿生。數(shù)字孿生屬于新興的方法,有可能用于臨床研究�。為了創(chuàng)建患者的數(shù)字孿生�����,AI/ML 可以用來構(gòu)建個體的計(jì)算機(jī)表示或復(fù)制品��,這些表示或復(fù)制品可以隨著時間的推移動態(tài)反映分子和生理狀態(tài)(圖1)[40-42]���。與接受在研藥品治療的臨床試驗(yàn)參與者相比����,數(shù)字孿生有望提供一份全面、縱向和計(jì)算生成的臨床記錄�,描述如果特定參與者接受安慰劑治療時可能會發(fā)生的情況��。
(4)臨床終點(diǎn)評價��。臨床終點(diǎn)評價是評估臨床試驗(yàn)中醫(yī)療干預(yù)措施的安全性和有效性的關(guān)鍵所在�。啟用AI/ML 的算法,可以檢測一組體征和癥狀�����,識別確定潛在的安全信號,幫助實(shí)時檢測出存在安全問題的病例[43-44]�����。AI/ML 可用于協(xié)助評估臨床試驗(yàn)期間從不同來源(例如�����,數(shù)字醫(yī)療產(chǎn)品、社交媒體)獲取的結(jié)果�,包括由大量數(shù)據(jù)組成的結(jié)果,手動審查可能不切實(shí)際�����。
2.4 上市后安全監(jiān)測
藥物警戒(PV)指與檢測��、評估、了解和預(yù)防不良事件或所有其他藥品相關(guān)問題(包括用藥差錯和產(chǎn)品質(zhì)量問題)的科學(xué)研究和活動����。上市后安全監(jiān)測����,或獲批后的藥物警戒活動�����,包括與使用人用藥品和生物制品有關(guān)的不良事件的上市后安全報(bào)告����。個案安全報(bào)告(ICSR) 用于向FDA 報(bào)告不良事件的上市后報(bào)告,作為上市后安全監(jiān)測中潛在藥物安全問題的重要數(shù)據(jù)源���。ICSR中的臨床信息���,包括一種或多種可疑產(chǎn)品�,以及與產(chǎn)品使用相關(guān)的時間信息以及患者病史��、臨床過程和結(jié)局中的不良事件�����。完整�、準(zhǔn)確報(bào)告ICSR,對了解藥物的安全性至關(guān)重要���。由于ICSR 數(shù)量增加等原因,正在探索AI/ML 應(yīng)用程序來幫助處理和評估監(jiān)管機(jī)構(gòu)內(nèi)的ICSR 提交[45-46]�����。
2.4.1 案例處理
ICSR 處理過程中�����,有可能使用AI/ML 自動處理��。ICSR 中不良事件數(shù)據(jù)來源的數(shù)量和復(fù)雜性都在增加��,包括來自患者自我報(bào)告、臨床試驗(yàn)��、電子病歷�����、社交媒體�����、電話��、電子郵件�����、文獻(xiàn)����、患者登記、理賠數(shù)據(jù)和獲批后安全研究[47]�。采用AI/ML 檢測源文件的信息,有助于識別確認(rèn)提交給ICSR 的不良事件�����。已開始探索采用AI/ML 從文獻(xiàn)中檢測和評估事件關(guān)聯(lián),篩選社交媒體中報(bào)道的不良事件[48-51]���。
在從數(shù)據(jù)源中識別�����、確認(rèn)不良事件后��,AI/ML 可用于案例有效性�、案例優(yōu)先級����、重復(fù)案例檢查、編碼和質(zhì)量控制����。使用AI/ML 可以幫助識別一個案例是否為有效案例�����,這包括確定一個案例是否包含最低的報(bào)告要求�����,例如可識別的患者、可疑藥品或生物制品��、不良事件和可識別報(bào)告人[52-53]�����。在病例入組過程中����,為了幫助確定病例的優(yōu)先次序,AI/ML 被用來按預(yù)期性(不良事件是否已知并被收錄于產(chǎn)品標(biāo)簽中)對不良事件進(jìn)行分類[47,52]�����。正在使用AI/ML 自動進(jìn)行重復(fù)檢查����,以確定該病例是否確實(shí)重復(fù),屬于先前已有記載病例的后續(xù)版本�����,還是新病例��。另一個應(yīng)用AI/ML 的領(lǐng)域是將ICSR 中記錄的不良事件編碼為結(jié)構(gòu)化醫(yī)學(xué)術(shù)語�����,用于質(zhì)量控制[54]。
2.4.2 病例評估
不良事件案例需要經(jīng)過臨床評價�����。案例評估包括評價藥物和不良事件之間的因果關(guān)系的可能性��,以及評價相關(guān)案例的結(jié)局����。根據(jù)因果關(guān)系評價中使用的相關(guān)特征,開發(fā)一個AI 模型�����;模型需經(jīng)過訓(xùn)練�����、驗(yàn)證和測試��,根據(jù)藥物和不良事件之間因果關(guān)系的概率��,對病例分類[55]�����。AI/ML 也被應(yīng)用于確定ICSR 結(jié)果的嚴(yán)重性�����,用于支持案例評估�����,同時有助于及時提交需要快速報(bào)告的個別案例[47]���。
2.4.3 病例提交
一般情況下�����,病例處理的最后一步是提交ICSR�����。AI/ML 算法已用于自動向FDA 提交ICSR 規(guī)則���。ICSR 需要基于個人匯總[54]。不良事件的匯總報(bào)告一般涉及產(chǎn)品安全數(shù)據(jù)的匯編��,按照規(guī)定的時間間隔提交。AI/ML 可以用來開發(fā)匯總報(bào)告�����,其中包括在一個時間段內(nèi)發(fā)生的特定產(chǎn)品的多個不良事件�����,用于報(bào)告用途[56]�����。
2.5 先進(jìn)制藥
工業(yè)4.0 匯集了多項(xiàng)快速發(fā)展的技術(shù)�,有望為制造商創(chuàng)造出嚴(yán)格合規(guī)、超級鏈接��、數(shù)字化的生態(tài)系統(tǒng)和醫(yī)藥價值鏈[57]�。AI/ML 是貫徹、實(shí)現(xiàn)工業(yè)4.0 的重要推動因素���。藥品開發(fā)涉及制藥����、加工����、包裝和存儲藥品的方法、設(shè)施和控制�,需要確保藥品符合安全性、有效性要求��,符合鑒別特性��、規(guī)格����,同時符合質(zhì)量和純度特征���。運(yùn)用AI/ML 的先進(jìn)分析技術(shù)為藥品制造提供多種可能性�,包括加強(qiáng)工藝控制�����,改善設(shè)備可靠性和產(chǎn)量�����,監(jiān)測制藥工藝中受控狀態(tài)之外的早期警告或信號,檢測反復(fù)出現(xiàn)的問題群����,防止批次損失。使用AI/ML 來支持制藥業(yè)�����,可以與其他先進(jìn)制藥技術(shù)(例如��,過程分析技術(shù)�����、連續(xù)制造)一起部署�,以實(shí)現(xiàn)預(yù)期效益。
AI/ML 也可用于通過預(yù)測產(chǎn)品需求��、分析生產(chǎn)計(jì)劃��、估算�、減輕潛在中斷的影響以及優(yōu)化庫存,提高制藥供應(yīng)鏈的可靠性�����?��;贏I/ML 的方法在藥品生產(chǎn)中的應(yīng)用,涵蓋從設(shè)計(jì)到商業(yè)化大生產(chǎn)的整個藥品生產(chǎn)周期�。
2.5.1 工藝設(shè)計(jì)優(yōu)化
數(shù)字孿生也可用于工藝設(shè)計(jì)優(yōu)化����。工藝數(shù)字孿生是物理過程的數(shù)字復(fù)制����,用于更好地理解����、分析、預(yù)測和優(yōu)化工藝性能�����。對于分析以有限的開發(fā)數(shù)據(jù)為特征的制造工藝�,數(shù)字孿生尤其有用��。AI/ML 模型可利用產(chǎn)品和工藝的現(xiàn)有知識(例如,來自先驗(yàn)研究����、開發(fā)計(jì)劃和科學(xué)文獻(xiàn)),更快地確定最佳工藝參數(shù)��,減少設(shè)計(jì)時間和浪費(fèi)�����。
2.5.2 先進(jìn)工藝控制
制藥業(yè)實(shí)施工藝控制已有數(shù)十年歷史����。傳統(tǒng)的工藝控制將輸入的工藝參數(shù)維持在設(shè)定點(diǎn),不能同時改變多個輸入?yún)?shù)����,將輸出參數(shù)維持在期望的水平,以優(yōu)化工藝����。另外,先進(jìn)工藝控制允許對工藝進(jìn)行動態(tài)控制����,實(shí)現(xiàn)預(yù)期輸出(圖2)[58]���。
AI/ML 技術(shù),例如神經(jīng)網(wǎng)絡(luò)����,輸入實(shí)時工藝數(shù)據(jù),可用于實(shí)現(xiàn)先進(jìn)工藝控制�����。這些方法也可用于工藝控制開發(fā)�����,通過使用AI/ML 工具與實(shí)時傳感器數(shù)據(jù)相結(jié)合�����,預(yù)測工藝是否處于受控狀態(tài)�����。
傳感器數(shù)據(jù)�����,包括與生產(chǎn)線的智能監(jiān)控相結(jié)合的傳感器數(shù)據(jù)��,用于改善現(xiàn)有生產(chǎn)線的效率和產(chǎn)量�。預(yù)期將物理、化學(xué)知識與AI/ML 技術(shù)相結(jié)合的先進(jìn)工藝控制方法將被越來越多地采用���,已有數(shù)家制藥公司采用這種方法。在這些先進(jìn)工藝控制應(yīng)用中����,高質(zhì)量的模型輸入為工藝?yán)斫夂湍P徒Y(jié)構(gòu)提供信息。在與數(shù)據(jù)驅(qū)動的建模相結(jié)合時��,利用這些強(qiáng)大的輸入����,可推導(dǎo)出模型參數(shù),提高模型穩(wěn)健性�。
2.5.3 智能監(jiān)控和維護(hù)
制造過程可以實(shí)現(xiàn)自動化和實(shí)時監(jiān)控,在不影響產(chǎn)品質(zhì)量的前提下��,實(shí)現(xiàn)更為有效的庫存管理���,縮短交貨時間��,提高產(chǎn)率���。AI/ML 方法可用于監(jiān)測設(shè)備和檢測偏離正常性能����、需要觸發(fā)維護(hù)活動的情況��,減少工藝過程中的停機(jī)時間��。另一個實(shí)例是在質(zhì)量控制中使用計(jì)算機(jī)可視化�、圖像���,例如包裝���、標(biāo)簽或西林瓶圖像,由AI/ML 軟件分析�����,檢測偏差����,確保圖像符合產(chǎn)品給定質(zhì)量屬性的要求����。用AI/ML 方法增強(qiáng)對藥品和包裝的目視檢查�,可提高目視檢查控制的準(zhǔn)確性和效率。
2.5.4 趨勢監(jiān)測
AI/ML 可用于多個領(lǐng)域�����,使制藥更加有效�、高效�,產(chǎn)出更快,浪費(fèi)更少��,在更為知情的情況下做出決策���,加強(qiáng)質(zhì)量控制�����。目前���,工藝偏差分析主要是由質(zhì)量部門員工和相關(guān)主題專家完成。AI/ML 可用于協(xié)助審查偏差報(bào)告��,這些報(bào)告包含大量數(shù)據(jù)或文本,以分析與制造有關(guān)的偏差趨勢����,將相關(guān)問題聚類,優(yōu)先考慮主動持續(xù)改進(jìn)的領(lǐng)域�����。僅靠人工審查偏差趨勢非常耗時��,因此借助AI/ML 可以加快識別確認(rèn)根本原因的過程���。AI/ML 方法與工藝性能(Ppk)和工藝能力(Cpk)指標(biāo)相結(jié)合����,可用于主動監(jiān)測生產(chǎn)操作趨勢和失控事件����,預(yù)測觸發(fā)整改與預(yù)防措施有效性評價的限度����。
3、 FDA 在藥品開發(fā)過程中使用AI/ML 的經(jīng)驗(yàn)
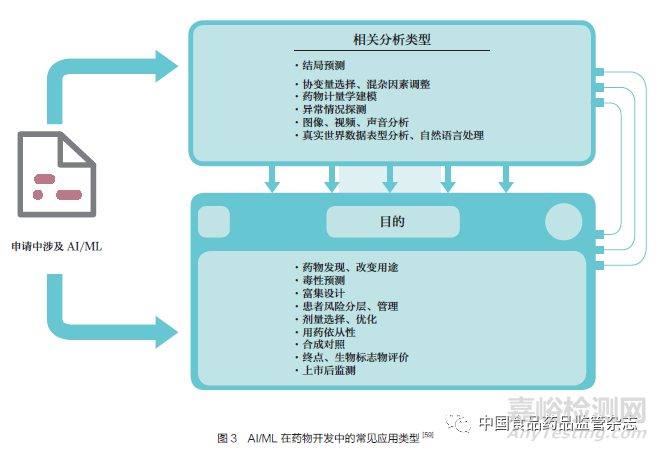
FDA 認(rèn)識到在整個藥品開發(fā)周期中越來越多地采用AI/ML��,及其在加速開發(fā)安全、有效的藥品方面的潛力��。AI/ML 越來越多地被整合到FDA 積極參與的領(lǐng)域中�����,包括臨床試驗(yàn)設(shè)計(jì)��、數(shù)字醫(yī)療技術(shù)和真實(shí)世界數(shù)據(jù)分析���。在過去的幾年里���,引用AI/ML 的申請數(shù)量迅速增長。2021 年�, 涉及AI/ML 的藥品和生物制品申請材料增加到100 余份[59]。這些申請跨越了一系列的治療領(lǐng)域���,AI/ML 在申請中的用途涵蓋藥品開發(fā)過程的許多不同領(lǐng)域���,從藥物發(fā)現(xiàn)、臨床試驗(yàn)患者富集����、終點(diǎn)評估��、制藥工藝到上市后安全監(jiān)測(圖3)�。申請?zhí)峤恢猩婕癆I/ML 最多的是在臨床開發(fā)/ 研究階段納入AI/ML����。
FDA 一直支持創(chuàng)新和強(qiáng)有力的AI/ML 的發(fā)展, 設(shè)立CDER人工智能指導(dǎo)委員會(AISC)����,該委員會負(fù)責(zé)協(xié)調(diào)藥品開發(fā)過程中運(yùn)用AI/ML。CDRH 設(shè)立數(shù)字醫(yī)療卓越中心����,通過推進(jìn)創(chuàng)新方法、促進(jìn)整個機(jī)構(gòu)的協(xié)作��,為涉及AI/ML 的藥品申請?zhí)峤惶峁┳稍?�。FDA 正在為基于AI/ML 的器械開發(fā)制定框架�,包括為嵌入AI/ML 的器械制定預(yù)先確定的變更控制計(jì)劃�����,同時正在著手制定醫(yī)療器械開發(fā)ML 規(guī)范的依據(jù)。此外�,F(xiàn)DA 還組織了各種研討會,召開了患者參與咨詢委員會(Patient Engagement Advisory Committee����,PEAC) 會議, 討論數(shù)字醫(yī)療技術(shù)和AI/ML 相關(guān)主題����。通過與外部學(xué)術(shù)機(jī)構(gòu)和臨床研究機(jī)構(gòu)合作,促進(jìn)監(jiān)管科學(xué)研究����,涉及穩(wěn)健性、以用戶為中心的透明度�、識別確認(rèn)和管理,以評估新興AI/ML 產(chǎn)品的安全性和有效性��。
此外�,CDER 還制定了新藥創(chuàng)新科技路徑(the Innovative Science and Technology Approaches for New Drugs,ISTAND)試點(diǎn)計(jì)劃�����,旨在拓展藥品開發(fā)工具的類型��,包括利用數(shù)字醫(yī)療技術(shù)工具,納入藥物開發(fā)工具認(rèn)證計(jì)劃���。運(yùn)用AI/ML����,可授予藥物開發(fā)工具資質(zhì)�����,或可用于幫助解讀��、分析傳統(tǒng)藥品開發(fā)工具(例如�,生物標(biāo)志物或臨床結(jié)局評估),有可能加速新的藥品開發(fā)工具評估��,加強(qiáng)可供決策采用的證據(jù)���,加快向患者提供新的治療方法�����。針對模型提供信息的藥品開發(fā)(model-informeddrug development���,MIDD),F(xiàn)DA CDER 和CBER 設(shè)立MIDD試點(diǎn)項(xiàng)目�����,以促進(jìn)開發(fā)和應(yīng)用非臨床和臨床數(shù)據(jù)來源的基于藥量的生物學(xué)和統(tǒng)計(jì)學(xué)模型���。對于MIDD����,AI/ML 有助于改善臨床試驗(yàn)?zāi)M���、優(yōu)化劑量選擇或估算����,或加強(qiáng)預(yù)測性或機(jī)制安全性評估���。
在上市后安全監(jiān)測領(lǐng)域����,F(xiàn)DA 的哨點(diǎn)計(jì)劃���, 包括CDER的哨點(diǎn)系統(tǒng)(Sentinel System)����、CBER 的生物制品有效性和安全性(Biologics Effectiveness and Safety,BEST) 系統(tǒng)�, 以及CDRH 的國家衛(wèi)生技術(shù)評估系統(tǒng)(National Evaluation System for health Technology,NEST)�,正在探索運(yùn)用AI/ML 方法, 改進(jìn)現(xiàn)有系統(tǒng)[60-62]�����。FDA在為期5 年的哨點(diǎn)系統(tǒng)戰(zhàn)略計(jì)劃中��,概述了使用由先進(jìn)分析支持�����、將理賠與電子病歷數(shù)據(jù)鏈接的目標(biāo)����。哨點(diǎn)系統(tǒng)創(chuàng)新中心計(jì)劃采用“四管齊下”的方法�����,通過將新興的數(shù)據(jù)科學(xué)創(chuàng)新與電子病歷數(shù)據(jù)用于醫(yī)藥產(chǎn)品安全監(jiān)控�,來實(shí)施這一計(jì)劃���。采取的4 項(xiàng)措施包括:①數(shù)據(jù)基礎(chǔ)設(shè)施;②特征工程�����;③因果推理�����;④檢測分析[63]�。相關(guān)的AI/ML 應(yīng)用�,包括自然語言處理(natural language processing,NLP)和從非結(jié)構(gòu)化電子病歷臨床記錄中自動提取特征�,用于可計(jì)算的表型,以及使用先進(jìn)的統(tǒng)計(jì)和ML 方法從基于電子病歷的變量中改進(jìn)混雜調(diào)整[64-65]��。
CBER 的BEST 系統(tǒng)旨在提供更好的數(shù)據(jù)源、方法��、工具��、專業(yè)知識和基礎(chǔ)設(shè)施��,以開展監(jiān)測和流行病學(xué)研究����。該計(jì)劃的一部分是使用AI/ML 方法來分析電子病歷���,預(yù)測或更好地了解與使用生物制品和CBER 監(jiān)管的其他產(chǎn)品有關(guān)的不良事件。這項(xiàng)工作也可以加強(qiáng)FDA 對采用AI/ML方法來生成關(guān)于產(chǎn)品療效的真實(shí)世界證據(jù)的理解��。
CDER 也在探索AI 應(yīng)用�����,以加強(qiáng)對提交給FDA 不良事件報(bào)告系統(tǒng)(FDA Adverse Event Reporting System�,F(xiàn)AERS)ICSR 的評估[46]。采用AI/ML 開發(fā)信息可視化平臺(Information Visualization Platform �����,InfoViP)��,用于檢測重復(fù)的ICSR��,按信息質(zhì)量水平對ICSR 分類,推導(dǎo)出可視化的臨床事件時間軸�����,用于幫助分析報(bào)告的不良事件[66-68]��。已經(jīng)研究了AI/ML 方法來自動識別藥物產(chǎn)品標(biāo)簽中的不良事件�����,以支持安全審查員對ICSR 進(jìn)行分流�����,促進(jìn)識別未知或意外的安全問題[69-70]��。另一個基于AI 的工具是計(jì)算機(jī)化標(biāo)簽評價工具(the Computerized Labeling Assessment Tool���,CLAT)�����,用于自動審查標(biāo)簽、標(biāo)識�, 例如處方信息、包裝盒和容器標(biāo)簽等�����。NLP 和ML 也用于探索將FDA 不良事件報(bào)告系統(tǒng) ICSR中的自由文本敘述分類為結(jié)構(gòu)化的醫(yī)學(xué)詞典用藥差錯術(shù)語�,以支持人類對編碼質(zhì)量的審查�����。此外�����,通過FDA 的質(zhì)量量度報(bào)告計(jì)劃(Quality Metrics Reporting Program)�����,CDER 的新興技術(shù)計(jì)劃和CBER 的先進(jìn)技術(shù)團(tuán)隊(duì)計(jì)劃�,F(xiàn)DA 通過讓行業(yè)參與進(jìn)來�����,獲取AI/ML 在藥品生產(chǎn)中所采用案例的反饋[71-72]��。
FDA 還利用廣泛機(jī)構(gòu)公告(Broad Agency Announcement)等機(jī)制����,面向監(jiān)管機(jī)構(gòu)外�����,公開征集解決新興監(jiān)管科學(xué)優(yōu)先事項(xiàng)方案�,包括利用外部專業(yè)知識和基礎(chǔ)設(shè)施�����,對整合和評估用于藥品開發(fā)中AI/ML 的方法提供深入了解。
4��、 在藥品開發(fā)過程中使用AI/ML 的考量因素
AI/ML 已廣泛用于藥品開發(fā)活動,不斷發(fā)展����。AI/ML 的使用有可能加速藥品開發(fā)過程,使臨床試驗(yàn)更安全��、更具效率��。然而�����,評估AI/ML 的使用是否引入了特定的風(fēng)險和危害非常重要。例如��,AI/ML 算法有可能放大基礎(chǔ)數(shù)據(jù)源中存在的差錯和預(yù)先存在的偏倚���,當(dāng)將研究結(jié)果被外推到檢測環(huán)境之外時,會引起與可推廣性和倫理問題的擔(dān)憂�����。此外����,可能由于固有的復(fù)雜性�����,AI/ML 系統(tǒng)可能會表現(xiàn)出可解釋性有限��,或者由于專利原因?qū)е虏煌耆该?。這些擔(dān)憂導(dǎo)致了對開發(fā)可信賴的AI 標(biāo)準(zhǔn)的關(guān)注�,相關(guān)標(biāo)準(zhǔn)有望解決諸如可解釋性����、可靠性���、隱私權(quán)保護(hù)、安全性���、安全保障和降低偏倚等具體特征��。FDA的討論文件首先概述AI/ML 一般應(yīng)用的考量因素和規(guī)范����,最后提出問題����,以征求利益攸關(guān)方對這些考量因素的反饋,進(jìn)一步確定AI/ML 用于藥品開發(fā)的潛在規(guī)范����,為FDA 進(jìn)一步確定整個藥品開發(fā)過程中應(yīng)用AI/ML 的機(jī)遇和挑戰(zhàn)提供幫助��。
4.1 采用AI/ML 的總體標(biāo)準(zhǔn)與規(guī)范
國際社會和美國聯(lián)邦政府越來越重視促進(jìn)AI 創(chuàng)新和應(yīng)用,包括促進(jìn)可信賴的和符合倫理的AI[73-78]��。為促進(jìn)AI 的技術(shù)進(jìn)步而制定跨部門和特定部門標(biāo)準(zhǔn)迅速增加�����。2019 年8 月,美國國家標(biāo)準(zhǔn)與技術(shù)研究院(NIST)發(fā)布《美國在人工智能方面的領(lǐng)導(dǎo)地位:聯(lián)邦參與制定技術(shù)標(biāo)準(zhǔn)和相關(guān)工具的計(jì)劃》(U.S. Leadership in AI:A Plan for Federal Engagement in Developing Technical Standards and Related Tools)�����,幫助確保技術(shù)標(biāo)準(zhǔn)的使用���,推動AI 應(yīng)用的創(chuàng)新、信任和信心[79-80]�。該計(jì)劃確定了制定AI 標(biāo)準(zhǔn)的幾個重點(diǎn)領(lǐng)域����,包括數(shù)據(jù)和知識、性能測試和報(bào)告方法���、風(fēng)險管理和可信度等。國際標(biāo)準(zhǔn)化組織(ISO)����、國際電氣和電子工程師協(xié)會(IEEE)和國際電工委員會(IEC)����,也在開發(fā)相關(guān)的AI/ML 標(biāo)準(zhǔn)和工作產(chǎn)品�����,解決數(shù)據(jù)質(zhì)量���、可解釋性和性能等基本問題,此外還在研究某些行業(yè)的具體應(yīng)用��。由美國機(jī)械工程師協(xié)會(ASME)制定核查和驗(yàn)證(V&V 40)風(fēng)險知情的可信度評估框架��,用于評價醫(yī)療器械計(jì)算模型的可信度[81],之后被用于模型提供信息的藥品開發(fā)中[82-83]��。V&V 40 標(biāo)準(zhǔn)并非專門針對AI/ML 開發(fā)��,沒有具體規(guī)定活動或定義標(biāo)準(zhǔn)����,為確定模型在特定使用或應(yīng)用環(huán)境下的可信度��,針對醫(yī)療器械和模型提供信息的藥品開發(fā),對該標(biāo)準(zhǔn)做出相應(yīng)調(diào)整[84-85]�。
除了用于評估醫(yī)療器械計(jì)算模型預(yù)測能力的V&V 40 標(biāo)準(zhǔn)外����,F(xiàn)DA、加拿大衛(wèi)生部和英國藥品與健康產(chǎn)品管理局(MHRA)聯(lián)合發(fā)布10 項(xiàng)指導(dǎo)原則�����,為使用AI/ML 的醫(yī)療器械制定機(jī)器學(xué)習(xí)規(guī)范(GMLP)提供依據(jù)�。該指導(dǎo)原則包括采用產(chǎn)品全生命周期的方法�����,在整個產(chǎn)品開發(fā)過程中利用多學(xué)科專業(yè)知識,深入了解如何將模型整合到臨床工作流程中����。這些原則還強(qiáng)調(diào)在臨床研究人群中充分代表年齡��、性別����、種族等的重要性�;控制偏倚;提高普遍適用性�����;提供足夠的透明度,提供清晰和必要的信息���,例如產(chǎn)品的預(yù)期用途和適應(yīng)癥���,用于測試和訓(xùn)練模型的數(shù)據(jù),以及已知的局限性��。GMLP 強(qiáng)調(diào)監(jiān)測已部署的模型性能和管理模型再培訓(xùn)風(fēng)險的重要性���。FDA CDRH 之前曾討論過GMLP 對醫(yī)療器械的作用���,并在2019 年發(fā)布關(guān)于修訂基于AI/ML 的醫(yī)療器械軟件(SaMD)的擬議框架。該框架提出了一個預(yù)先確定的變更控制計(jì)劃機(jī)制����,申辦方可以主動指定對包含AI/ML 的設(shè)備軟件的擬定修改,以及用于確保其安全性和有效性的方法�����,為AI/ML 支持的器械奠定基礎(chǔ)���,提高適應(yīng)性[86]。
盡管上述標(biāo)準(zhǔn)�、規(guī)范并非專門為藥品開發(fā)而制定����,但探討這些標(biāo)準(zhǔn)對藥品開發(fā)和計(jì)劃與藥品一起使用的醫(yī)療器械開發(fā)的效用和適用性����,以確保一致性和連貫性����。
4.2 藥品開發(fā)中AI/ML的考量因素和規(guī)范討論
根據(jù)AI/ 分子生物學(xué)在藥品開發(fā)中的多個應(yīng)用領(lǐng)域����,F(xiàn)DA 正在考慮相應(yīng)的方法,以便在不斷擴(kuò)展的知識體系���,以及在對藥品開發(fā)中使用AI/ 分子生物學(xué)的機(jī)會和挑戰(zhàn)的清晰認(rèn)識的支持下,對在藥品開發(fā)中的采用AI/ML 提供監(jiān)管清晰度�����。雖然討論文件第Ⅲ.A 節(jié)中概述的某些標(biāo)準(zhǔn)和實(shí)踐有可能被調(diào)整以解決藥品開發(fā)中AI/ML 的使用問題,但在藥品開發(fā)中使用AI/ML 可能會引起特定的挑戰(zhàn)�,可能需要重視其他考量因素��。FDA 強(qiáng)調(diào)����,不應(yīng)將討論文件視為FDA 的指南或政策�,指南文件也不意味著在藥品開發(fā)中采用AI/ML 的所有具體方法。指南文件用于反饋利益攸關(guān)方的看法��,為將來與利益攸關(guān)方討論�,為將來的監(jiān)管活動提供幫助��、提供信息��。
根據(jù)美國政府問責(zé)局AI 問責(zé)框架的總體原則,F(xiàn)DA 的CDER���、CBER、CDRH(包括DHCoE)旨在與利益攸關(guān)方展開討論�,并就藥品開發(fā)中的AI/ML 的3 個關(guān)鍵領(lǐng)域征求意見。這3 個關(guān)鍵領(lǐng)域包括:①以人為主導(dǎo)的治理��、問責(zé)制和透明度��;②數(shù)據(jù)質(zhì)量、可靠性和代表性��;③模型開發(fā)�、性能�����、監(jiān)控和驗(yàn)證���。采用基于風(fēng)險、AI/ML 特定使用環(huán)境所帶來的風(fēng)險水平相稱的措施����。
4.2.1 以人為主導(dǎo)的治理����、問責(zé)制和透明度
以人為主導(dǎo)的AI/ML 治理���,有助于確保遵守法律和倫理價值觀���,問責(zé)制和透明度對于發(fā)展值得信賴的AI 至關(guān)重要����。這種治理和明確的問責(zé)制可延伸到藥品開發(fā)過程中AI/ML 的計(jì)劃��、開發(fā)、使用���、修改和叫停等各個環(huán)節(jié)�����。
作為治理的一部分,可以采用考慮使用環(huán)境的風(fēng)險管理計(jì)劃來識別確定和減輕風(fēng)險���。這種方法可以通過跟蹤、記錄關(guān)鍵步驟和決策�,包括所有偏差的根本原因,以及警惕性監(jiān)督和審計(jì)的流程�,來幫助指導(dǎo)文檔����、透明度和可解釋性的級別�����。透明度和文件記錄可提供有關(guān)AI/ML 的最初規(guī)劃����、開發(fā)、功能以及在具體使用環(huán)境中所有修改的關(guān)鍵見解��,可解釋性可提供產(chǎn)出的附帶證據(jù)或理由�。
討論文件提出的問題包括:①在藥品開發(fā)中采用AI/ML 的哪些具體用例或應(yīng)用���,最需要額外的監(jiān)管清晰度��;②對于在藥品開發(fā)中采用AI/ML���,透明度意味著什么[ 例如,透明度可以被認(rèn)為有關(guān)AI/ML 模型的適用信息�,涵蓋使用����、開發(fā)��、性能以及(如果存在)邏輯],清晰地傳達(dá)給監(jiān)管機(jī)構(gòu)與其他利益攸關(guān)方的程度[87]��;③根據(jù)所積累的經(jīng)驗(yàn)����,在藥品開發(fā)過程中使用AI/ML,透明度的主要障礙和促進(jìn)因素�,以及所涉及的情況�;④ AI/ML 用于藥品開發(fā)時�,在人為參與方面,利益攸關(guān)方有哪些基于風(fēng)險的���、有意義的好做法;⑤制定了哪些規(guī)程加強(qiáng)和實(shí)現(xiàn)可追溯性和可審計(jì)性�����;⑥如何管理質(zhì)量標(biāo)準(zhǔn)出臺之前的活動�,以及如何捕捉和監(jiān)測變更�����,確保在藥品開發(fā)中安全和有效地采用AI/ML����。
4.2.2 數(shù)據(jù)質(zhì)量、可靠性和代表性
AI/ML 對用于訓(xùn)練���、測試和驗(yàn)證的數(shù)據(jù)的屬性或特征特別靈敏�����。盡管并非AI/ML 特有����,但通常情況下�����,缺失的數(shù)據(jù)、偏倚和數(shù)據(jù)漂移均為重要的考量因素��。確保數(shù)據(jù)質(zhì)量�����、可靠性以及數(shù)據(jù)適合使用(即與特定的預(yù)期用途和人群相關(guān))成為關(guān)鍵�。需要加以考慮的潛在的數(shù)據(jù)相關(guān)問題包括以下幾個方面�。
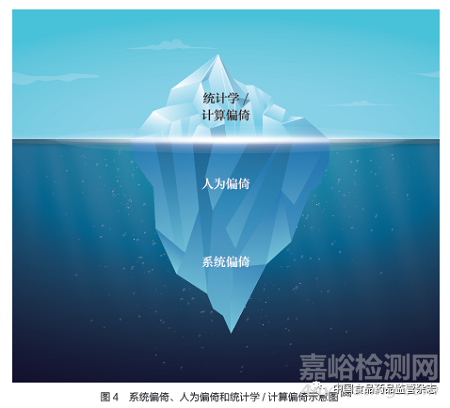
偏倚:AI/ML 可能會放大基礎(chǔ)輸入數(shù)據(jù)中預(yù)先存在的偏倚����。美國國家標(biāo)準(zhǔn)與技術(shù)研究院發(fā)布文件�����,闡述了來自人為�����、系統(tǒng)和統(tǒng)計(jì)學(xué)/ 計(jì)算的三類偏倚(圖4),以及如何在委托�、設(shè)計(jì)、開發(fā)和部署可用于生成預(yù)測���、建議或決策的AI 技術(shù)(例如,算法決策系統(tǒng))中發(fā)生,AI 系統(tǒng)在什么情況下可能造成社會危害[88]����。
完整性:數(shù)據(jù)完整性��、一致性和準(zhǔn)確性[89]����。
隱私權(quán)和安全保障:數(shù)據(jù)保護(hù)和隱私權(quán)����,與數(shù)據(jù)分類和系統(tǒng)技術(shù)特征有關(guān)����。
溯源:記錄一段數(shù)據(jù)(在數(shù)據(jù)庫��、文檔或數(shù)據(jù)倉庫中)的來源����,同時解讀如何以及為什么到達(dá)現(xiàn)行位置[90]��。溯源描述了元數(shù)據(jù)或有關(guān)數(shù)據(jù)的額外信息���,可以幫助回答諸如誰創(chuàng)建數(shù)據(jù)以及何時創(chuàng)建數(shù)據(jù)等問題[91]���。
相關(guān)性:有充分?jǐn)?shù)據(jù)可供使用,并適用于預(yù)期用途���。
可復(fù)制性:旨在回答相同問題、各自獲取數(shù)據(jù)的多項(xiàng)研究獲得一致結(jié)果[91]����。在過程的早期明確數(shù)據(jù)訪問權(quán)非常重要����。
可重復(fù)性:使用相同的輸入數(shù)據(jù)�����、計(jì)算步驟��、方法和代碼以及分析條件���,獲得一致結(jié)果[92]。盡管不能確認(rèn)有效性���,但需要可重復(fù)性所需的透明度�����,對設(shè)計(jì)和操作決策的有效性開展評估[93]。
代表性:對生成證據(jù)的樣本與目標(biāo)人群有足夠的相似性的置信度�����。在患者體驗(yàn)數(shù)據(jù)的背景下,代表性包括樣本的體驗(yàn)��、觀點(diǎn)�����、需求和優(yōu)先事項(xiàng)與預(yù)期的患者群體充分相似的程度[94]��。
所涵蓋的問題包括:①在藥品開發(fā)過程中���,AI/ML 還有哪些額外的數(shù)據(jù)考量�����;②開發(fā)機(jī)構(gòu)�����、制造商和其他利益攸關(guān)方目前采用哪些做法來幫助確保AI/ML 的完整性或解決這些問題,諸如偏倚�����、數(shù)據(jù)缺失和其他數(shù)據(jù)質(zhì)量考慮�,有利于在藥品開發(fā)中使用AI/ML ���;③利益攸關(guān)方采用了哪些關(guān)鍵做法來幫助確保數(shù)據(jù)隱私權(quán)和安全保障;④利益攸關(guān)方采用了哪些關(guān)鍵做法來幫助解決可重復(fù)性和可復(fù)制性問題�����;⑤開發(fā)機(jī)構(gòu)采用了什么樣的流程來識別確定和管理偏倚��。
4.2.3 模型開發(fā)��、性能、監(jiān)控�、驗(yàn)證
在評估AI/ML 模型的開發(fā)和性能時,所采用的模型是重要的考量因素����,包括通過預(yù)先指定步驟的做法和明確記錄開發(fā)和評估模型的標(biāo)準(zhǔn)�����??紤]模型風(fēng)險和可信度可能也很重要��;可信度目標(biāo)與相關(guān)措施的選擇受制于模型風(fēng)險��?����?尚哦戎柑囟ㄊ褂铆h(huán)境下計(jì)算模型預(yù)測能力的可信程度。包括在可行的情況下���,記錄組件層面(例如,模型和非水平組件����,包括指標(biāo)和評估每個組件的性能和結(jié)果)和系統(tǒng)層面(例如,評價方法���、性能指標(biāo)和結(jié)果)的性能和方法,以衡量不確定性����。可信度的證明通常包括一種基于風(fēng)險的方法����,即呈現(xiàn)最高風(fēng)險的用途通常需要標(biāo)準(zhǔn)最高的證據(jù)����,根據(jù)相關(guān)風(fēng)險需要有梯度的證據(jù)(即為非嚴(yán)重醫(yī)療狀況的早期藥物開發(fā)提供信息����,而為關(guān)鍵醫(yī)療狀況評估藥物安全性和有效性)��。模型風(fēng)險由模型影響(模型在特定決策的全部證據(jù)中的權(quán)重)和決策后果(錯誤決策的潛在后果)2個因素決定,這2 個因素取決于相關(guān)的使用環(huán)境�����。
在平衡性能和可解釋性方面���,考慮AI/ML 模型復(fù)雜性非常重要。在確定復(fù)雜模型(例如��,人工神經(jīng)網(wǎng)絡(luò)模型)具有相似性能的情況下�,選擇更為傳統(tǒng)和更為簡明(即參數(shù)更少)的模型�����,可能具有整體優(yōu)勢�����。
監(jiān)測和記錄AI/ML 模型的監(jiān)測工作很重要�,確?����?煽俊⑾嚓P(guān)�����,并在一段時間內(nèi)保持一致。包括記錄監(jiān)測結(jié)果和為確保AI/ML 產(chǎn)生預(yù)期結(jié)果而采取的所有整改措施����。隨后的評估(例如,上市后的安全監(jiān)測���、監(jiān)督)可以提供關(guān)于流程和真實(shí)世界模型性能的寶貴反饋。真實(shí)世界模型性能包括可由真實(shí)世界數(shù)據(jù)采集和監(jiān)測支持的具體應(yīng)用�����,例如電子病歷�����、產(chǎn)品�、疾病登記等��?���;谡鎸?shí)世界性能的再訓(xùn)練���,能夠?yàn)槟P托阅芴峁┲匾纳钊肓私猓谶@種再訓(xùn)練之后����,監(jiān)測和記錄AI/ML模型以適當(dāng)?shù)毓芾盹L(fēng)險可能變得很重要��。
數(shù)據(jù)方面的考量還包括提供用于開發(fā)AI/ML 模型的訓(xùn)練數(shù)據(jù)集的細(xì)節(jié)�,以及在采用獨(dú)立外部測試數(shù)據(jù)支持驗(yàn)證和確認(rèn)[ 外部有效性(external validity)] 情況下的性能。一般來講�,對于特定使用環(huán)境���,具有足夠質(zhì)量的數(shù)據(jù)將具備對采用AI/ML 方法所針對的人群的代表性,這一點(diǎn)很重要����。重要的是有助于確保AI/ML 模型得到驗(yàn)證���,生成對模型使用可信的結(jié)果����。可靠性活動包括驗(yàn)證軟件代碼和計(jì)算�、驗(yàn)證模型�����,以及評估驗(yàn)證評價對使用環(huán)境的適用性。這些活動包括考慮測量模型預(yù)測的不確定性水平�����。在完成可信度活動后��,可開展評價,以確定模型的使用是否足夠可信��,以及在監(jiān)管所涉范圍內(nèi)���,是否能夠接受模型。所涵蓋的問題包括:①利益攸關(guān)方目前使用的工具��、流程�����、方法和規(guī)范的用例����;②記錄可用于藥品開發(fā)的AI/ML 模型的開發(fā)和性能(例如��,CONSORT-AI、SPIRITAI)[31,95] �����;③針對具體使用環(huán)境選擇模型的類型和算法�;④確定在什么情況下采用特定的方法驗(yàn)證模型��,并在特定的使用環(huán)境下測量性能(例如�,選擇相關(guān)的成功標(biāo)準(zhǔn)和性能測量)����;⑤如何評價透明度和可解釋性���,提高模型的透明度���;⑥解決準(zhǔn)確性和可解釋性的問題(例如�,模型可能提供更高的準(zhǔn)確性��,同時在可解釋性方面存在局限的情況)���;⑦是否針對AI/ML 模型的開發(fā)選擇開源AI 軟件��,采用開源AI 軟件時有哪些注意事項(xiàng);⑧是否采用真實(shí)世界數(shù)據(jù)性能來監(jiān)測AI/ML 性能���。
5、 結(jié)語
AI/ML 在醫(yī)藥產(chǎn)品開發(fā)����、生產(chǎn)���、上市后監(jiān)測中的運(yùn)用����,呈現(xiàn)出在多種環(huán)境下��,與多種類型的軟件�����、硬件一起使用的跨平臺(technology-agnostic) 特征��。面對技術(shù)的不斷發(fā)展����,監(jiān)管機(jī)構(gòu)需要與行業(yè)和利益攸關(guān)方達(dá)成共識�����,在推動相關(guān)技術(shù)運(yùn)用的同時��,充分認(rèn)識到相關(guān)技術(shù)的風(fēng)險和面臨的挑戰(zhàn),通過與行業(yè)和利益攸關(guān)方協(xié)作��,充分利用創(chuàng)新技術(shù)��,共同推動AI/ML 在相關(guān)領(lǐng)域的運(yùn)用����。
引用本文
姚立新.淺析人工智能/ 機(jī)器學(xué)習(xí)用于藥品開發(fā)——基于FDA 討論文件的探討[J].中國食品藥品監(jiān)管.2023.07(234):44-57.