“以患者為中心”的藥物研發(fā)是以患者的需求為出發(fā)點(diǎn),讓患者參與藥物研發(fā),該理念已經(jīng)成為目前藥物研發(fā)的核心指導(dǎo)思想����,因此為了指導(dǎo)以患者為中心的臨床試驗(yàn)設(shè)計(jì), CDE于2023年7月27日發(fā)布了該指導(dǎo)原則��。
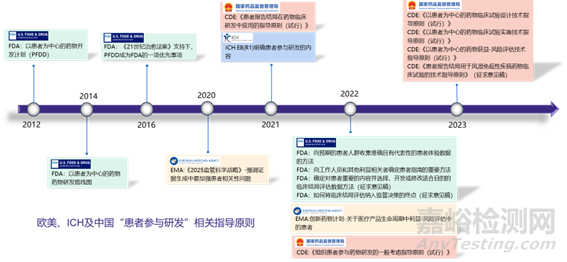
實(shí)際上 “以患者為中心”的理念一直貫穿在臨床診療實(shí)踐以及臨床試驗(yàn)中�,如診療實(shí)踐中強(qiáng)調(diào)的“以人為本”,臨床試驗(yàn)中的基石“赫爾辛基宣言”�,以及反復(fù)強(qiáng)調(diào)的“獲益風(fēng)險(xiǎn)比”,都體現(xiàn)了“以患者為中心”的理念��。但是真正將“以患者為中心”納入法規(guī)��、指導(dǎo)原則是從近年來(lái)才開(kāi)始的�,從2012年開(kāi)始FDA發(fā)布了一系列的患者參與研發(fā)的指導(dǎo)原則,到2020年EMA在2025監(jiān)管科學(xué)戰(zhàn)略中強(qiáng)調(diào)證據(jù)生成中要加強(qiáng)患者相關(guān)性問(wèn)題����,再到2021年ICH 發(fā)布了E8(R1) 明確了患者參與研發(fā)的內(nèi)容,此后FDA����、EMA及CDE先后發(fā)布了多個(gè)“患者參與研發(fā)”的指導(dǎo)原則,標(biāo)志著“以患者為中心”的藥物研發(fā)策略進(jìn)入了新的階段��,上升到法規(guī)指南的層面。
本指導(dǎo)原則的目的有以下三點(diǎn):
1����、闡明以患者為中心的藥物臨床試驗(yàn)設(shè)計(jì)的總體原則和關(guān)鍵要素
2��、說(shuō)明如何收集并將患者體驗(yàn)數(shù)據(jù)納入整體臨床研發(fā)計(jì)劃和試驗(yàn)設(shè)計(jì)
3����、說(shuō)明與審評(píng)機(jī)構(gòu)溝通交流的重點(diǎn)內(nèi)容
總體原則
以患者為中心的藥物臨床試驗(yàn)設(shè)計(jì)的前提是仍應(yīng)滿足藥物臨床試驗(yàn)設(shè)計(jì)的一般原則。建議同時(shí)參考 ICH E8(R1)和國(guó)家藥監(jiān)局發(fā)布的《藥物臨床試驗(yàn)的一般考慮指導(dǎo)原則》����,以及針對(duì)特定疾病藥物研發(fā)的技術(shù)指導(dǎo)原則等。除此之外��,從以患者為中心的角度出發(fā)����,應(yīng)重點(diǎn)關(guān)注的原則有以下4點(diǎn):
(一)將患者需求貫穿藥物研發(fā)全過(guò)程
(二)臨床試驗(yàn)設(shè)計(jì)應(yīng)該體現(xiàn)患者需求
(三)應(yīng)該改善受試者體驗(yàn)、減輕受試者負(fù)擔(dān)
(四)加強(qiáng)早期和全過(guò)程溝通交流
“以患者為中心”的原則應(yīng)該貫穿藥物研發(fā)的全生命周期����,充分了解患者的“經(jīng)驗(yàn)、觀點(diǎn)�、需求和偏好”。粗略的將藥物研發(fā)分為“臨床前”、“臨床”和“上市后”:
從藥物開(kāi)發(fā)的臨床前階段甚至更早期就應(yīng)該根據(jù)擬定的適應(yīng)癥來(lái)確定產(chǎn)品的治療目標(biāo)����,針對(duì)這個(gè)適應(yīng)癥的治療現(xiàn)狀,以及治療藥物能夠讓患者達(dá)到治療結(jié)局��,以及當(dāng)前治療的不足�,來(lái)確定新研發(fā)的產(chǎn)品的臨床定位,根據(jù)臨床定位擬定潛在的優(yōu)勢(shì)��。此外����,根據(jù)未來(lái)的臨床定位,適應(yīng)癥人群��,來(lái)設(shè)計(jì)產(chǎn)品的劑型和遞送方式�。比如對(duì)于兒童患者人群,通常會(huì)將口服給藥劑型設(shè)計(jì)為溶液劑����、顆粒劑;對(duì)于重癥疾病患者��,無(wú)法經(jīng)口給藥的����,設(shè)計(jì)成注射劑更符合患者的實(shí)際需求��。
在臨床階段����,需要考慮參加臨床試驗(yàn)是否給患者帶來(lái)了額外的風(fēng)險(xiǎn)或者不適����。例如在NASH(非酒精性脂肪肝炎)的臨床試驗(yàn)中��,診斷和療效確認(rèn)都需要對(duì)患者做肝穿活檢�,該操作可能對(duì)患者參加臨床試驗(yàn)的意愿造成影響。
對(duì)于臨床試驗(yàn)終點(diǎn)指標(biāo)的選擇��,應(yīng)該關(guān)注患者對(duì)疾病帶來(lái)的不良影響的體驗(yàn)��,例如對(duì)于眩暈的治療����,對(duì)于患者而言更想達(dá)到的臨床終點(diǎn)是快速緩解眩暈的癥狀,而不是縮短眩暈持續(xù)時(shí)間(如從眩暈5天縮短到4天)�。
在臨床試驗(yàn)過(guò)程中,應(yīng)該盡可能的優(yōu)化試驗(yàn)的流程����,減輕患者的負(fù)擔(dān)�。如優(yōu)化采樣時(shí)間����,提供交通服務(wù)等。
藥品上市后�,患者需要對(duì)產(chǎn)品具有知情選擇權(quán),才有助于做出選擇��。而確保藥物的可及性也相當(dāng)重要�。
綜上所述,藥物開(kāi)發(fā)中需要“以終為始”��,在研發(fā)的全生命周期中考慮患者需求����,改善患者的體驗(yàn),減輕患者的負(fù)擔(dān)����,盡早與審評(píng)機(jī)構(gòu)進(jìn)行溝通交流。
以患者為中心的臨床試驗(yàn)設(shè)計(jì)的考慮
(一)以患者為中心的臨床整體研發(fā)計(jì)劃�。
藥物研發(fā)的終極目標(biāo)是使患者以最小的風(fēng)險(xiǎn)獲得最大的治療獲益,因此整體的研發(fā)計(jì)劃應(yīng)該以終為始����,在全流程中貫穿“以患者為中心”的原則����。
重要的是��,從臨床實(shí)踐中挖掘特定疾病未滿足的臨床需求����,根據(jù)已有信息,在充分調(diào)研的基礎(chǔ)上評(píng)估是否需要開(kāi)展收集患者體驗(yàn)數(shù)據(jù)的研究以及研究?jī)?nèi)容�,以解決臨床研發(fā)中重要的科學(xué)問(wèn)題��。例如����,對(duì)于某些發(fā)病率低、表型復(fù)雜��、臨床診療認(rèn)知有限的罕見(jiàn)疾病��,在開(kāi)展藥物研發(fā)之初�,可以先對(duì)擬開(kāi)發(fā)適應(yīng)癥開(kāi)展臨床調(diào)研和疾病自然史研究。
在整體研發(fā)計(jì)劃中應(yīng)該采取階段性的研究決策考慮和動(dòng)態(tài)調(diào)整�。例如����,為了支持在關(guān)鍵研究階段入選人群范圍更接近臨床目標(biāo)人群(如在某個(gè)成人與兒童共患適應(yīng)癥的成人研究中同時(shí)納入 12 歲以上青少年)�,需要在早期階段,結(jié)合臨床需求和藥物特點(diǎn)��,獲得相應(yīng)的非臨床和臨床證據(jù)�。擬用于后期的臨床結(jié)局評(píng)估工具應(yīng)在早期階段完成探索和初步驗(yàn)證。
在符合科學(xué)性的原則下����,優(yōu)化臨床研發(fā)策略,從而提高研發(fā)效率�。例如基于成人數(shù)據(jù)的兒科適應(yīng)癥外推、建模模擬輔助藥物研發(fā)��、適應(yīng)性設(shè)計(jì)等��,避免不必要的患者暴露��。
(二)收集患者體驗(yàn)數(shù)據(jù)的研究
在本指導(dǎo)原則中對(duì)“患者體驗(yàn)數(shù)據(jù)”的解釋是:所有由患者����、患者的家屬、監(jiān)護(hù)者�、看護(hù)者提供的對(duì)疾病和相關(guān)治療的經(jīng)驗(yàn)����、觀點(diǎn)��、需求和偏好等信息����。
FDA在2021年發(fā)布的《新藥和生物制品的獲益-風(fēng)險(xiǎn)評(píng)估供企業(yè)用的指導(dǎo)原則》中術(shù)語(yǔ)患者體驗(yàn)數(shù)據(jù)(patient experience data)包括:(1)是指由患者、患者家屬成員和家庭護(hù)理員��、患者權(quán)益組織��、疾病研究基金會(huì)�、研究人員和藥物生產(chǎn)商收集的數(shù)據(jù)。(2)旨在提供患者對(duì)疾病或狀況體驗(yàn)的信息����,包括:(a)這類(lèi)疾病或狀態(tài)或相關(guān)治療對(duì)患者生活的影響(包括身體和心理影響)��,以及(b)患者對(duì)這類(lèi)疾病或狀態(tài)的治療偏好��。
收集患者體驗(yàn)數(shù)據(jù)的研究�,就是指收集上述患者信息的研究,為藥物研發(fā)提供支持��,不同于具體的藥物臨床試驗(yàn)?���;颊唧w驗(yàn)數(shù)據(jù)研究的基本要素如下圖所示:
(三)以患者為中心的臨床試驗(yàn)設(shè)計(jì)要素
第1條要素:以患者需求為導(dǎo)向的研究目的
在確定研究目的時(shí),需考慮疾病的自然史��、試驗(yàn)藥物的治療目標(biāo)����、患者偏好信息等。
例如����,治療慢性膽汁淤積性肝病的藥物一般以改善疾病進(jìn)展為目的;但是這種疾病常常伴有瘙癢癥狀����,嚴(yán)重瘙癢會(huì)顯著影響患者的生活質(zhì)量,在這種情況下��,以改善瘙癢癥狀作為目標(biāo)適應(yīng)癥進(jìn)行新藥研發(fā)��,也可以為患者帶來(lái)臨床獲益��。
第2條要素:選擇合適的目標(biāo)人群
在藥物研發(fā)過(guò)程中,申辦者應(yīng)當(dāng)結(jié)合疾病特點(diǎn)����、藥物作用機(jī)制、已知安全性與有效性特征以及現(xiàn)有治療等��,納入獲益-風(fēng)險(xiǎn)比最優(yōu)的受試者��,并盡量促進(jìn)受試者人群的代表性��。
一方面��,納入最有可能從試驗(yàn)中獲益的患者����,以保障受試者的安全和權(quán)益。
例如��,對(duì)于缺乏有效的后線治療手段的疾病�,若試驗(yàn)藥物療效尚不明確,則后線治療患者相較一線治療患者更有可能從中獲益�。
例如�,如果作用機(jī)制或已有數(shù)據(jù)表明,試驗(yàn)藥物在生物標(biāo)志物陽(yáng)性的患者中有明顯的療效����,而在標(biāo)志物陰性的患者中療效較小甚至沒(méi)有療效����,則標(biāo)志物陽(yáng)性的患者最有可能從試驗(yàn)中獲益��;而在用于富集受試者的標(biāo)志物把握度不足�、標(biāo)志物陰性患者的治療手段受限的情況下,也可考慮納入標(biāo)志物陰性患者��。
另一方面����,不應(yīng)沒(méi)有任何科學(xué)理由地排除特定人群,比如兒童�、老年人、孕婦����、肝腎功能不全的患者等,如果同樣存在臨床需求��,那么應(yīng)該在前期研究數(shù)據(jù)支持的前提下盡量納入�,除非存在明顯安全性隱患,或有證據(jù)表明不太可能獲益�。
前瞻性地積累必要的支持性數(shù)據(jù)����,可以避免在后期臨床試驗(yàn)中對(duì)研究人群做不必要的限制��。
例如�,對(duì)于可能合并肝功能不全的慢性肝病適應(yīng)癥、或疾病本身常會(huì)對(duì)患者肝功能產(chǎn)生影響的罕見(jiàn)疾病����,在前期肝功能損害研究數(shù)據(jù)支持的前提下,在后期臨床試驗(yàn)中可考慮納入肝功能不全患者��,但要做好風(fēng)險(xiǎn)管理��。
第3個(gè)要素:選擇對(duì)于受試者最佳且可及的對(duì)照
臨床試驗(yàn)中的對(duì)照組選擇應(yīng)充分保障受試者獲得治療的權(quán)益����,符合倫理原則,例如某適應(yīng)癥已有上市且可及的標(biāo)準(zhǔn)治療藥物����,則不能選擇安慰劑做對(duì)照。
由于公認(rèn)的標(biāo)準(zhǔn)治療方案會(huì)不斷修訂��,預(yù)期適當(dāng)?shù)膶?duì)照組選擇將隨著時(shí)間的推移而發(fā)生變化����。因此,建議在結(jié)合患者體驗(yàn)數(shù)據(jù)����,選擇當(dāng)前臨床實(shí)踐中最佳且可及的治療的基礎(chǔ)上,關(guān)注其他可用治療����,評(píng)估未來(lái)一段時(shí)間內(nèi)治療需求的動(dòng)態(tài)變化,前瞻性地選擇對(duì)照組�。
總體而言,應(yīng)避免將次優(yōu)治療作為對(duì)照����,從而影響受試者的治療選擇。
若在臨床試驗(yàn)開(kāi)展過(guò)程中�,目標(biāo)適應(yīng)癥的標(biāo)準(zhǔn)治療發(fā)生變化,應(yīng)及時(shí)告知受試者��,保障受試者充分了解其它可選擇的治療手段�,并保障受試者自主選擇是否退出試驗(yàn)的權(quán)利。
第4個(gè)要素:基于臨床結(jié)局評(píng)估的有效性評(píng)價(jià)
臨床結(jié)局評(píng)估的定義:它是指來(lái)自患者及其看護(hù)者�、醫(yī)生或其他評(píng)估人員,用于評(píng)價(jià)患者個(gè)體感受����、功能或生存狀態(tài)的評(píng)估工具或手段��,通常需要主觀評(píng)估而非直接的事實(shí)呈現(xiàn)����。
根據(jù)不同報(bào)告者��,臨床結(jié)局評(píng)估分為:醫(yī)生報(bào)告結(jié)局(ClinRO)����、患者報(bào)告結(jié)局(PRO)、觀察者報(bào)告結(jié)局( ObsRO)��,還包括基于測(cè)試評(píng)估患者表現(xiàn)的功能結(jié)局(PerfO)����。
患者報(bào)告結(jié)局PRO 是直接由患者本人報(bào)告的癥狀、體征��、功能或其他方面的測(cè)量��,未經(jīng)醫(yī)生或其他人的外部修正和解釋��。測(cè)PRO的工具通常為量表����、問(wèn)卷調(diào)查�、數(shù)字評(píng)分或患者日志等��。例如�,患者整體評(píng)估(PGA)����、數(shù)字評(píng)分量表(NRS)等。
醫(yī)生報(bào)告結(jié)局ClinRO 是專業(yè)醫(yī)護(hù)人員基于檢查或觀察到的患者疾病和健康狀態(tài)的測(cè)量結(jié)果��,多涉及對(duì)于患者體征����、癥狀、行為或疾病相關(guān)的其他現(xiàn)象的臨床判斷或基于實(shí)驗(yàn)室指標(biāo)的臨床判斷�。例如,銀屑病面積和嚴(yán)重程度指數(shù)(PASI)等��。
觀察者報(bào)告結(jié)局 ObsRO 是由日常生活照護(hù)者報(bào)告的患者健康狀況結(jié)果的測(cè)量�。例如,照護(hù)者記錄的兒童癲癇發(fā)作頻率日記等��。
基于測(cè)試評(píng)估患者表現(xiàn)的功能結(jié)局PerfO 是患者完成一項(xiàng)標(biāo)準(zhǔn)化的功能任務(wù)時(shí)�,由經(jīng)過(guò)適當(dāng)培訓(xùn)的人員或患者獨(dú)自評(píng)估的測(cè)量值��。例如����,6分鐘步行試驗(yàn)�, 6MWT,即患者6分鐘內(nèi)的步行距離��,用于分析心血管和肺部疾病患者功能能力����。
此外,復(fù)合型臨床結(jié)局評(píng)估工具中可能包含多種類(lèi)型的臨床結(jié)局評(píng)估����,如 ClinRO 和 PRO 的組合等。
如何選擇與目的相符的臨床結(jié)局評(píng)估工具�?:
•對(duì)于有癥狀或功能障礙的病癥,一般采用 PRO評(píng)估����,因?yàn)樗鼈兲峁┝嘶颊吒惺芎凸δ荏w驗(yàn)的直接證據(jù)。
•當(dāng)患者不能提供自我報(bào)告時(shí)��,往往需要基于觀察體征、事件的報(bào)告或反映患者感受和功能的行為來(lái)報(bào)告(例如 ClinRO����、 ObsRO),不鼓勵(lì)由其他人代替患者從患者視角進(jìn)行報(bào)告的間接測(cè)量方法��。
•在需要臨床判斷來(lái)解釋觀察結(jié)果的情況下��,應(yīng)該使用 ClinRO 評(píng)估��,例如評(píng)估斑塊型銀屑病的銀屑病皮損面積及嚴(yán)重性指數(shù)( PASI)�。
•PerfO 測(cè)量可用于通過(guò)一項(xiàng)或一系列的標(biāo)準(zhǔn)化任務(wù)����,以標(biāo)準(zhǔn)化的方式評(píng)估患者的功能(例如:測(cè)量運(yùn)動(dòng)功能和認(rèn)知功能等)。
第5個(gè)要素:在安全性監(jiān)測(cè)中納入患者體驗(yàn)數(shù)據(jù)
藥物的安全性風(fēng)險(xiǎn)是患者選擇藥物時(shí)考慮的重要因素之一�。
通過(guò)前期收集患者體驗(yàn)數(shù)據(jù)的結(jié)果,可以了解患者對(duì)于特定不良反應(yīng)的看法和耐受程度�,在臨床試驗(yàn)設(shè)計(jì)中重點(diǎn)收集患者關(guān)注、耐受度較差從而影響其依從性的事件�,尤其對(duì)于毒性較大、用藥療程長(zhǎng)的藥物����。例如,在評(píng)價(jià)治療慢性腎病貧血藥物的安全性風(fēng)險(xiǎn)時(shí)��,納入主要心血管不良事件(心血管死亡、心肌梗死和卒中)作為安全性終點(diǎn)��。關(guān)注癥狀性不良事件的評(píng)估(如惡心�、疼痛等),可以選擇 PRO 測(cè)量�,以直接反映患者的感受。
臨床試驗(yàn)設(shè)計(jì)中應(yīng)體現(xiàn)有效的風(fēng)險(xiǎn)管理�,以保障受試者安全。尤其對(duì)于特殊人群和安全性風(fēng)險(xiǎn)較高的受試者����,必要時(shí)考慮制定針對(duì)性的風(fēng)險(xiǎn)管理措施,包括完善必要的評(píng)估檢查��,在給藥和隨訪過(guò)程中設(shè)置適當(dāng)?shù)谋O(jiān)測(cè)項(xiàng)目與頻率(或在必要時(shí)進(jìn)行非計(jì)劃監(jiān)測(cè))����,以及針對(duì)性的預(yù)防/處理方法和隨訪計(jì)劃等。例如在CART項(xiàng)目中�,CRS和ICANS是最應(yīng)關(guān)注的AE,那么在細(xì)胞回輸以后�,會(huì)持續(xù)的進(jìn)行生命體征監(jiān)測(cè)、心電監(jiān)護(hù)�、血氧飽和度,提前備好托珠單抗這類(lèi)藥品。
如何與審評(píng)機(jī)構(gòu)的進(jìn)行溝通交流��?
審評(píng)機(jī)構(gòu)鼓勵(lì)申請(qǐng)人從藥物研發(fā)的早期階段積極的進(jìn)行溝通交流�。CDE鼓勵(lì)溝通的內(nèi)容如下:
綜合來(lái)講,如果在臨床開(kāi)發(fā)過(guò)程中選擇臨床結(jié)局評(píng)估終點(diǎn)��,那么申請(qǐng)人需要證明這個(gè)臨床結(jié)局評(píng)估是合理的��、可行的����,并具有度量性、信度����,并據(jù)此與監(jiān)管進(jìn)行溝通����。
參考文獻(xiàn):
1.以患者為中心的藥物臨床試驗(yàn)設(shè)計(jì)技術(shù)指導(dǎo)原則(試行),國(guó)家藥監(jiān)局藥審中心��,2023年7月27日����。
2.以患者為中心的藥物臨床試驗(yàn)實(shí)施技術(shù)指導(dǎo)原則(試行),國(guó)家藥監(jiān)局藥審中心,2023年7月27日��。
3.以患者為中心的藥物獲益-風(fēng)險(xiǎn)評(píng)估技術(shù)指導(dǎo)原則(試行)��,國(guó)家藥監(jiān)局藥審中心��,2023年7月27日��。
4. 組織患者參與藥物研發(fā)的一般考慮指導(dǎo)原則(試行)�,國(guó)家藥監(jiān)局藥審中心,2022 年 11 月��。
5. 患者報(bào)告結(jié)局在藥物臨床研發(fā)中應(yīng)用的指導(dǎo)原則(試行)����,國(guó)家藥監(jiān)局藥審中心,2021 年 12 月�。





