連續(xù)流動(dòng)化學(xué)是一項(xiàng)很有前景的新興制藥技術(shù),具有可縮短生產(chǎn)周期�����、自動(dòng)化程度較高�����、環(huán)境友好�����、節(jié)能減排等優(yōu)點(diǎn)�����,尤其有利于批次模式難以進(jìn)行的反應(yīng),是原料藥(即活性藥物成分,API) 技術(shù)革新的趨勢(shì)�����。但由于質(zhì)量控制和監(jiān)管的原因�����,長(zhǎng)期以來(lái)連續(xù)流技術(shù)在制藥行業(yè)推廣緩慢�����。ICH 指導(dǎo)原則《Q13 :原料藥和制劑的連續(xù)制造》的頒布,提出了原料藥工藝開(kāi)發(fā)要點(diǎn)和控制策略�����,監(jiān)管期望逐漸明晰�����。該文結(jié)合新頒布的ICH Q13,綜述連續(xù)流動(dòng)化學(xué)的特點(diǎn)�����、應(yīng)用場(chǎng)景和質(zhì)量考量,通過(guò)文獻(xiàn)案例分享�����,進(jìn)一步說(shuō)明連續(xù)流動(dòng)化學(xué)開(kāi)發(fā)要點(diǎn)和控制策略,以期推動(dòng)連續(xù)流動(dòng)化學(xué)在國(guó)內(nèi)制藥企業(yè)的應(yīng)用�����,提升行業(yè)制造水平�����,努力實(shí)現(xiàn)國(guó)家的“雙碳”目標(biāo)�����。
原料藥[即活性藥物成分(active pharmaceutical ingredient,API)] 供應(yīng)是確保廣大患者藥品可及性的前提�����,在集采背景下尤為重要�����。隨著國(guó)家“雙碳”目標(biāo)的制定�����,國(guó)家發(fā)展和改革委員會(huì)�����、工業(yè)和信息化部于2021年11月初頒布了關(guān)于推動(dòng)原料藥產(chǎn)業(yè)高質(zhì)量發(fā)展實(shí)施方案的通知,原料藥生產(chǎn)技術(shù)的創(chuàng)新升級(jí)朝著綠色化�����、低碳化轉(zhuǎn)型已是必然的趨勢(shì)[1]�����。連續(xù)流動(dòng)化學(xué)是一種化工過(guò)程強(qiáng)化技術(shù)�����,應(yīng)用微通道反應(yīng)、固定床�����、連續(xù)攪拌釜等微反應(yīng)器實(shí)現(xiàn)連續(xù)生產(chǎn)�����,具有本質(zhì)安全�����、可迅速擴(kuò)大產(chǎn)能的特點(diǎn)�����,是工信部�����、生態(tài)環(huán)境部、國(guó)家衛(wèi)健委�����、國(guó)家藥監(jiān)局等四部委重點(diǎn)推薦的綠色制藥技術(shù)[2],也是保證原料藥供應(yīng)鏈安全的關(guān)鍵技術(shù)�����。
連續(xù)流技術(shù)在大化工領(lǐng)域已大規(guī)模使用�����,體現(xiàn)出許多明顯的優(yōu)勢(shì)�����,但該技術(shù)在原料藥生產(chǎn)中的應(yīng)用進(jìn)展緩慢�����,尤其是多步整合連續(xù)生產(chǎn)的原料藥品種更少,近年來(lái)只有1 個(gè)品種在FDA 獲批[3]�����。FDA 藥品評(píng)價(jià)和研究中心原主任WOODCOCK 認(rèn)為連續(xù)制造技術(shù)應(yīng)用的主要障礙是進(jìn)入的成本較高和審評(píng)周期長(zhǎng)[4]�����。為了幫助制藥公司了解連續(xù)制造的監(jiān)管考慮和設(shè)施檢查、增強(qiáng)投資信心�����,F(xiàn)DA于2019 年發(fā)布了《工業(yè)連續(xù)制造的質(zhì)量考量》草案[5]�����,并征求意見(jiàn)�����,但該指南只針對(duì)小分子藥物的口服制劑�����。2021年,人用藥品技術(shù)要求國(guó)際協(xié)調(diào)理事會(huì)(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use�����,ICH) 終于發(fā)布了首個(gè)涉及原料藥連續(xù)制造的監(jiān)管文件Q13[6]�����,即《原料藥和制劑的連續(xù)制造》�����,囊括了原料藥和制劑的連續(xù)制造,為連續(xù)制造提供了研究指南�����。
ICH Q13 草案對(duì)連續(xù)制造及其批次進(jìn)行了定義�����,指導(dǎo)控制策略建立�����,討論了工藝確證和工藝變更的研究方法�����。該指南草案結(jié)合實(shí)際提出了對(duì)連續(xù)制造產(chǎn)品的監(jiān)管考量,并且在附件中以案例的形式幫助申請(qǐng)者理解,撰寫(xiě)水平較高且不教條。本研究梳理了Q13 草案和相關(guān)文獻(xiàn)�����,并結(jié)合課題組近年在連續(xù)流合成工藝方面的研究體會(huì)作一綜述�����,以期將這一技術(shù)應(yīng)用于中間體和原料藥的生產(chǎn)�����,降低制造成本和節(jié)能減排�����,以推動(dòng)這一先進(jìn)制備技術(shù)在化學(xué)原料藥生產(chǎn)上的應(yīng)用�����。
1�����、連續(xù)流技術(shù)的特點(diǎn)
連續(xù)流技術(shù)給原料藥生產(chǎn)帶來(lái)的最明顯優(yōu)勢(shì)就是可以顯著縮短生產(chǎn)周期�����,尤其是多步整合連續(xù)生產(chǎn)的模式�����。與傳統(tǒng)批次生產(chǎn)不同�����,不間斷的連續(xù)生產(chǎn)一般要求采用過(guò)程分析技術(shù)( process analysis technology,PAT) 和設(shè)備對(duì)質(zhì)量進(jìn)行在線監(jiān)測(cè),由于無(wú)需等每步中間體檢測(cè)合格后才能進(jìn)入下一步�����,可減少大量等待時(shí)間�����。其他的一些特點(diǎn)具體如下:
①自動(dòng)化程度高�����,全程涉及生產(chǎn)人員較少,可降低人為錯(cuò)誤風(fēng)險(xiǎn)�����,保障產(chǎn)品質(zhì)量[7]。
②連續(xù)流反應(yīng)器持液量小�����,傳熱�����、傳質(zhì)快�����,可安全地使用在釜式反應(yīng)中需要避免的工藝條件�����,如高溫(高壓) 下的反應(yīng)和超快速放熱反應(yīng)。此外�����,連續(xù)流反應(yīng)中還可以安全使用危險(xiǎn)性較大�����、不適于釜式反應(yīng)的試劑,如一些高毒和高活試劑[8]�����。
③微反應(yīng)器的流體基本是平推流[9]�����,“三傳一反”調(diào)控容易,放大效應(yīng)小�����,從實(shí)驗(yàn)室開(kāi)發(fā)到生產(chǎn)放大周期短�����,可快速形成產(chǎn)能�����,尤其適合那些服務(wù)創(chuàng)新藥公司的合同定制研發(fā)生產(chǎn)機(jī)構(gòu)及合同定制生產(chǎn)機(jī)構(gòu)�����,縮短工藝開(kāi)發(fā)和供樣周期[10]�����。
④連續(xù)流設(shè)施占地面積小�����,可減少寶貴的藥品生產(chǎn)質(zhì)量管理規(guī)范(Good Manufacturing Practice of Medical Products�����,GMP) 設(shè)施空間�����,大大減少工廠固定資產(chǎn)投入和運(yùn)營(yíng)成本�����。美國(guó)CONTINUUS Pharmaceuticals 公司的案例顯示�����,采用集成的連續(xù)制造�����,固定資產(chǎn)投入可減少90%�����,API 生產(chǎn)運(yùn)營(yíng)成本降低33.6%,片劑生產(chǎn)降低29.4% [11]�����。
2�����、連續(xù)流技術(shù)的應(yīng)用
對(duì)于醫(yī)藥行業(yè)�����,應(yīng)用新的制造技術(shù)的目的是期望加強(qiáng)藥品供應(yīng)鏈穩(wěn)定性�����,使其更加高效和適應(yīng)性更強(qiáng)�����,最終為患者帶來(lái)好處�����。將連續(xù)流技術(shù)應(yīng)用于原料藥生產(chǎn)不僅要考慮具體品種情況�����,如工藝是否適合�����、是否要求專線�����、創(chuàng)新藥還是仿制藥等因素�����,還要平衡產(chǎn)能與市場(chǎng)需求�����,不是簡(jiǎn)單地在批次生產(chǎn)和連續(xù)生產(chǎn)之間做“二元”選擇�����。一般認(rèn)為�����,連續(xù)流技術(shù)更適合批量小的特色原料藥或者需求很大的基礎(chǔ)原料藥[12]�����。
3�����、連續(xù)流生產(chǎn)的質(zhì)量考量
3.1批量范圍
傳統(tǒng)間歇式生產(chǎn)工藝的注冊(cè)批量與起始原料的投料量相關(guān)�����,根據(jù)注冊(cè)批的投料量和收率范圍確定商業(yè)化批量�����,批量范圍一般較窄�����。而Q13 草案對(duì)連續(xù)制造的批量要求相對(duì)靈活�����,不僅可以根據(jù)輸入物料量和輸出物料量制定�����,還可以規(guī)定運(yùn)行時(shí)間(限定質(zhì)量流量)�����,通過(guò)定義最小和最大運(yùn)行時(shí)間來(lái)確定批量范圍。甚至還允許其他基于連續(xù)制造工藝特征的科學(xué)合理的方法來(lái)定義批量�����,批量的范圍將更加靈活�����,更有利于制造商根據(jù)需求安排產(chǎn)能�����,減少倉(cāng)儲(chǔ)成本�����。
3.2設(shè)備的設(shè)計(jì)和整合
生產(chǎn)設(shè)備情況是原料藥申報(bào)資料里需要提供的內(nèi)容�����。傳統(tǒng)間歇釜只需提供每個(gè)設(shè)備型號(hào)及技術(shù)參數(shù)�����,但是連續(xù)流設(shè)備大多是定制化設(shè)備�����,需要提供更多的內(nèi)容�����。ICH Q13 草案中要求對(duì)設(shè)備設(shè)計(jì)或配置以及系統(tǒng)整合的任何方面都要進(jìn)行詳細(xì)描述�����,其附件Ⅰ提供了原料藥連續(xù)生產(chǎn)的示例�����,包括了由2步連續(xù)反應(yīng)和1步批次反應(yīng)組成的混合工藝連續(xù)生產(chǎn)案例�����。該示例從控制策略�����、工藝穩(wěn)健性�����、長(zhǎng)期性能、工藝驗(yàn)證和監(jiān)管考慮幾個(gè)方面進(jìn)行了詳細(xì)描述和討論�����,易于理解�����,此處不再贅述�����,但需要指出的是�����,質(zhì)量保證(quality assurance�����,QA) 部門(mén)應(yīng)建立適合連續(xù)流設(shè)備性能和穩(wěn)定性的驗(yàn)收標(biāo)準(zhǔn)(例如包括參數(shù)差異和偏移�����,以及瞬時(shí)干擾的發(fā)生)�����,以支持連續(xù)生產(chǎn)工藝的開(kāi)發(fā)和運(yùn)行�����。連續(xù)生產(chǎn)方式需要通過(guò)長(zhǎng)時(shí)間運(yùn)行來(lái)達(dá)到預(yù)定批量大小�����,因此設(shè)備的穩(wěn)健性對(duì)質(zhì)量的影響至關(guān)重要�����。
3.3工藝過(guò)程控制
連續(xù)流技術(shù)是一個(gè)動(dòng)態(tài)的過(guò)程�����,在過(guò)程的每個(gè)時(shí)點(diǎn)�����,微通道的前后各個(gè)位點(diǎn)料液的組分比例均不同�����,對(duì)于多步整合的連續(xù)流反應(yīng),不同位點(diǎn)的組分可能都不同�����。前一個(gè)位點(diǎn)的反應(yīng)程度如果由于干擾發(fā)生變化�����,必將影響下一個(gè)位點(diǎn)的質(zhì)量�����,經(jīng)過(guò)連續(xù)疊加�����,將導(dǎo)致終產(chǎn)品質(zhì)量產(chǎn)生較大偏差�����,因此在連續(xù)流反應(yīng)中�����,輕微的擾動(dòng)就可能導(dǎo)致產(chǎn)品質(zhì)量發(fā)生較大偏差。Q13 草案中明確要求建立工藝監(jiān)測(cè)和維持受控狀態(tài)的穩(wěn)健方法�����,在附件中進(jìn)行了重點(diǎn)描述�����,要求增加多個(gè)PAT 裝置�����,精確控制進(jìn)料的濃度和流速�����,監(jiān)測(cè)每一步的質(zhì)量�����,根據(jù)上一步中間體的質(zhì)量水平�����,反饋控制下一步物料添加流速�����,達(dá)到控制反應(yīng)�����、維持受控狀態(tài)的目的�����。
對(duì)于擾動(dòng)的管理是不同于傳統(tǒng)批次工藝的重要內(nèi)容�����。Q13 草案要求基于設(shè)備的停留時(shí)間分布(remain time distribution�����,RTD) 開(kāi)發(fā)合適的擾動(dòng)檢測(cè)�����、糾正措施以及物料分流策略�����。對(duì)干擾的研究一般處于工藝開(kāi)發(fā)的后期,通過(guò)動(dòng)態(tài)模擬的方法�����,了解反應(yīng)過(guò)程動(dòng)力學(xué)與輸入物料屬性�����、工藝參數(shù)和設(shè)備參數(shù)的關(guān)系�����,這些知識(shí)可以幫助識(shí)別和評(píng)估風(fēng)險(xiǎn)�����。Q13 草案的附件Ⅴ提供的案例可供參考�����,通過(guò)一系列基于RTD 的干擾幅度和持續(xù)時(shí)間的分析�����,采用漏斗圖工具�����,評(píng)估工藝對(duì)擾動(dòng)的大小或持續(xù)時(shí)間的容忍度�����,再根據(jù)評(píng)估結(jié)果制定物料分流點(diǎn)和分流決策�����,還給出了物料分流決策樹(shù)�����。這方面研究結(jié)果是注冊(cè)資料中工藝開(kāi)發(fā)章節(jié)須重點(diǎn)提供的內(nèi)容�����。
3.4清潔驗(yàn)證
現(xiàn)有GMP 體系帶來(lái)最大的挑戰(zhàn)之一是連續(xù)流設(shè)備的清潔驗(yàn)證�����。連續(xù)流動(dòng)化學(xué)應(yīng)用最多的是微通道反應(yīng)器�����,反應(yīng)模塊通道直徑為毫米級(jí);為了保持密封性�����,一般都采用一體成型�����,通道無(wú)法打開(kāi)清洗�����。商業(yè)化的微通道反應(yīng)器往往會(huì)根據(jù)工藝的混合要求�����,定制特殊設(shè)計(jì)的通道�����,這使得反應(yīng)器里可能殘留的組分種類更多�����,尤其是多步連續(xù)的設(shè)施內(nèi)組分更加復(fù)雜�����,如何清洗�����、如何取樣都給生產(chǎn)商和監(jiān)管機(jī)構(gòu)帶來(lái)了困惑�����。Q13 草案中沒(méi)有提供清潔方法開(kāi)發(fā)指南�����,建議申請(qǐng)人可以參考FDA 于2019 年發(fā)布的“連續(xù)制造的質(zhì)量考量征求意見(jiàn)稿”[13]�����。該指南建議首先應(yīng)從開(kāi)發(fā)和工藝放大(例如增加生產(chǎn)運(yùn)行時(shí)間)研究中獲得的知識(shí)來(lái)開(kāi)發(fā)和定義清潔方法�����,然后定期驗(yàn)證以確認(rèn)持續(xù)的有效性�����。清潔程序應(yīng)基于在操作期間和拆卸后密切監(jiān)控物料的結(jié)果而建立,方案的制定應(yīng)考慮以下幾點(diǎn):
①檢查物料在設(shè)備�����、管道�����、過(guò)濾器和儀器上的滯留和積聚�����,包括在線分析儀和傳感器�����;
②在運(yùn)行過(guò)程中關(guān)注生產(chǎn)線上的物料降解�����、形成的化學(xué)膜和微生物生長(zhǎng)�����;
③清潔驗(yàn)證期間的評(píng)估條件應(yīng)考慮在預(yù)期最差條件( 例如延長(zhǎng)生產(chǎn)時(shí)間)下的潛在故障模式( 例如結(jié)垢和磨損)�����。
3.5質(zhì)量標(biāo)準(zhǔn)制定
對(duì)于多步整合連續(xù)生產(chǎn)的品種�����,過(guò)程中不分離中間體�����,連續(xù)反應(yīng)時(shí)需要制定過(guò)程中監(jiān)測(cè)或控制的可接受標(biāo)準(zhǔn)和采樣計(jì)劃�����,成品的實(shí)時(shí)檢測(cè)放行的方法和標(biāo)準(zhǔn)�����,這些方法和標(biāo)準(zhǔn)的建立不同于傳統(tǒng)生產(chǎn)方式�����,需要基于PAT 設(shè)備進(jìn)行全新開(kāi)發(fā)�����。如應(yīng)用在線液相色譜法對(duì)中間體質(zhì)量進(jìn)行監(jiān)控,檢測(cè)結(jié)果用于前饋和反饋控制�����。在線液相色譜的方法開(kāi)發(fā)不同于傳統(tǒng)離線液相色譜的方法開(kāi)發(fā)�����,首先要求結(jié)果盡快響應(yīng)�����,其次除了要開(kāi)發(fā)液相色譜方法以外還需要開(kāi)發(fā)樣品在線處理方法�����,如樣品淬滅�����、稀釋�����、過(guò)濾方法�����,并通過(guò)方法學(xué)驗(yàn)證�����,這些工作給質(zhì)量分析人員提出了新的挑戰(zhàn)�����。
總之�����,連續(xù)流生產(chǎn)的質(zhì)量控制策略的制定對(duì)于國(guó)內(nèi)制造商和監(jiān)管機(jī)構(gòu)都是新的挑戰(zhàn)�����,需要雙方加強(qiáng)溝通�����,共同努力�����,逐漸完善法規(guī)和指南。
4�����、原料藥連續(xù)生產(chǎn)案例
連續(xù)流技術(shù)應(yīng)用于原料藥生產(chǎn)的優(yōu)勢(shì)和挑戰(zhàn)并存�����。連續(xù)制造目前在國(guó)內(nèi)尚處于起步狀態(tài)�����,國(guó)外雖然發(fā)展多年�����,但目前獲批上市的連續(xù)制造產(chǎn)品主要是制劑產(chǎn)品[14]�����,公開(kāi)報(bào)道的只有葛蘭素公司的丙酸氟替卡松作為連續(xù)制造的原料藥獲批[15]�����。為了進(jìn)一步理解連續(xù)流工藝的開(kāi)發(fā)和質(zhì)量考量�����,本研究介紹2個(gè)GMP 階段的原料藥文獻(xiàn)典型案例�����,供同仁參考�����。
4.1單步連續(xù)流生產(chǎn)[16]
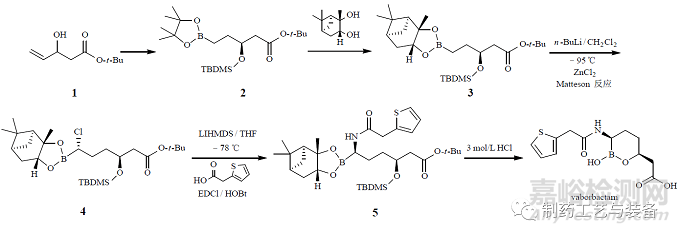
Vaborbactam 是美國(guó)Rempex公司開(kāi)發(fā)的一種環(huán)硼酸β-內(nèi)酰胺酶抑制劑�����。2017 年FDA 批準(zhǔn)vaborbactam 與美羅培南合用�����,用于治療復(fù)雜的尿路感染和腎盂腎炎�����, 商品名為Vabomere�����。Vaborbactam 的制備工藝見(jiàn)圖1。
圖1 Vaborbactam 的制備工藝
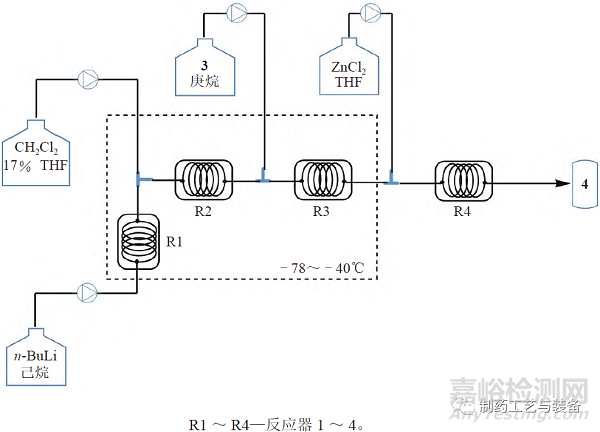
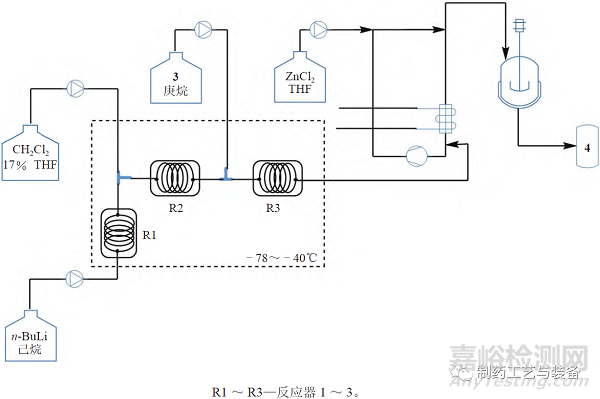
其中關(guān)鍵中間體α- 氯代烷基硼酸酯(4)的制備需要在超低溫(–100 ~ –95 ℃ ) 條件下進(jìn)行�����,商業(yè)化生產(chǎn)很困難�����,制造商決定將該步反應(yīng)由批次反應(yīng)變更為連續(xù)生產(chǎn)�����,小試反應(yīng)設(shè)備流程圖見(jiàn)圖2�����。采用連續(xù)化生產(chǎn)�����,收率可由75%提高到90%�����,但是在放大過(guò)程中發(fā)現(xiàn)氯化鋅淬滅反應(yīng)時(shí)會(huì)產(chǎn)生固體,堵塞通道�����,而且放熱明顯�����,導(dǎo)致非對(duì)映異構(gòu)體含量增加�����。制造商重新設(shè)計(jì)了淬滅工序的設(shè)備�����,改成連續(xù)循環(huán)淬滅設(shè)備�����,見(jiàn)圖3�����。
圖2 Vaborbactam 中間體4的小試連續(xù)反應(yīng)流程圖
圖3 Vaborbactam 中間體4的連續(xù)生產(chǎn)流程圖
優(yōu)化后的連續(xù)反應(yīng)設(shè)備經(jīng)過(guò)長(zhǎng)時(shí)間運(yùn)行�����,證明了裝置的穩(wěn)健性�����,轉(zhuǎn)化率超過(guò)90%�����,選擇性超過(guò)95%�����,產(chǎn)能達(dá)到百公斤級(jí)�����。隨后制造商又定制一套相同設(shè)備�����,將中間體4 的cGMP 商業(yè)化產(chǎn)能提高到噸級(jí)�����,這些連續(xù)化生產(chǎn)設(shè)施于2017年通過(guò)了FDA的審核。
4.2多步連續(xù)流生產(chǎn)[17]
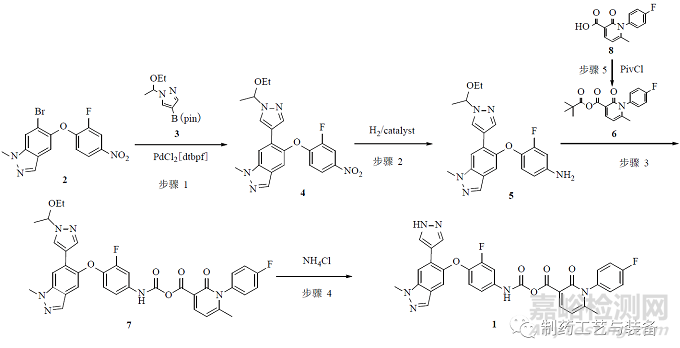
Merestinib 由美國(guó)禮來(lái)公司開(kāi)發(fā)�����,用于治療晚期實(shí)體瘤�����,目前將進(jìn)入Ⅲ期臨床試驗(yàn)�����。Ⅲ期臨床試驗(yàn)前樣品由禮來(lái)公司采用連續(xù)流技術(shù)制備�����,為了降低成本�����、縮短周期�����,Ⅲ期臨床試驗(yàn)樣品轉(zhuǎn)移給合同加工外包公司合全藥業(yè)負(fù)責(zé)�����,在cGMP 條件下生產(chǎn)183 kg 產(chǎn)品的生產(chǎn)周期為25 d�����,工藝路線見(jiàn)圖4�����。
圖4 Merestinib 的合成工藝路線
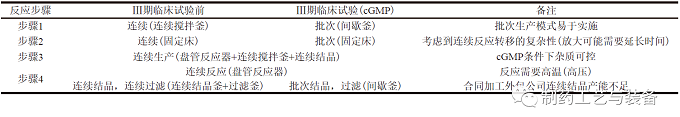
Ⅲ期臨床試驗(yàn)前�����,禮來(lái)公司采用全連續(xù)的方式制備樣品�����,而制備Ⅲ期臨床試驗(yàn)樣品時(shí)為了適應(yīng)cGMP的生產(chǎn)和進(jìn)度要求�����,變更為批次和連續(xù)混合工藝�����,具體變化見(jiàn)表1。
表1 Ⅲ期臨床試驗(yàn)前后的工藝變化
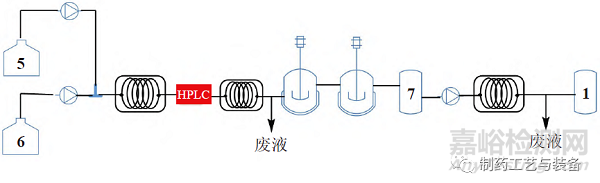
由表1可見(jiàn)�����,雖然該產(chǎn)品的最初工藝是全連續(xù)制造工藝�����,但到了cGMP 生產(chǎn)階段�����,為了滿足監(jiān)管要求且考慮到時(shí)間成本�����,最終只是將步驟3和步驟4進(jìn)行了連續(xù)生產(chǎn)(反應(yīng)設(shè)備流程圖見(jiàn)圖5)�����,其他都改成傳統(tǒng)批次生產(chǎn),可見(jiàn)采用連續(xù)流方式進(jìn)行原料藥的合規(guī)生產(chǎn)還存在較大挑戰(zhàn)�����。為了研究連續(xù)反應(yīng)過(guò)程�����,對(duì)于雜質(zhì)的產(chǎn)生和清除情況�����,禮來(lái)公司在步驟3應(yīng)用了在線HPLC 監(jiān)控反應(yīng)�����,每30 min 檢測(cè)1次�����,根據(jù)結(jié)果反饋調(diào)整工藝操作�����,包括:
①繼續(xù)反應(yīng)�����;
②調(diào)整原料5和6的進(jìn)料比;
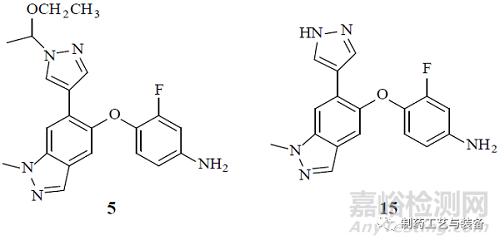
③如超出標(biāo)準(zhǔn)范圍�����,切換閥門(mén)�����,進(jìn)入廢液管線排走�����。經(jīng)過(guò)連續(xù)17 d 的連續(xù)運(yùn)行監(jiān)控�����,結(jié)果顯示�����,未轉(zhuǎn)化的中間體5控制在0.05%�����,產(chǎn)物中間體7的純度不小于99%�����,剩余雜質(zhì)是中間體6 和8�����,均在可接受范圍內(nèi)�����。步驟4可能產(chǎn)生2個(gè)基因毒性雜質(zhì)5和15(結(jié)構(gòu)見(jiàn)圖6)�����,cGMP 生產(chǎn)過(guò)程采用LC-MS 離線檢測(cè)�����,每8 h檢測(cè)放行�����,連續(xù)運(yùn)行17 d,粗品中2個(gè)基因毒性雜質(zhì)均不超過(guò)80×10–6�����,精制后不超過(guò)10×10–6(Ⅱ期臨床樣品控制70×10–6)�����,確保了成品質(zhì)量�����。
圖5 Merestinib 合成過(guò)程中步驟3和步驟4的連續(xù)生產(chǎn)流程圖
圖6 Merestinib 雜質(zhì)5和15的結(jié)構(gòu)式
5�����、結(jié)語(yǔ)
連續(xù)流技術(shù)是制藥工業(yè)很有前景的新技術(shù)�����,可以減少藥品的質(zhì)量問(wèn)題�����,降低生產(chǎn)成本�����,提高患者對(duì)優(yōu)質(zhì)藥品的可及性[18]�����。在明確的監(jiān)管指南發(fā)布以前�����,連續(xù)流工藝開(kāi)發(fā)和監(jiān)管要點(diǎn)對(duì)于申請(qǐng)人和監(jiān)管者都是全新的挑戰(zhàn)�����,采用連續(xù)制造工藝申請(qǐng)注冊(cè)獲批上市的投入可能會(huì)超過(guò)獲益�����。ICH Q13 草案的頒布�����,為行業(yè)和監(jiān)管機(jī)構(gòu)在制藥中應(yīng)用連續(xù)生產(chǎn)技術(shù)提供了指導(dǎo)�����,但是該文件目前還只能作為一個(gè)綱領(lǐng)性指導(dǎo),還需要各國(guó)藥品監(jiān)管機(jī)構(gòu)針對(duì)本國(guó)國(guó)情制定操作性更強(qiáng)的指導(dǎo)原則�����。作為原料藥研究人員�����,筆者建議國(guó)內(nèi)的藥品監(jiān)管機(jī)構(gòu)也成立類似美國(guó)FDA的新技術(shù)小組�����,加大ICH Q13 草案的宣傳�����,組織學(xué)術(shù)界和業(yè)界專家制定細(xì)則�����,指導(dǎo)工藝開(kāi)發(fā)工作�����,實(shí)施過(guò)程監(jiān)控方法和標(biāo)準(zhǔn)的建立以及監(jiān)管考量�����,制定實(shí)時(shí)檢測(cè)放行標(biāo)準(zhǔn)等�����。在生產(chǎn)體系方面應(yīng)明確那些與傳統(tǒng)批次生產(chǎn)差別較大的文件和規(guī)范的制定原則和監(jiān)管期望�����,如連續(xù)設(shè)備確認(rèn)和維護(hù)�����、干擾管理和清潔驗(yàn)證等�����,并且在實(shí)踐中不斷更新和完善�����。希望有更多原料藥生產(chǎn)企業(yè)應(yīng)用連續(xù)流技術(shù)�����,共同推動(dòng)該技術(shù)的發(fā)展,提升行業(yè)制造水平�����,盡早實(shí)現(xiàn)國(guó)家的“雙碳”目標(biāo)�����。
參考文獻(xiàn)
[1] 國(guó)家發(fā)展和改革委員會(huì).關(guān)于推動(dòng)原料藥產(chǎn)業(yè)高質(zhì)量發(fā)展實(shí)施方案的通知[EB/OL].[2022-04-21].https://www.ndrc.gov.cn/xwdt/tzgg/202111/t20211109_1303462.html?code=&state=123.
[2] 工業(yè)和信息化部, 生態(tài)環(huán)境部, 國(guó)家衛(wèi)生健康委, 等.關(guān)于印發(fā)《推動(dòng)原料藥產(chǎn)業(yè)綠色發(fā)展的指導(dǎo)意見(jiàn)》的通知[EB/OL].[2022-04-21].https://wap.miit.gov.cn/jgsj/xfpgys/wjfb/art/2020/art_95a430a0a0bf40ab82dca23e84efc185.html.
[3] FDA.2020 OPQ Annual Report [EB/OL].[2022-04-21].https://www.fda.gov/media/145830/download.
[4] FDA.August 2018: FDA's comprehensive effort to advance new innovations: initiatives to modernize for innovation[EB/OL].(2015-04-30)[2022-04-21].https://www.outsourcing-pharma.com/Article/2015/05/01/FDA-callson-manufacturers-to-begin-switch-from-batch-to-continuousproduction.
[5] FDA.FDA statement on FDA’s modern approach toadvanced pharmaceutical manufacturing [EB/OL].(2015-04-30)[2022-04-21].https://www.fda.gov/news-events/press-announcements/fda-statement-fdas-modern-approachadvanced-pharmaceutical-manufacturing.
[6] 國(guó)家藥品監(jiān)督管理局藥品審評(píng)中心.關(guān)于公開(kāi)征求ICH指導(dǎo)原則《Q13: 原料藥和制劑的連續(xù)制造》意見(jiàn)的通知[EB/OL].(2021-10-18)[2022-0421]https://www.cde.org cn/main/news/viewInfoCommon/d30747763265e07fae058d565519070.
[7] FDA.Advancement of emerging technology applications for pharmaceutical innovation and modernization: guidance for industry [EB/OL].[2022-04-21].https://www.fda.gov/regulatory-information/search-fda-guidancedocuments/advancement-emerging-technology-applicationspharmaceuticalinnovation-and-modernization-guidance.
[8] DALLINGER D, GUTMANN B, KAPPE C O.The concept of chemical generators: on-site on-demand production of hazardous reagents in continuous flow [J].Acc Chem Res,2020, 53(7): 1330-1341.
[9] 駱廣生, 王 凱.微反應(yīng)器研究最新進(jìn)展[J].現(xiàn)代化工,2009, 29(5): 27-31.
[10] REIZMAN B J, COLE K P, HESS M, et al.Smallvolume continuous manufacturing of merestinib. Part 2.Technology transfer and cGMP manufacturing [J].Org Process Res Dev, 2019, 23(5): 870-881.
[11] TESTA C J, HU C, SHVEDOVAE K, et al.Design and commercialization of an end-to-end continuous pharmaceutical production process: a pilot plant case study [J].Org Process Res Dev, 2020, 24(12): 2874-2889.
[12] SRAI J S, SETTANNI E, AULAKH P K.Evaluating the business case for continuous manufacturing of pharmaceuticals: a supply network perspective, in continuous pharmaceutical processing [M].Berlin: Springer International Publishing, 2020: 477-512.
[13] FDA.Quality considerations for continuous manufacturing[EB/OL].[2022-04-21].https://www.fda.gov/regulatory-information/search-fda-guidance-documents/quality-considerations-continuous-manufacturing.
[14] 曹 輝, 丁力承.國(guó)外已上市連續(xù)制造藥品的注冊(cè)審評(píng)情況及其啟示[J].中國(guó)藥事, 2022, 36(4): 377-383.
[15] BERRY M B.Filing a multistage continuous process for API [J/OL].(2020-03-24)[2022-04-21].https://www.a(chǎn)mericanpharmaceuticalreview.com/Featured-Articles/562258-Filing-a-Multistage-Continuous-Processfor-API/.
[16] STUECKLER C, HERMSEN P, RITZEN B, et al.Development of a continuous flow process for a Matteson reaction: from lab scale to full-scale production of a pharmaceutical intermediate [J].Org Process Res Dev,2019, 23(5): 1069-1077.
[17] REIZMAN B J, COLE K P, HESS M, et al.Smallvolume continuous manufacturing of merestinib.Part 2.Technology transfer and cGMP manufacturing [J].Org Process Res Dev, 2019, 23(5): 870-881.
[18] 曹 萌, 丁力承, 胡延臣, 等.藥品連續(xù)制造全球監(jiān)管發(fā)展現(xiàn)狀與思考[J].中國(guó)藥事, 2022, 36(4): 364-376.
本文作者陳蔚�����、馮明杰�����、許波�����、潘毅�����、陳華�����、湯立達(dá),天津藥物研究院有限公司�����、天津泰普制藥有限公司�����、釋藥技術(shù)與藥代動(dòng)力學(xué)國(guó)家重點(diǎn)實(shí)驗(yàn)室�����,來(lái)源于中國(guó)醫(yī)藥工業(yè)雜志�����,僅供交流學(xué)習(xí)