目的:研究美國(guó)食品藥品監(jiān)督管理局(FDA)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的構(gòu)建,為完善我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)提供參考���。
方法:詳細(xì)介紹FDA藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的構(gòu)成及功能��,為我國(guó)數(shù)據(jù)庫(kù)的進(jìn)一步完善提出建議���。
結(jié)果與結(jié)論:FDA網(wǎng)站建立了相對(duì)完善的藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)�����,其結(jié)構(gòu)的邏輯性�����、資源的完整性及檢索功能的便捷性均存在可借鑒之處���。我國(guó)正在探索建設(shè)�����、完善藥品法規(guī)數(shù)據(jù)庫(kù)���,其系統(tǒng)性與科學(xué)性需要不斷提高,從而更好地滿足公眾及行業(yè)需求��。
隨著我國(guó)藥品監(jiān)管體系的發(fā)展日趨完善��,相關(guān)法律法規(guī)文件的數(shù)量也在與日俱增[1-3]。公眾和行業(yè)訪問需求不斷增加��,對(duì)訪問的便利性���、時(shí)效性提出了更高要求���。我國(guó)藥監(jiān)部門一直致力于監(jiān)管信息化�����、現(xiàn)代化���,并依托各監(jiān)管機(jī)構(gòu)網(wǎng)站逐步建立和完善了我國(guó)藥品法規(guī)數(shù)據(jù)庫(kù)���,歷經(jīng)多次改版升級(jí)���,已初具成效���。但從結(jié)構(gòu)、資源和功能方面來看�����,我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)在系統(tǒng)性和專業(yè)性方面還難以滿足公眾和行業(yè)不斷增長(zhǎng)的需要��。國(guó)際上���,一些發(fā)達(dá)國(guó)家在藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)建設(shè)方面的先進(jìn)經(jīng)驗(yàn)可供我國(guó)學(xué)習(xí)和借鑒���,其中美國(guó)的情況最有代表性[4]。美國(guó)食品藥品監(jiān)督管理局(Food and Drug Administration��,F(xiàn)DA)歷經(jīng)百年發(fā)展�����,形成了法律�����、法規(guī)和指南的完整藥品監(jiān)管體系[5]��,F(xiàn)DA網(wǎng)站涵蓋了相對(duì)完善的藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)�����,對(duì)我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的提高有借鑒意義��。本文通過對(duì)美國(guó)FDA藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)進(jìn)行研究��,從數(shù)據(jù)庫(kù)的結(jié)構(gòu)�����、資源和功能等方面得出啟示�����,以期對(duì)我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的進(jìn)一步完善提供參考�����。
1���、美國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)建設(shè)概況
美國(guó)是最早建立法規(guī)文件數(shù)據(jù)庫(kù)的國(guó)家���,具有多個(gè)科學(xué)、權(quán)威���、完整的法律法規(guī)文件數(shù)據(jù)庫(kù)[ 6 ]。法規(guī)文件數(shù)據(jù)庫(kù)的建立需要依托成熟的法律法規(guī)體系�����,美國(guó)藥品監(jiān)管法規(guī)體系包括法律(Law)���、法規(guī)(Regulation)和指南文件(Guidance Document)3個(gè)層級(jí)[7]��。FDA網(wǎng)站的數(shù)據(jù)庫(kù)不僅涵蓋了所有與藥品有關(guān)的法律法規(guī)原文�����,還將所有技術(shù)指南文件納入其中��,供公眾免費(fèi)查詢��。FDA官方網(wǎng)站自上線運(yùn)營(yíng)以來��,幾經(jīng)改版���,不斷更新法律法規(guī)數(shù)據(jù)庫(kù),其結(jié)構(gòu)���、資源與功能等日趨完善�����,為藥品監(jiān)管者�����、行業(yè)及患者提供更加便捷���、準(zhǔn)確的醫(yī)藥信息服務(wù)。
1.1FDA法律數(shù)據(jù)庫(kù)
在美國(guó)���,法律是由國(guó)會(huì)頒布的��,所有一般性、永久性法律均匯編于《美國(guó)法典》(United States Code���,USC)中��。第一部《美國(guó)法典》于1926年正式發(fā)布�����,與食品和藥品相關(guān)的法律條文主要收錄于第21卷[8]��。其中���,《美國(guó)法典》在藥品領(lǐng)域最為重要的是FD&CA,被收錄于第21卷第9章(21USC.ch.9)?��,F(xiàn)行的《美國(guó)法典》分為54卷��,卷下設(shè)章���、部分��、節(jié)(常用§表示)�����、段���、款和項(xiàng)幾個(gè)層級(jí)���。
FDA網(wǎng)站的“監(jiān)管信息”專欄,將法律數(shù)據(jù)庫(kù)分為“FD&CA”“其他影響FDA的法律”和“FD&CA修正案”3個(gè)板塊[9]�����。其中���,F(xiàn)D&CA板塊設(shè)置了《美國(guó)法典》數(shù)據(jù)庫(kù)[10]的外部鏈接�����,并提供了可直接跳轉(zhuǎn)至“第21卷—食品與藥品”(Title 21—Food and Drug)的選項(xiàng)���?�!睹绹?guó)法典》數(shù)據(jù)庫(kù)具備多種檢索功能���,包括關(guān)鍵詞檢索��、特定字段檢索���、法律編號(hào)檢索等�����,并可以分章�����、分節(jié)下載XML��、XHTML、PCC和PDF多種格式的法律原文��。為便于公眾在《美國(guó)法典》數(shù)據(jù)庫(kù)中檢索法律條款��,F(xiàn)DA法律數(shù)據(jù)庫(kù)根據(jù)FD&CA章節(jié)劃分��,將FD&CA和《美國(guó)法典》的條款編號(hào)相對(duì)應(yīng)���。而在“其他影響FDA的法律”和“FD&CA修正案”板塊���,不僅列出相關(guān)法案的發(fā)布時(shí)間和公法號(hào),還附上國(guó)會(huì)網(wǎng)站[11]的外部鏈接��,供公眾查詢法案原文��。此外��,對(duì)于一些重要的修正案(例如《21世紀(jì)治愈法案》《FDA再授權(quán)法案》等)�����,還列出法案簡(jiǎn)介及法案要點(diǎn)等信息��。
1.2FDA法規(guī)數(shù)據(jù)庫(kù)
1938年��,美國(guó)聯(lián)邦政府參照《美國(guó)法典》的編纂方式開始進(jìn)行聯(lián)邦行政法規(guī)的編纂,并發(fā)布第一版《美國(guó)聯(lián)邦法規(guī)》(Code of Federal Regulations�����,CFR)[12]���。在結(jié)構(gòu)上,《美國(guó)聯(lián)邦法規(guī)》與《美國(guó)法典》非常相似��,將與食品和藥品相關(guān)的法律條文收錄于第21卷�����。
FDA遵循CFR的原有結(jié)構(gòu),在其網(wǎng)站上將CFR第21卷單獨(dú)建立藥品法規(guī)數(shù)據(jù)庫(kù)[13]。FDA法規(guī)數(shù)據(jù)庫(kù)具備3種檢索功能:1)根據(jù)法規(guī)編碼進(jìn)行明確檢索���;2)根據(jù)目錄導(dǎo)航選擇檢索章節(jié)���;3)通過輸入關(guān)鍵詞或關(guān)鍵字段進(jìn)行全文檢索���。其中,后2種檢索方式可以結(jié)合使用��。FDA法規(guī)數(shù)據(jù)庫(kù)還具備輸出和分享功能��,用戶可將檢索到的法規(guī)原文發(fā)送到郵箱�����,或直接分享到Facebook���、Twitter等平臺(tái)�����。此外��,F(xiàn)DA在法規(guī)專欄還附上了電子聯(lián)邦法規(guī)(e-CFR)的鏈接���,可一鍵跳轉(zhuǎn)至CFR的官方電子數(shù)據(jù)庫(kù)�����。與FDA法規(guī)數(shù)據(jù)庫(kù)不同的是�����,e-CFR還可使用布爾邏輯檢索和近似搜索。FDA法規(guī)數(shù)據(jù)庫(kù)每年更新1次�����,而e-CFR每日更新1次�����,更具時(shí)效性���。
1.3FDA指南數(shù)據(jù)庫(kù)
根據(jù)《良好指南制定規(guī)范》(Good Guidance Practice)(21CFR§10.115)中定義���,“指南”是指為FDA員工�����、注冊(cè)申請(qǐng)人/發(fā)起人和公眾準(zhǔn)備的���,用來描述FDA就某個(gè)法規(guī)議題所做出解釋或指導(dǎo)的文件[14]。FDA每年發(fā)布大量的指南文件�����,大部分適用于業(yè)界��,還有一些用于規(guī)范FDA內(nèi)部員工的工作程序及標(biāo)準(zhǔn)�����。
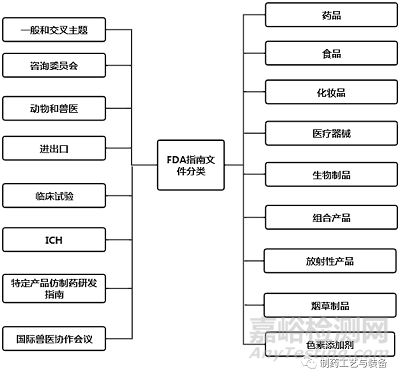
在FDA指南數(shù)據(jù)庫(kù)中���,根據(jù)所涉及的內(nèi)容不同��,F(xiàn)DA發(fā)布的所有指南文件被分為17個(gè)主題(見圖1)�����。其中��,藥品又分為廣告、標(biāo)識(shí)簽�����、生物類似藥��、組合產(chǎn)品���、非處方藥(Over The Counter��,OTC)、罕見病���、真實(shí)世界數(shù)據(jù)/真實(shí)世界證據(jù)(RWD/RWE)等38個(gè)分支主題[15]�����。FDA指南文件數(shù)據(jù)庫(kù)具有關(guān)鍵字檢索功能���,也可以根據(jù)產(chǎn)品類型��、發(fā)布日期、發(fā)布機(jī)構(gòu)和文件類型進(jìn)行篩選��、檢索��。公眾還可以根據(jù)指南的主題進(jìn)行分類瀏覽���,且所有指南文件均可查閱和下載�����。
圖1 FDA 指南文件分類
2���、我國(guó)藥品監(jiān)管法規(guī)數(shù)據(jù)庫(kù)概況
目前���,在國(guó)家醫(yī)藥政策的深入改革進(jìn)程中,國(guó)內(nèi)醫(yī)藥相關(guān)數(shù)據(jù)庫(kù)也處于蓬勃發(fā)展之中�����。在我國(guó)醫(yī)藥數(shù)據(jù)市場(chǎng)上��,國(guó)際軟件巨頭占據(jù)了絕大多數(shù)的份額���,國(guó)內(nèi)的阿里巴巴、東軟等企業(yè)也在醫(yī)療數(shù)據(jù)領(lǐng)域有所發(fā)展[16]��。我國(guó)的醫(yī)藥相關(guān)數(shù)據(jù)庫(kù)大致可以分為政府主導(dǎo)��、企業(yè)主導(dǎo)兩類���。
政府主導(dǎo)的醫(yī)藥數(shù)據(jù)庫(kù)�����,主要為國(guó)家市場(chǎng)監(jiān)督管理總局�����、國(guó)家藥品監(jiān)督管理局等在其各自官方網(wǎng)站上建立的數(shù)據(jù)庫(kù)�����,此類數(shù)據(jù)庫(kù)內(nèi)容真實(shí)準(zhǔn)確�����,且具備權(quán)威性�����。國(guó)家市場(chǎng)監(jiān)督管理總局網(wǎng)站不僅涵蓋藥品監(jiān)管法規(guī)���,還包括食品、廣告等其他領(lǐng)域的法律法規(guī)和其他文件���。
近年來��,隨著我國(guó)藥品監(jiān)管法規(guī)體系不斷完善��,藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的建設(shè)受到了監(jiān)管部門的高度重視,逐步建設(shè)并更新了多個(gè)由政府主導(dǎo)的數(shù)據(jù)庫(kù)���。但是���,現(xiàn)有數(shù)據(jù)庫(kù)在其結(jié)構(gòu)、功能及資源方面尚存在需完善之處��,不能完全滿足公眾高效��、便捷地查詢藥品法規(guī)文件的需求���。在結(jié)構(gòu)方面:現(xiàn)有的分類標(biāo)簽較少,用戶無(wú)法快速精準(zhǔn)定位,且不同網(wǎng)站數(shù)據(jù)庫(kù)對(duì)法規(guī)文件的分類方法不一��;在功能方面:即使輸入有效關(guān)鍵詞進(jìn)行查詢��,但檢索出的信息相關(guān)度較低���,檢索效率不高���;在資源方面:法規(guī)文件分散于各個(gè)不同的政府或事業(yè)單位網(wǎng)站�����,公眾尚無(wú)法實(shí)現(xiàn)“一站式檢索”�����。
由企業(yè)主導(dǎo)的數(shù)據(jù)庫(kù)�����,如Insight���、藥智數(shù)據(jù)��、醫(yī)藥魔方等�����,一般重點(diǎn)聚焦于藥物研發(fā)��、藥品申報(bào)和藥品使用等數(shù)據(jù)��,能夠查詢的藥品監(jiān)管法規(guī)文件數(shù)量較少��,且缺乏權(quán)威性��,即使顯示了法規(guī)文件的全文��,用戶仍需自行轉(zhuǎn)向政府網(wǎng)站來實(shí)施二次搜索��,以確保其真實(shí)性��,增加了工作量���。
3���、對(duì)我國(guó)建立更加系統(tǒng)��、科學(xué)的藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的啟示
3.1結(jié)構(gòu)方面
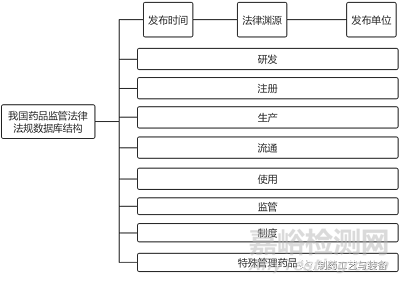
我國(guó)法規(guī)文件具有發(fā)布單位多��、法律效力層級(jí)復(fù)雜等特點(diǎn)��,在設(shè)計(jì)數(shù)據(jù)庫(kù)結(jié)構(gòu)時(shí)應(yīng)以便于檢索為原則���,將法規(guī)文件從多個(gè)維度進(jìn)行分類�����。首先���,可分別按照法規(guī)文件發(fā)布時(shí)間、法律淵源和發(fā)布單位進(jìn)行橫向分類;其次�����,可根據(jù)藥品的生命周期進(jìn)行縱向分類�����,包括研發(fā)��、注冊(cè)���、生產(chǎn)���、流通、使用等���。此外��,我國(guó)近年來不斷完善藥品監(jiān)管制度�����,可將“監(jiān)管”(藥品的審評(píng)��、檢查���、檢驗(yàn)等)、“制度”(包括藥品上市許可持有人制度��、優(yōu)先審評(píng)審批制度���、藥物警戒制度���、藥物追溯制度���、原輔包管理制度�����、一致性評(píng)價(jià)制度��、假劣藥管理制度和行刑銜接制度等)以及特殊管理藥品(麻醉藥品�����、精神藥品�����、毒性藥品���、放射性藥品等)單獨(dú)分類,從而更便于公眾按照需求檢索法規(guī)文件(見圖2)��。
圖2 我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)結(jié)構(gòu)圖
3.2資源方面
為保證藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的權(quán)威性與完整性�����,應(yīng)優(yōu)先從政府主導(dǎo)的相關(guān)數(shù)據(jù)庫(kù)獲取資源�����。對(duì)于各部門發(fā)布的藥品法律法規(guī)文件,可按法律淵源的類別作為納入標(biāo)準(zhǔn)���。其中��,對(duì)于藥品相關(guān)的地方政府規(guī)章和地方性法規(guī)���,可設(shè)立單獨(dú)板塊�����,按照34個(gè)省級(jí)行政區(qū)(包括23個(gè)省��、5個(gè)自治區(qū)�����、4個(gè)直轄市和2個(gè)特別行政區(qū)),將與藥品相關(guān)的地方政府規(guī)章和地方性法規(guī)等文件分類整理���。而且��,藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的資源不應(yīng)僅局限于國(guó)內(nèi)藥品法律法規(guī)文件��,還可鏈接美國(guó)���、歐盟��、英國(guó)及ICH等國(guó)家和組織的法律法規(guī)數(shù)據(jù)資源�����,從而建立一個(gè)權(quán)威�����、全面��、國(guó)際化的藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)�����。
為保證藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的時(shí)效性���,建議定期檢查有關(guān)資源網(wǎng)站�����,例如:國(guó)務(wù)院政策咨詢文件庫(kù)、司法部行政法規(guī)庫(kù)等��,及時(shí)進(jìn)行文件更新��,并在頁(yè)面上標(biāo)注最新更新時(shí)間���。此外��,還應(yīng)設(shè)置外部鏈接區(qū)域��,以便用戶可以直接跳轉(zhuǎn)到法規(guī)文件的發(fā)布單位網(wǎng)站���。
3.3功能方面
3.3.1 檢索功能
針對(duì)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的檢索功能�����,建議采用“目錄導(dǎo)航” “快速搜索” “高級(jí)檢索”和“熱門搜索”相結(jié)合的檢索功能���。“目錄導(dǎo)航”模塊可包括研發(fā)�����、注冊(cè)���、生產(chǎn)、流通���、使用、監(jiān)管、制度和特殊管理藥品等細(xì)分選項(xiàng)��。“快速搜索”應(yīng)包含“關(guān)鍵字”搜索��、“字段”搜索以及“法律發(fā)文字號(hào)”搜索等功能��,以提高檢索法律法規(guī)文件的精準(zhǔn)度�����。“高級(jí)檢索”功能應(yīng)涵蓋包括近似搜索���、布爾邏輯檢索等檢索方式�����,同時(shí)數(shù)據(jù)庫(kù)還應(yīng)提供“日期范圍”(發(fā)布日期和實(shí)施日期)�����、“時(shí)效性”“法律淵源”和“發(fā)布單位”等篩選項(xiàng)�����,以幫助用戶縮小檢索范圍�����,精確鎖定目標(biāo)文件��,提高檢索效率���。“熱門搜索”功能可以根據(jù)近期熱點(diǎn),生成并及時(shí)更新“熱搜關(guān)鍵詞庫(kù)”���,保證時(shí)效性與實(shí)用性��。
3.3.2 下載功能
藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)應(yīng)不僅支持在線閱讀文件�����,還應(yīng)支持多種版本的下載功能���,包括PDF��、XML、DOC等格式��。此外���,由于一些法律法規(guī)文件的篇幅較長(zhǎng)�����,用戶在檢索到法律法規(guī)原文后�����,還需要自行查找所需條款�����。因此���,應(yīng)在檢索結(jié)果分為“全文”顯示和“相關(guān)條款”顯示的基礎(chǔ)上�����,提供以“章”“條”下載的功能���。
3.3.3 定期更新功能
藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)應(yīng)密切關(guān)注各級(jí)政府的官方網(wǎng)站、國(guó)際有關(guān)機(jī)構(gòu)與組織網(wǎng)站��,及時(shí)獲取藥品相關(guān)的法律法規(guī)更新信息��,定期更新數(shù)據(jù)庫(kù)資源�����,并在頁(yè)面底部標(biāo)明頁(yè)面更新時(shí)間��,從而使用戶了解最前沿��、最權(quán)威的法律法規(guī)信息��。出于全面性的考慮,還應(yīng)保留不同歷史版本的法律法規(guī)���,但應(yīng)在標(biāo)題中明確標(biāo)識(shí)發(fā)布時(shí)間及是否廢止等信息�����,以便公眾和行業(yè)專業(yè)人員的查詢和研究��。
4��、結(jié)語(yǔ)
通過對(duì)美國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)進(jìn)行調(diào)研��,分析我國(guó)藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)的現(xiàn)狀和存在的不足���,從結(jié)構(gòu)�����、資源和功能方面提出建議�����,為在我國(guó)建立更加系統(tǒng)�����、科學(xué)的藥品監(jiān)管法規(guī)文件數(shù)據(jù)庫(kù)提供了參考��,具有現(xiàn)實(shí)指導(dǎo)意義��。
參考文獻(xiàn)
[1] 國(guó)家藥品監(jiān)督管理局. 2020年政府信息公開工作年度報(bào)告[EB/OL].(2021-01-28)[2021-09-07]. https://www.nmpa.gov.cn/newzwgk/zfxxgknb/2020nb/index.html.
[2] 國(guó)家藥品監(jiān)督管理局. 2019年政府信息公開工作年度報(bào)告[EB/OL].(2020-01-31)[2021-09-07].https://www.nmpa.gov.cn/newzwgk/zfxxgknb/20200131152501262.html.
[3] 國(guó)家藥品監(jiān)督管理局. 2018年政府信息公開工作年度報(bào)告[EB/OL].(2019-03-29)[2021-09-07].https://www.nmpa.gov.cn/newzwgk/zfxxgknb/20190329153101648.html.
[4] 申楊. 以信息化引領(lǐng)藥品監(jiān)管現(xiàn)代化[N]. 中國(guó)醫(yī)藥報(bào)��,2021-08-30(001).
[5] 王鑫��,甄橙. 美國(guó)藥品監(jiān)管法規(guī)百年歷程及對(duì)中國(guó)的啟示[J]. 中國(guó)新藥雜志���,2016,25(8):849-854.
[6] 王曉���,楊牧,王璐�����,等. 歐盟與中國(guó)藥品法律法規(guī)及檢查體系對(duì)比分析[J]. 中國(guó)藥業(yè),2020���,29(10):60-64.
[7] 孟八一. FDA藥物監(jiān)管權(quán)力結(jié)構(gòu)簡(jiǎn)析[J]. 中國(guó)食品藥品監(jiān)管��,2019(7):46-55.
[8] National Archives. About Laws[EB/OL].(2017-12-28)[2021-08-26]. https://www.archives.gov/federal-register/laws.
[9] FDA. Laws Enforced by FDA[EB/OL].(2018-03-29)[2021-09-02]. https://www.fda.gov/regulatory-information/laws-enforced-fda.
[10] FDA. Federal Food, Drug, and Cosmetic Act(FD&C Act)[EB/OL].(2018-03-29)[2021-09-06]. https://www.fda.gov/regulatory-information/laws-enforced-fda/federalfood-drug-and-cosmetic-act-fdc-act.
[11] FDA. Selected Amendments to the FD&C Act[EB/OL].(2018-03-29)[2021-09-06]. https://www.fda.gov/regulatory-information/laws-enforced-fda/selectedamendments-fdc-act.
[12] National Archives and Records Administration. A Brief History Commemorating the 70th Anniversary of the Publication of the First Issue of the Federal Register March14, 1936[EB/OL].(2014-06-11)[2021-08-29]. https://www.archives.gov/files/federal-register/the-federalregister/history.pdf.
[13] 王越��,周良彬���,王悅,等. 美國(guó)和日本醫(yī)療器械數(shù)據(jù)庫(kù)系統(tǒng)構(gòu)建思路探析[J]. 中國(guó)藥事�����,2019��,33(10):1181-1186.
[14] FDA. Fact Sheet: FDA Good Guidance Practices[EB/OL].(2019-12-04)[2021-08-29]. https://www.fda.gov/about-fda/transparency-initiative/fact-sheet-fda-goodguidance-practices.
[15] FDA. Guidances(Drugs)[EB/OL].(2021-09-03)[2021-09-07]. https://www.fda.gov/drugs/guidancecompliance-regulatory-information/guidances-drugs.
[16] 新浪醫(yī)藥新聞. 國(guó)內(nèi)各類醫(yī)藥數(shù)據(jù)庫(kù)的發(fā)展現(xiàn)狀[EB/OL].(2017-02-22)[2020-08-12]. https://med.sina.com/article_detail_103_2_20740.html.
本文作者張靜、關(guān)月月、揣紅梅��、唐桃群、潘威��、楊悅���,國(guó)家藥品監(jiān)督管理局信息中心��、沈陽(yáng)藥科大學(xué)工商管理學(xué)院�����、清華大學(xué)藥學(xué)院��,來源于中國(guó)藥事��,僅供交流學(xué)習(xí)。