法規(guī)要求
《動(dòng)物源性醫(yī)療器械注冊(cè)技術(shù)審查指導(dǎo)原則(2017年修訂版)》指出���,某些醫(yī)療器械可能含有動(dòng)物來(lái)源的材料��,這些材料是多種多樣的���,可以構(gòu)成該器械的主要部件(例如牛/豬源心臟瓣膜、羊腸縫合線�����、止血材料等)�����、涂層或者浸滲劑(例如肝素��、明膠���、膠原等)�,也可成為生產(chǎn)過(guò)程中所用的輔助材料(例如牛脂等)。對(duì)于動(dòng)物源性醫(yī)療器械�,研究資料需增加涉及控制病毒和/或傳染性因子(細(xì)菌、霉菌�、酵母菌、寄生蟲(chóng)��、病毒���、TSE因子以及未被分類(lèi)的病原體)感染以及免疫原性風(fēng)險(xiǎn)方面有關(guān)的技術(shù)內(nèi)容����,如對(duì)生產(chǎn)過(guò)程中滅活和去除病毒和/或傳染性因子工藝過(guò)程的描述及有效性驗(yàn)證數(shù)據(jù)或相關(guān)資料���。
YY 0970 及 ISO 14160提出�,醫(yī)療器械最常使用的滅菌方式有濕熱����、干熱、輻照和環(huán)氧乙烷滅菌���,部分動(dòng)物源性醫(yī)療器械可能適用于以上滅菌方式����。但另一些醫(yī)療器械需于滅菌后保持組織所需物理性能,如生物心臟瓣膜或組織補(bǔ)片�����,則不適用傳統(tǒng)滅菌方式��,而更常使用液體化學(xué)滅菌���。
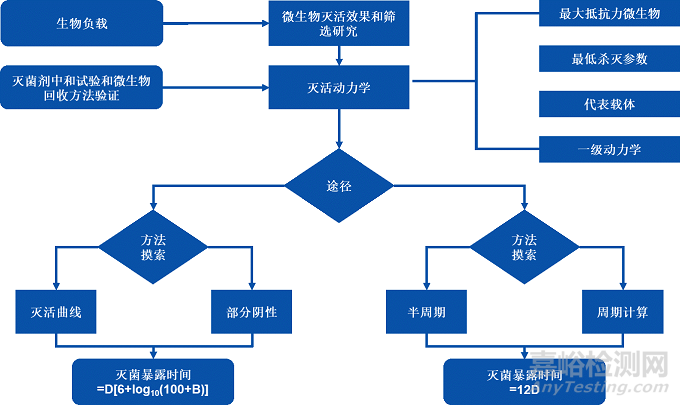
2023年03月14日,YY 0970更新發(fā)布�����,除標(biāo)準(zhǔn)名稱(chēng)���、法規(guī)依據(jù)����、名詞調(diào)整外�,最關(guān)鍵的技術(shù)細(xì)節(jié)有較多補(bǔ)充,其中變化較大���、補(bǔ)充內(nèi)容較多的為2023版本附錄B《應(yīng)用指南》(更新自2013版本附錄A《指南》)章節(jié)��,關(guān)于微生物殺滅效果�、過(guò)程定義和微生物性能鑒定流程在2023版本中有了詳細(xì)的描述(見(jiàn)下圖),對(duì)如何達(dá)到法規(guī)要求提供了適合的方法和建議:
液體化學(xué)滅菌驗(yàn)證測(cè)試項(xiàng)目:
方法確認(rèn):
NO.1 生物負(fù)載回收率試驗(yàn)
評(píng)估篩選試驗(yàn)��、滅活動(dòng)力學(xué)試驗(yàn)等所用的生物負(fù)載測(cè)試方法的采集回收效率�。
NO.2 中和鑒定試驗(yàn)
確保篩選試驗(yàn)、滅活動(dòng)力學(xué)試驗(yàn)等所用的中和方法能有效地去除滅菌劑的抗菌性(中和效力試驗(yàn))���,同時(shí)又不削弱微生物活力的恢復(fù)(中和毒性試驗(yàn))��。
NO.3 抑菌試驗(yàn)
確保半周期滅菌驗(yàn)證所用的中和方法能有效地中和/去除滅菌劑的抗菌性(中和效力試驗(yàn))���,同時(shí)又不削弱微生物活力的恢復(fù)(中和毒性試驗(yàn))。
過(guò)程確認(rèn):
NO.1 產(chǎn)品生物負(fù)載試驗(yàn)
測(cè)試產(chǎn)品上微生物的數(shù)量和/或種類(lèi)���,適用時(shí)����,選取產(chǎn)品上的分離株進(jìn)行篩選試驗(yàn)��。
NO.2 菌株篩選試驗(yàn)
使用產(chǎn)品的生物負(fù)載�、生產(chǎn)環(huán)境中的分離株、從菌種保藏中心獲得的高抗微生物作為供試微生物���。評(píng)估最差滅菌條件下供試微生物對(duì)滅菌劑的抗性��。篩選得到對(duì)滅菌過(guò)程抗性最高的微生物�,作為本滅菌過(guò)程的生物指示劑。
NO.3 滅活動(dòng)力學(xué)
使用滅菌劑的下限濃度����、下限pH和下限溫度,旨在建立最差滅菌條件下���,滅菌時(shí)間與高抗力微生物滅活動(dòng)力學(xué)的數(shù)學(xué)關(guān)系,建立微生物滅活曲線��,以計(jì)算供試微生物的D值��。
NO.4 半周期滅菌驗(yàn)證
接種一定數(shù)量的高抗力微生物���,使用下限滅菌劑濃度和下限溫度進(jìn)行半周期滅菌��。
NO.5 全周期滅菌驗(yàn)證
使用上限滅菌劑濃度����、上限滅菌溫度�、上限滅菌pH值和上限滅菌時(shí)間����,旨在評(píng)價(jià)滅菌劑在滅菌過(guò)程中的是否存在濃度����、pH變化,以及滅菌劑對(duì)材料的影響��。
NO.6 二次滅菌確認(rèn)
使用經(jīng)過(guò)一次全周期滅菌的樣品���,其他同全周期滅菌驗(yàn)證���,旨在評(píng)價(jià)當(dāng)日常滅菌過(guò)程中出現(xiàn)滅菌失敗時(shí),產(chǎn)品進(jìn)行二次滅菌后�,產(chǎn)品性能依然符合技術(shù)要求。