臨床隨機(jī)對(duì)照試驗(yàn)( randomized controlled trial����,RCT) 是評(píng)價(jià)藥物有效性和安全性的“金標(biāo)準(zhǔn)”,被藥物臨床研究普遍采用; 隨機(jī)分組可以控制組間基線已知或未知影響因素的均衡����,因此形成的證據(jù)可靠性較高����。但 RCT 存在嚴(yán)苛的納入排除標(biāo)準(zhǔn),加之某些罕見(jiàn)病和重大疾病難以實(shí)施傳統(tǒng) RCT����,以及需要高昂的時(shí)間成本等局限����,使得臨床真實(shí)世界證據(jù)( real world evidence����,RWE) 成 為 RCT 的 有 效 補(bǔ)充[1]����。如何更好地利用 RWE 評(píng)價(jià)藥物的有效性和安全性,支持藥物研發(fā)和輔助監(jiān)管決策����,已成為全球監(jiān)管機(jī)構(gòu)、制藥工業(yè)界和學(xué)術(shù)界共同關(guān)注的挑戰(zhàn)性問(wèn)題����。
真實(shí)世界數(shù)據(jù)( real world data����,RWD) 是產(chǎn)生高質(zhì)量 RWE 的基礎(chǔ)[2]����。在數(shù)據(jù)全生命周期中全面評(píng)估其對(duì)于研究問(wèn)題的適用性����,規(guī)范開(kāi)展 RWD 治理將為滿足臨床研究目的所需的高質(zhì)量研究數(shù)據(jù)提供可靠保障����,并進(jìn)一步基于 RWD 分析形成 RWE����,支持藥械監(jiān)管決策����。
本文通過(guò)梳理國(guó)內(nèi)外主要藥械監(jiān)管機(jī)構(gòu) RWD/RWE 科學(xué)監(jiān)管體系建設(shè)進(jìn)程中已發(fā)布的有關(guān)政策法規(guī)和指導(dǎo)原則,著重圍繞其中具體針對(duì) RWD 用于藥械審評(píng)與科學(xué)監(jiān)管的相關(guān)政策法規(guī)與指導(dǎo)原則����,從數(shù)據(jù)來(lái)源、數(shù)據(jù)適用性評(píng)價(jià)����、數(shù)據(jù)全生命周期的質(zhì)量控制����、倫理考慮及質(zhì)量管理體系����、用于遞交 RWD 的數(shù)據(jù)標(biāo)準(zhǔn)以及與監(jiān)管機(jī)構(gòu)的溝通等方面進(jìn)行要點(diǎn)解讀和對(duì)比。在此基礎(chǔ)上����,列舉了我國(guó)學(xué)者在 RWD 用于藥械監(jiān)管的積極探索實(shí)踐,以期為健全和完善適用于我國(guó) RWD 具體實(shí)施的指導(dǎo)原則提供借鑒����。
1����、國(guó)內(nèi)外各主要監(jiān)管機(jī)構(gòu) RWD/RWE 科學(xué)監(jiān)管體系建設(shè)相關(guān)政策法規(guī)和指導(dǎo)原則概覽
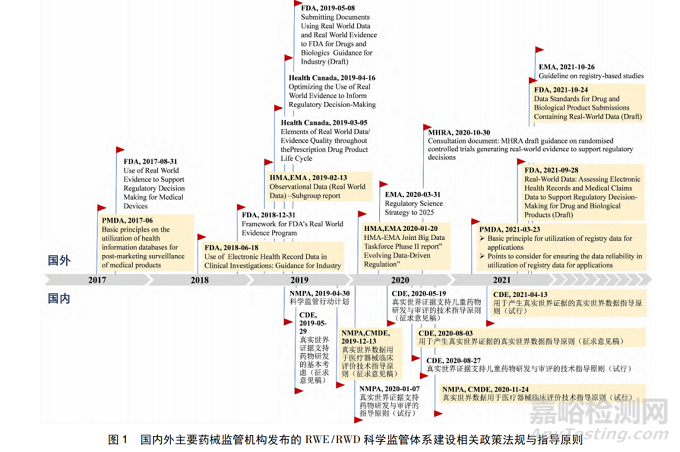
圖1 匯總了國(guó)內(nèi)外各主要監(jiān)管機(jī)構(gòu)發(fā)布的RWD/RWE 科學(xué)監(jiān)管體系建設(shè)相關(guān)政策法規(guī)和指導(dǎo)原則。目前����,我國(guó)系統(tǒng)性開(kāi)展 RWD/RWE 科學(xué)監(jiān)管體系建設(shè)工作尚處于起步階段,美����、歐����、日等發(fā)達(dá)國(guó)家和地區(qū)正在加速深化布局。
1.1����、各國(guó)相關(guān)政策法規(guī)和指導(dǎo)原則發(fā)布情況
美國(guó)食品藥品管理局( Food and Drug Administration����,F(xiàn)DA) 于 2008 年啟動(dòng)哨點(diǎn)計(jì)劃[3]����,利用現(xiàn)有的電子醫(yī)療健康數(shù)據(jù)實(shí)現(xiàn)對(duì)上市后醫(yī)療產(chǎn)品安全性的主動(dòng)監(jiān)測(cè)����,為后續(xù)開(kāi)展真實(shí)世界研究( real worldstudy����,RWS) 積累了探索經(jīng)驗(yàn),同時(shí)奠定了方法學(xué)基礎(chǔ)����。2016 年 12 月通過(guò)《21 世紀(jì)治愈法案》[4],鼓勵(lì)FDA 開(kāi)展研究并使用 RWE 支持藥物和其他醫(yī)療產(chǎn)品的監(jiān)管決策����,加快醫(yī)藥產(chǎn)品開(kāi)發(fā)����,這是 RWE 第一次以法案形式提及。隨后����,2017 ~ 2019 年 FDA 先后發(fā)布《使用真實(shí)世界證據(jù)支持醫(yī)療器械監(jiān)管決策》[5]、《臨床研究中使用電子健康檔案數(shù)據(jù)指南》[6]����、《真實(shí)世界證據(jù)計(jì)劃的框架》[7]和《使用真實(shí)世界數(shù)據(jù)和真實(shí)世界證據(jù)向 FDA 遞交藥物和生物制品資料》[8]等多部指南����。為進(jìn)一步規(guī)范評(píng)估和獲取可用于產(chǎn)生高質(zhì)量證據(jù)的 RWD,2021 年 9 月����,F(xiàn)DA 針對(duì)評(píng)估電子健康數(shù)據(jù)( electronic health records,EHR) 和醫(yī)療保險(xiǎn)數(shù)據(jù)用于支持藥品監(jiān)管決策發(fā)布 RWD 指南[9]����,同年 10 月發(fā)布包含 RWD 提交的數(shù)據(jù)標(biāo)準(zhǔn)相關(guān)指南[10]����,后續(xù)還將針對(duì)注冊(cè)登記數(shù)據(jù)提交等具體問(wèn)題發(fā)布相關(guān)指南����。
歐盟藥品管理局( European Medicines Agency����,EMA) 于 2013 年參與 GetReal Institute 項(xiàng)目����,致力開(kāi)發(fā)出收集與綜合 RWE 的新方法[11]; 2014 年發(fā)起適應(yīng)性許可試點(diǎn)項(xiàng)目[12]����,探索利用 RWD 包括觀察性研究數(shù)據(jù)等用于監(jiān)管決策的可行性。2017 年 EMA聯(lián) 合 藥 品 局 總 部 ( Heads of Medicines Agency����,HMA) 成立大數(shù)據(jù)工作組。該工作組于 2019 年發(fā)布的 Observational data ( real world data) -Subgroupreport 中圍繞電子健康數(shù)據(jù)和醫(yī)保數(shù)據(jù)����、注冊(cè)登記數(shù)據(jù)和藥品消費(fèi)數(shù)據(jù)( 銷售和處方數(shù)據(jù)) 等特征及應(yīng)用價(jià)值展開(kāi)介紹[13]����。聯(lián)合工作組 2020 年報(bào)告提出“發(fā)展數(shù)據(jù)驅(qū)動(dòng)的監(jiān)管”這一主題����,同時(shí)圍繞 10項(xiàng)首要推薦事宜展開(kāi)討論[14]。為進(jìn)一步構(gòu)建適宜的監(jiān)管系統(tǒng)����,2020 年 3 月,EMA 發(fā)起“科學(xué)監(jiān)管策略 2025”計(jì)劃[15]����,將高質(zhì)量 RWD 作為首要任務(wù)����,并于 2021 年 10 月發(fā)布將注冊(cè)登記研究用于監(jiān)管決策的指南[16]。
日本藥品和醫(yī)療器械管理局( Pharmaceuticals and Medical Devices Agency����,PMDA) 自 2014 年起致力于建設(shè)包括“醫(yī)療信息用于風(fēng)險(xiǎn)評(píng)估計(jì)劃”和“醫(yī)學(xué)信息數(shù)據(jù)庫(kù)網(wǎng)絡(luò)”等多項(xiàng)數(shù)據(jù)庫(kù)計(jì)劃[17]����。2015年,日本內(nèi)閣修訂“日本振興戰(zhàn)略”����,通過(guò)創(chuàng)建臨床創(chuàng)新網(wǎng)絡(luò)項(xiàng)目����,以建立基于疾病登記信息的臨床發(fā)展基礎(chǔ)設(shè)施����。PMDA 于 2017 年 6 月發(fā)布《利用健康信息數(shù)據(jù)庫(kù)進(jìn)行醫(yī)療產(chǎn)品上市后監(jiān)測(cè)的基本原則》[18]����,2019 年與人用藥品注冊(cè)技術(shù)要求國(guó)際協(xié)調(diào)會(huì)( International Council for Harmonization of Technical Requirements for Pharmaceuticals for Human Use,ICH) 合作并提出更高效利用 RWD 開(kāi)展上市后藥物流行病學(xué)研究的技術(shù)要求新議題����。考慮到利用注冊(cè)登記數(shù)據(jù)在藥物研發(fā)( 如罕用藥) 的必要性����,PMDA在 2021 年 3 月制定了應(yīng)用注冊(cè)登記數(shù)據(jù)的基本原則和確保應(yīng)用注冊(cè)登記數(shù)據(jù)可靠性需要考慮的要點(diǎn)這兩項(xiàng)法規(guī)政策[19,20]����。
1.2����、我國(guó)相關(guān)政策法規(guī)和指導(dǎo)原則發(fā)布情況
相比上述發(fā)達(dá)國(guó)家與地區(qū)����,我國(guó)面臨著 RWD/RWE 支持新藥研發(fā)需求高速增長(zhǎng)與開(kāi)展高質(zhì)量RWS 環(huán)境不完善這一矛盾境況����。2019 年����,我國(guó)正式啟動(dòng)了“中國(guó)藥品監(jiān)管科學(xué)行動(dòng)計(jì)劃”,同時(shí)開(kāi)展使用 RWD/RWE 支持藥物研發(fā)和監(jiān)管的相關(guān)指導(dǎo)原則的制訂����。國(guó)家藥品監(jiān)督管理局( National Medical Products Administration,NMPA) 發(fā)布了《真實(shí)世界證據(jù)支持藥物研發(fā)與審評(píng)的指導(dǎo)原則( 試行) 》[21]����,從宏觀上提出使用 RWE 進(jìn)行藥物研發(fā)和審評(píng)的一般原則����。但由于我國(guó)醫(yī)療數(shù)據(jù)相對(duì)分散,在數(shù)據(jù)準(zhǔn)確性和完整性等方面存在諸多不足����,實(shí)踐過(guò)程中利用RWD 產(chǎn)生 RWE 仍有許多需要注意的原則及問(wèn)題。鑒于此����,2020 年 11 月和 2021 年 4 月,NMPA 藥品審評(píng)中心( Center for Drug Evaluation����,CDE) 先后發(fā)布了兩部專門(mén)針對(duì) RWD 的指導(dǎo)原則[22,23]����。
2����、國(guó)內(nèi)外現(xiàn)行 RWD 相關(guān)政策法規(guī)與指導(dǎo)原則要點(diǎn)解讀與比較
鑒于正確評(píng)估 RWD 的適用性和規(guī)范的數(shù)據(jù)治理是產(chǎn)生高質(zhì)量 RWE 用于藥械監(jiān)管的關(guān)鍵,本研究著重對(duì)圖 1 中針對(duì) RWD 有關(guān)具體問(wèn)題發(fā)布的相關(guān)指南及指導(dǎo)原則( 圖 1 中陰影內(nèi)容) 加以解讀與比較分析����,以期對(duì)比各國(guó)在 RWD 應(yīng)用要求中異同點(diǎn),借鑒國(guó)外先進(jìn)經(jīng)驗(yàn)����,更好地促進(jìn)我國(guó)制定適于中國(guó) RWD/RWE 應(yīng)用條件與環(huán)境的指南����。
2.1����、RWD 的來(lái)源
在 RWD 的數(shù)據(jù)來(lái)源定義方面,各國(guó)藥械監(jiān)管機(jī)構(gòu)雖在具體表述上有所不同����,但普遍將通過(guò)多種途徑常規(guī)收集的與個(gè)體健康狀況有關(guān)的數(shù)據(jù)定義為RWD����。從國(guó)內(nèi)外各主要監(jiān)管機(jī)構(gòu)法規(guī)政策來(lái)看,EHR����、醫(yī)療保險(xiǎn)數(shù)據(jù)和注冊(cè)登記數(shù)據(jù)作為三大類主要的 RWD 數(shù)據(jù)來(lái)源。
NMPA 和 CDE 2021 年發(fā)布的 RWD 指導(dǎo)原則中����,按照數(shù)據(jù)功能劃分 RWD 種類[23],可包含醫(yī)院信息系統(tǒng)數(shù)據(jù)����、醫(yī)保支付數(shù)據(jù)、登記研究數(shù)據(jù)����、藥品安全性主動(dòng)監(jiān)測(cè)數(shù)據(jù)、自然人群隊(duì)列數(shù)據(jù)����、組學(xué)數(shù)據(jù)、死亡登記數(shù)據(jù)����、患者報(bào)告結(jié)局?jǐn)?shù)據(jù)、來(lái)自移動(dòng)設(shè)備的個(gè)體健康監(jiān)測(cè)數(shù)據(jù)����、其他特定功能數(shù)據(jù)( 包括公共衛(wèi)生監(jiān)測(cè)數(shù)據(jù)、患者隨訪數(shù)據(jù)����、患者用藥數(shù)據(jù)等) 。同時(shí)在此基礎(chǔ)上����,進(jìn)一步強(qiáng)調(diào)并非所有的 RWD 都可以直接生成 RWE,如組學(xué)數(shù)據(jù),從系統(tǒng)生物學(xué)角度刻畫(huà)了患者在遺傳學(xué)����、生理學(xué)、生物學(xué)等方面的特征����。通常組學(xué)數(shù)據(jù)需要結(jié)合臨床數(shù)據(jù)才可能成為適用的 RWD����。又如,考慮到在真實(shí)臨床診療環(huán)境中����,院內(nèi)電子病歷數(shù)據(jù)往往無(wú)法涵蓋患者一些重要的臨床結(jié)局指標(biāo)����,如生存時(shí)間、不良反應(yīng)信息等����,需要補(bǔ)充長(zhǎng)期隨訪數(shù)據(jù),才能形成適用的 RWD����。
此外����,NMPA 發(fā)布的關(guān)于醫(yī)療器械臨床評(píng)價(jià)指導(dǎo)原則[22]中提到 RWD 還可包括在醫(yī)療器械生產(chǎn)����、銷售、運(yùn)輸����、存儲(chǔ)、安裝����、使用、維護(hù)����、退市、處置等過(guò)程中產(chǎn)生的器械登記數(shù)據(jù)( 如驗(yàn)收?qǐng)?bào)告����、維修報(bào)告、使用者反饋����、使用環(huán)境����、校準(zhǔn)記錄����、運(yùn)行日志、影像原始數(shù)據(jù)等) ����。
2.2����、RWD 適用性評(píng)價(jià)
各地區(qū)和國(guó)家監(jiān)管部門(mén)均重視 RWD 適用性問(wèn)題,即所使用的 RWD 是否適用于特定的研究目的和監(jiān)管決策的用途����。與其他國(guó)家有所不同,CDE 將數(shù)據(jù)適用性評(píng)價(jià)概括為兩個(gè)階段: ①源數(shù)據(jù)進(jìn)行初步適用性評(píng)價(jià): 即從數(shù)據(jù)可及性、倫理考慮����、合規(guī)����、代表性����、關(guān)鍵變量完整性����、樣本量和源數(shù)據(jù)活動(dòng)狀態(tài)等維度,判斷其是否滿足研究方案的基本分析要求; ②經(jīng)治理的數(shù)據(jù)的相關(guān)性、可靠性評(píng)價(jià),以及采用的或擬采用的數(shù)據(jù)治理機(jī)制( 數(shù)據(jù)標(biāo)準(zhǔn)和通用數(shù)據(jù)模型) 的評(píng)價(jià)分析,從而判斷治理后的數(shù)據(jù)是否適用于產(chǎn)生 RWE����。
美國(guó) FDA 發(fā)布的基于 EHR 和醫(yī)療保險(xiǎn)數(shù)據(jù)支持藥品監(jiān)管指南[9]中也同樣強(qiáng)調(diào)數(shù)據(jù)的可靠性和相關(guān)性評(píng)價(jià)是 RWD 是否能用于臨床研究����,有效支持藥物有效性和安全性監(jiān)管決策的兩個(gè)關(guān)鍵問(wèn)題[9]。日本PMDA 基本原則[19]中提出����,在使用注冊(cè)登記數(shù)據(jù)開(kāi)展研究時(shí),應(yīng)提早與登記數(shù)據(jù)庫(kù)建立者溝通����,了解數(shù)據(jù)庫(kù)構(gòu)建初衷及用處����,盡可能基于原有登記數(shù)據(jù)用途開(kāi)展研究。若使用注冊(cè)登記數(shù)據(jù)開(kāi)展回顧性研究解釋某干預(yù)有效性情況時(shí)����,需重點(diǎn)解釋變量選擇的適用性,避免引入選擇偏倚����。
2.2.1RWD 的相關(guān)性
相關(guān)性評(píng)價(jià)旨在評(píng)估 RWD是否與所關(guān)注的臨床問(wèn)題密切相關(guān)����,重點(diǎn)關(guān)注關(guān)鍵變量的覆蓋度、暴露/干預(yù)和臨床結(jié)局定義的準(zhǔn)確性����、目標(biāo)人群的代表性和多源異構(gòu)數(shù)據(jù)的融合性。數(shù)據(jù)庫(kù)覆蓋源人群的連續(xù)性和代表性對(duì)于評(píng)價(jià)此類研究結(jié)果的有效性十分重要����。應(yīng)考察與研究問(wèn)題有關(guān)的關(guān)鍵數(shù)據(jù)元素( 暴露����、結(jié)局和有關(guān)協(xié)變量) 所需的變量的可及性。對(duì)于注冊(cè)登記數(shù)據(jù)����,日本 PMDA2021 年新發(fā)布的基本原則[19]中提出 5 種適用場(chǎng)景并給予相應(yīng)解釋,申辦者需要根據(jù)研究目的確定選擇使用注冊(cè)登記數(shù)據(jù)的相關(guān)性����。美國(guó) FDA 指南[9]建議應(yīng)評(píng)估每個(gè)數(shù)據(jù)源����,以確定可用信息是否適用于解決特定的研究假設(shè)。由于現(xiàn)有的電子醫(yī)療保健數(shù)據(jù)不是為了支持監(jiān)管而開(kāi)發(fā)的����,因此了解它們?yōu)楸O(jiān)管目的而使用時(shí)的潛在局限性十分重要。另外����,在變量獲取過(guò)程中涉及影響數(shù)據(jù)相關(guān)性的問(wèn)題包括數(shù)據(jù)鏈接、分布式數(shù)據(jù)網(wǎng)絡(luò)以及非結(jié)構(gòu)化數(shù)據(jù)處理等����。
(1) 數(shù)據(jù)鏈接與整合: 當(dāng)研究涉及多個(gè)數(shù)據(jù)庫(kù)時(shí),需要將不同來(lái)源數(shù)據(jù)在個(gè)體水平進(jìn)行數(shù)據(jù)的鏈接����、融合和同構(gòu)處理。FDA 指南[9]給出較為詳細(xì)的操作建議: 如果研究涉及內(nèi)部與外部數(shù)據(jù)鏈接時(shí)����,需具體描述每個(gè)數(shù)據(jù)源中可獲取的變量信息����、鏈接方法以及數(shù)據(jù)鏈接有效性和完整度評(píng)估。不同數(shù)據(jù)鏈接的方法( 如基于概率的鏈接或確定性鏈接等[24])將導(dǎo)致不同的鏈接質(zhì)量����,因而對(duì)于不同的鏈接方法需給予具體說(shuō)明和鏈接穩(wěn)健性評(píng)價(jià)。如果研究涉及生成新的數(shù)據(jù)( 如采訪����、郵件或問(wèn)卷調(diào)查、可穿戴設(shè)備采集信息等) ,研究方案中需描述數(shù)據(jù)收集的方法以及將收集到的數(shù)據(jù)與 EHR 數(shù)據(jù)結(jié)合的方法����。
若研究需要整合多個(gè)中心的數(shù)據(jù)����,F(xiàn)DA 指南[9]建議需提供考慮到各中心存在因人群特征、臨床事件環(huán)境等因素帶來(lái)的潛在異質(zhì)性情況下����,如何確保所獲取的數(shù)據(jù)具有良好可及的研究質(zhì)量的說(shuō)明。
(2) 分布式數(shù)據(jù)網(wǎng)絡(luò): 若研究需構(gòu)建分布式數(shù)據(jù)網(wǎng)絡(luò)從而獲取多中心數(shù)據(jù)����,則可使用通用數(shù)據(jù)模型( common data model����,CDM) 實(shí)現(xiàn)。在美國(guó)����,CDM 已較多應(yīng)用于藥物安全性評(píng)價(jià)和監(jiān)測(cè)研究中,相比之下����,CDM 在我國(guó)的應(yīng)用尚處于起步探索階段����。CDE 將CDM 定義為一種數(shù)據(jù)治理機(jī)制����,通過(guò)該機(jī)制可以將源數(shù)據(jù)標(biāo)準(zhǔn)化為通用結(jié)構(gòu)����、格式和術(shù)語(yǔ),從而允許跨多個(gè)數(shù)據(jù)庫(kù)/數(shù)據(jù)集進(jìn)行數(shù)據(jù)整合����。理想的 CDM 應(yīng)具有訪問(wèn)源數(shù)據(jù)的能力,是可動(dòng)態(tài)擴(kuò)展和持續(xù)改進(jìn)的數(shù)據(jù)模型����,并有版本控制����。同時(shí),由于多源數(shù)據(jù)的結(jié)構(gòu)和類型的復(fù)雜性����、樣本規(guī)模和標(biāo)準(zhǔn)的差異性����,在將源數(shù)據(jù)轉(zhuǎn)換為通用數(shù)據(jù)模型的整體過(guò)程中����,需要對(duì)源數(shù)據(jù)進(jìn)行提取����、轉(zhuǎn)換����、加載,應(yīng)確保源數(shù)據(jù)在語(yǔ)法和語(yǔ)義上與目標(biāo)分析數(shù)據(jù)庫(kù)的結(jié)構(gòu)和術(shù)語(yǔ)一致����。
考慮到不同研究問(wèn)題所需的研究變量數(shù)據(jù)元素有所不同,F(xiàn)DA 指南[9]建議注意考慮分布式數(shù)據(jù)網(wǎng)絡(luò)中已構(gòu)建的 CDM 很少能包含全面的個(gè)體健康數(shù)據(jù)����,因而在使用 CDM 前需充分考慮具體研究問(wèn)題所需的變量元素以確定所選擇數(shù)據(jù)的相關(guān)性����、完整度和是否需要補(bǔ)充其他研究所需變量等關(guān)鍵問(wèn)題����。
(3) 非結(jié)構(gòu)化數(shù)據(jù): EHR 中的非結(jié)構(gòu)化數(shù)據(jù)蘊(yùn)含大量癥狀����、體征����、診斷相關(guān)數(shù)據(jù),隨著信息技術(shù)的飛速發(fā)展����,結(jié)合高效可行的臨床 RWD 采集模式,將其整理為可供分析的結(jié)構(gòu)化數(shù)據(jù)����,可以更好地利用這些信息開(kāi)展研究[25]。FDA 指南[9]建議在使用人工智能或其他機(jī)器學(xué)習(xí)����、自然語(yǔ)言處理等方法提取和處理非結(jié)構(gòu)化數(shù)據(jù)時(shí)����,需在研究方案和分析計(jì)劃中明確提取算法構(gòu)建的假設(shè)和計(jì)算機(jī)參數(shù)����,是否為有監(jiān)督學(xué)習(xí)的算法以及提取轉(zhuǎn)化算法驗(yàn)證等可能影響數(shù)據(jù)質(zhì)量和相關(guān)性的重要信息�。
2.2.2RWD 的可靠性
RWD 的可靠性主要從數(shù)據(jù)的完整性�、準(zhǔn)確性、透明性�、質(zhì)量控制和質(zhì)量保證幾個(gè)方面進(jìn)行評(píng)價(jià)。
(1) 完整性: 完整性是指數(shù)據(jù)信息的缺失程度����,包括變量的缺失和變量值的缺失���。NPMA 和 CDE發(fā)布的指導(dǎo)原則[23]建議對(duì)于不同研究,數(shù)據(jù)的缺失程度���、缺失分布�、缺失原因和變量值的缺失機(jī)制不盡相同�,應(yīng)該予以詳盡描述����。另外���,美國(guó) FDA 指南[9]中提及數(shù)據(jù)缺失問(wèn)題也常出現(xiàn)在不同數(shù)據(jù)庫(kù)鏈接過(guò)程中,如可通過(guò)其他數(shù)據(jù)庫(kù)中的變量作為某研究關(guān)鍵變量的替代變量( 如使用是否有低收入補(bǔ)助作為個(gè)體社會(huì)經(jīng)濟(jì)狀況變量的替代變量) 則需在研究方案和分析計(jì)劃中予以說(shuō)明����。
(2) 變量準(zhǔn)確性及其驗(yàn)證: 準(zhǔn)確性是指數(shù)據(jù)與其描述的客觀特征是否一致�,包括原始數(shù)據(jù)記錄的準(zhǔn)確性,數(shù)據(jù)采集的準(zhǔn)確性( 如是否建立規(guī)范統(tǒng)一的數(shù)據(jù)采集方法�,是否核查不同來(lái)源數(shù)據(jù)的準(zhǔn)確性等) ���,以及數(shù)據(jù)治理的恰當(dāng)性( 如是否建立規(guī)范統(tǒng)一的數(shù)據(jù)治理流程�,包括數(shù)據(jù)安全性處理�、數(shù)據(jù)鏈接、數(shù)據(jù)清洗����、數(shù)據(jù)編碼����、數(shù)據(jù)結(jié)構(gòu)化�、數(shù)據(jù)傳輸?shù)?���,是否核查?shù)據(jù)治理算法的正確性) 。
FDA 指南[9]針對(duì)使用 RWD 開(kāi)展臨床研究中所涉及的各主要設(shè)計(jì)元素( 研究對(duì)象�、暴露變量����、結(jié)局變量�、協(xié)變量以及定義各類變量所涉及的時(shí)間定義) 分別進(jìn)行了詳細(xì)的準(zhǔn)確性及其驗(yàn)證過(guò)程中的重要問(wèn)題的討論[9]??偨Y(jié)來(lái)說(shuō),針對(duì)上述各關(guān)鍵設(shè)計(jì)元素���,需根據(jù)研究問(wèn)題分別設(shè)定與臨床相關(guān)的概念性定義( a conceptual definition) 和由數(shù)據(jù)庫(kù)具體變量算法構(gòu)成的操作性定義 ( an operational definition) �。考慮到由操作性概念的算法可能無(wú)法十分準(zhǔn)確地區(qū)分每個(gè)個(gè)體相應(yīng)變量���,因而會(huì)導(dǎo)致錯(cuò)分偏倚,指南建議針對(duì)設(shè)計(jì)元素有關(guān)變量的操作性定義算法開(kāi)展驗(yàn)證���,評(píng)價(jià)其靈敏度����、特異度和預(yù)測(cè)值����。另外,在提交研究方案時(shí)建議具體描述計(jì)劃開(kāi)展驗(yàn)證研究所使用的標(biāo)準(zhǔn)參照�、驗(yàn)證方法和抽樣策略等���。如果所使用的操作定義前期開(kāi)展過(guò)驗(yàn)證評(píng)價(jià)����,需提供用于驗(yàn)證研究的數(shù)據(jù)來(lái)源�、研究對(duì)象�、各設(shè)計(jì)元素相關(guān)變量選取的時(shí)間框架、驗(yàn)證結(jié)果以及評(píng)價(jià)該操作定義的驗(yàn)證效果是否適用于計(jì)劃開(kāi)展的研究����。
針對(duì)使用注冊(cè)登記數(shù)據(jù)支持監(jiān)管決策���,日本PMDA 發(fā)布評(píng)估注冊(cè)登記數(shù)據(jù)可靠性需考慮要點(diǎn)中建議申辦者從使用數(shù)據(jù)的合規(guī)事項(xiàng)�、注冊(cè)登記數(shù)據(jù)庫(kù)政策支持、計(jì)算機(jī)系統(tǒng)�、數(shù)據(jù)質(zhì)量管理����、注冊(cè)數(shù)據(jù)質(zhì)量保證、數(shù)據(jù)提取和分析數(shù)據(jù)庫(kù)準(zhǔn)備等多個(gè)方面綜合考量注冊(cè)登記數(shù)據(jù)用于具體研究問(wèn)題的可靠性[20]�。
若使用注冊(cè)登記數(shù)據(jù)作為臨床試驗(yàn)的外對(duì)照時(shí),日本 PMDA 提出需特別注意注冊(cè)患者人群的納入排除標(biāo)準(zhǔn)����、招募條件���、隨訪時(shí)間�、結(jié)局測(cè)量方法及評(píng)價(jià)時(shí)間等方面應(yīng)與臨床試驗(yàn)的實(shí)驗(yàn)組具有可比性[19]����。另外���,需注意使用注冊(cè)登記數(shù)據(jù)開(kāi)展觀察性研究的方式( 回顧性研究還是前瞻性研究) 也將在一定程度上為臨床試驗(yàn)干預(yù)措施有效性和安全性評(píng)價(jià)帶來(lái)影響����。
(3) 透明性: RWD 的透明性是指 RWD 的治理方案和治理過(guò)程清晰透明�,應(yīng)確保分析數(shù)據(jù)中的關(guān)鍵暴露/干預(yù)變量����、協(xié)變量和結(jié)局變量能夠追溯至源數(shù)據(jù)出處( provenance) �,并反映數(shù)據(jù)的提取�、清洗����、轉(zhuǎn)換和標(biāo)準(zhǔn)化過(guò)程。CDE 發(fā)布的指導(dǎo)原則建議需清晰記錄和存檔數(shù)據(jù)治理標(biāo)準(zhǔn)化操作程序和驗(yàn)證確認(rèn)文件����,尤其是有關(guān)數(shù)據(jù)缺失程度�、變量值域����、衍生變量計(jì)算方法、映射關(guān)系以及各關(guān)鍵設(shè)計(jì)元素的算法開(kāi)發(fā)及驗(yàn)證過(guò)程等應(yīng)透明且可溯源( traceability)[23]����。
2.3���、RWD 全生命周期的質(zhì)量控制
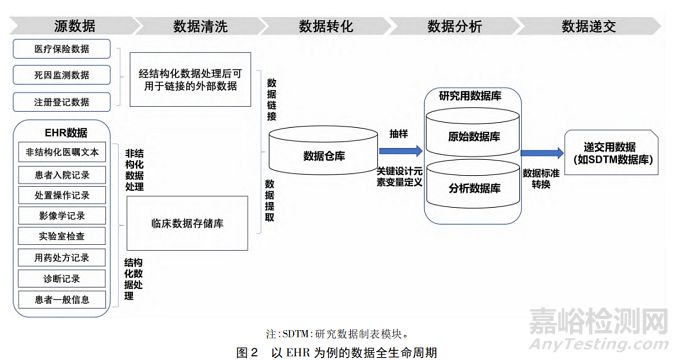
質(zhì)量控制是指用以確證數(shù)據(jù)治理的各個(gè)環(huán)節(jié)符合質(zhì)量要求而實(shí)施的技術(shù)和活動(dòng)。數(shù)據(jù)質(zhì)量控制是確保研究數(shù)據(jù)完整性���、準(zhǔn)確性和透明性的關(guān)鍵。美國(guó) FDA 指南[9]以 EHR 數(shù)據(jù)庫(kù)為例( 圖 2) ���,列舉了在數(shù)據(jù)從源數(shù)據(jù)經(jīng)獲取、轉(zhuǎn)換等數(shù)據(jù)治理過(guò)程整理為分析性數(shù)據(jù)庫(kù)���,最終用于遞交的數(shù)據(jù)全生命周期過(guò)程中所涉及到有關(guān)數(shù)據(jù)質(zhì)量控制相關(guān)要點(diǎn)、數(shù)據(jù)管理過(guò)程文件記錄要求等���。
2.4���、RWD 的倫理考慮及質(zhì)量管理體系
由于 RWD 來(lái)源于患者個(gè)人診療����、醫(yī)療保險(xiǎn)等多種途徑數(shù)據(jù)�,對(duì)其收集���、治理與使用等涉及倫理及患者隱私問(wèn)題�。日本 PMDA 基本原則將患者個(gè)人信息和權(quán)益保護(hù)放在 RWD 數(shù)據(jù)指南需首要注意的要點(diǎn)�。CDE 明確提及獲取和使用 RWD 以 開(kāi) 展RWS���,須通過(guò)倫理委員會(huì)的審查批準(zhǔn)���。
數(shù)據(jù)質(zhì)量控制需要建立完善的 RWD 質(zhì)量管理體系和標(biāo)準(zhǔn)操作規(guī)程���,以規(guī)范 RWD 的處理流程���,嚴(yán)格評(píng)價(jià)數(shù)據(jù)的合規(guī)性,充分保護(hù)患者安全及權(quán)益���,并在實(shí)際工作中持續(xù)優(yōu)化���、完善。NPMA 和 CDE 要求[23]數(shù)據(jù)安全保護(hù)范圍應(yīng)涵蓋包括數(shù)據(jù)收集���、數(shù)據(jù)提取、數(shù)據(jù)傳輸�、數(shù)據(jù)存儲(chǔ)����、數(shù)據(jù)交換、數(shù)據(jù)銷毀等在內(nèi)的全生命周期�。建立完善的人員管理制度,同時(shí)需建立從數(shù)據(jù)收集到數(shù)據(jù)遞交各環(huán)節(jié)的風(fēng)險(xiǎn)管理流程[23]����。
2.5���、用于遞交研究數(shù)據(jù)庫(kù)的數(shù)據(jù)標(biāo)準(zhǔn)
目前大多數(shù)地區(qū)監(jiān)管機(jī)構(gòu)對(duì)于遞交包含 RWD來(lái)源的研究數(shù)據(jù)所使用的數(shù)據(jù)標(biāo)準(zhǔn)尚未在指南或技術(shù)規(guī)范中提出明確要求,美國(guó) FDA 在 2021 年 10 月21 日發(fā)布的《用于藥品和生物制品提交的真實(shí)世界數(shù)據(jù)標(biāo)準(zhǔn)》指南草案[10]���,概述了對(duì)申辦者應(yīng)如何提交來(lái)自 RWD 來(lái)源的藥品和生物制品研究數(shù)據(jù)。這是國(guó)內(nèi)外藥械監(jiān)管機(jī)構(gòu)首部發(fā)布的專門(mén)針對(duì) RWD來(lái)源的研究數(shù)據(jù)遞交審批時(shí)所建議采用數(shù)據(jù)標(biāo)準(zhǔn)的指南���。
目前�,F(xiàn)DA 可以處理、審查和存檔使用數(shù)據(jù)標(biāo)準(zhǔn)目錄( Catalog) 中指定標(biāo)準(zhǔn)的臨床和非臨床研究數(shù)據(jù)( 包括來(lái)自 RWD 來(lái)源的數(shù)據(jù)) 的電子提交����。FDA 發(fā)布指南建議申辦方在向 FDA 遞交申報(bào)資料中提交研究數(shù)據(jù)時(shí)�,應(yīng)參考 FDA 于 2021 年 10 月更新的《研究數(shù)據(jù)技術(shù)一致性指南( 4.8.1 版) 》[26]中提供的數(shù)據(jù)標(biāo)準(zhǔn)���、建議和一般注意事項(xiàng)。當(dāng)尋求使RWD 轉(zhuǎn)換成為符合 FDA 支持的數(shù)據(jù)標(biāo)準(zhǔn)時(shí)����,申辦方應(yīng)考慮在數(shù)據(jù)遞交時(shí)以所需格式生成研究數(shù)據(jù)集可能需要的相關(guān)數(shù)據(jù)轉(zhuǎn)換或映射�,同時(shí)需在研究方案、數(shù)據(jù)管理計(jì)劃和( 或) 最終研究報(bào)告中描述數(shù)據(jù)轉(zhuǎn)換為相應(yīng)標(biāo)準(zhǔn)的方法����。該指南推薦推廣符合FDA 當(dāng)前支持的臨床數(shù)據(jù)交換標(biāo)準(zhǔn)協(xié)會(huì)( clinical data interchange standards consortium����,CDISC) 開(kāi)發(fā)的 CDISC 標(biāo)準(zhǔn)[27]在 RWD 的應(yīng)用。在充分記錄所使用的一致性方法及其依據(jù)后���,可將源自 RWD 的研究數(shù)據(jù)轉(zhuǎn)換為研究數(shù)據(jù)制表模塊( study data tabulation model,SDTM) 數(shù)據(jù)集�,并在適用的藥物申報(bào)資料中提交給 FDA����。
另外����,指南還強(qiáng)調(diào)為加強(qiáng) RWD 到臨床研究數(shù)據(jù)中的可溯源性�,需重視在元數(shù)據(jù)( metadata) 記錄里明確闡述數(shù)據(jù)意義上的區(qū)別[28]。同時(shí)�,在數(shù)據(jù)管理和數(shù)據(jù)轉(zhuǎn)換過(guò)程中,應(yīng)建立適當(dāng)?shù)牧鞒桃栽黾訉?duì)所得數(shù)據(jù)的可靠性����。這些過(guò)程的記錄可能包括但不限于從源數(shù)據(jù)系統(tǒng)到最終研究分析數(shù)據(jù)集的數(shù)據(jù)添加、刪除或更改的電子文件( 即元數(shù)據(jù)驅(qū)動(dòng)的稽查跟蹤����、質(zhì)量控制程序等) �。申辦方還應(yīng)在其藥物提交資料中記錄為使 RWD 轉(zhuǎn)換符合當(dāng)前 FDA 支持的數(shù)據(jù)標(biāo)準(zhǔn)數(shù)據(jù)時(shí)發(fā)生的變更���,以及這些變更的潛在影響,如將性別變量或其他變量?jī)?nèi)容映射到 CDISC的術(shù)語(yǔ)對(duì)研究結(jié)果的潛在影響���。另外����,該指南還強(qiáng)調(diào)記錄申辦方為 RWD 選擇特定 CDISC 數(shù)據(jù)元素的依據(jù)以及記錄兩者之間的差異至關(guān)重要���。
此外�,申辦者應(yīng)包括一個(gè)數(shù)據(jù)詞典�,記錄所使用的每個(gè)數(shù)據(jù)元素的定義以及該元素的所有相關(guān)信息,例如其與其他數(shù)據(jù)的關(guān)系�、來(lái)源、用法和格式���。建議把相關(guān)數(shù)據(jù)集/域中的詳細(xì)映射以及流程放入可擴(kuò)展標(biāo)記語(yǔ)言( define-XML) 文件中進(jìn)行傳輸。
2.6�、與監(jiān)管機(jī)構(gòu)的溝通
為保證 RWD 的質(zhì)量符合監(jiān)管要求,CDE 鼓勵(lì)申請(qǐng)人與監(jiān)管機(jī)構(gòu)及時(shí)溝通交流[23]���。可在研究開(kāi)始前就擬定用于研究的 RWD 第一階段適用性評(píng)價(jià)( 數(shù)據(jù)可及性���、樣本代表性和數(shù)據(jù)質(zhì)量) 等問(wèn)題進(jìn)行交流。特別的�,日本 PMDA 對(duì)于注冊(cè)登記數(shù)據(jù)用于監(jiān)管規(guī)定了 5 種適用場(chǎng)景,建議申辦者在研究開(kāi)始前也跟監(jiān)管機(jī)構(gòu)進(jìn)行充分的討論���。在研究進(jìn)行過(guò)程中����,如需對(duì)數(shù)據(jù)治理方案進(jìn)行調(diào)整�,申辦者需衡量數(shù)據(jù)治理計(jì)劃更改對(duì)于研究潛在影響,征得監(jiān)管部門(mén)同意后����,遞交更新的研究方案和數(shù)據(jù)治理計(jì)劃���。另外���,美國(guó) FDA 發(fā)布的數(shù)據(jù)標(biāo)準(zhǔn)指南中提及申辦者應(yīng)與監(jiān)管審查部門(mén)盡早討論在藥物遞交資料中從 RWD 來(lái)源獲得的任何計(jì)劃的研究數(shù)據(jù)遞交資料及其將數(shù)據(jù)轉(zhuǎn)換為當(dāng)前監(jiān)管部門(mén)支持的數(shù)據(jù)標(biāo)準(zhǔn)的方法[10]。
3���、我國(guó)在 RWD 及數(shù)據(jù)標(biāo)準(zhǔn)方面的積極探索實(shí)踐
RWE 正逐步成為藥械安全性����、有效性評(píng)價(jià)支持監(jiān)管決策的重要組成部分���,我國(guó)已發(fā)布多個(gè)政策探索與實(shí)踐 RWS 應(yīng)用于創(chuàng)新藥械評(píng)價(jià)與監(jiān)管����。2019年 6 月����,NMPA 與海南省政府聯(lián)合啟動(dòng)海南臨床RWD 應(yīng)用試點(diǎn)工作; 9 月《海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)臨床 RWD 應(yīng)用試點(diǎn)工作實(shí)施方案》發(fā)布,推動(dòng)試點(diǎn)落地�。2020 年 6 月,海南省藥品監(jiān)督管理局在 NMPA 的指導(dǎo)下修訂《海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)臨床急需進(jìn)口醫(yī)療器械管理暫行規(guī)定》�,增加臨床 RWD 應(yīng)用試點(diǎn)相關(guān)內(nèi)容����,明確基本概念、適用范圍�、基本原則、重要制度����、工作流程及注冊(cè)申報(bào)要求���,為開(kāi)展 RWD 應(yīng)用研究工作奠定基礎(chǔ)����。
另外�,博鰲樂(lè)城特許藥械 RWD 研究具有唯一性、廣泛性和多元性三大顯著特點(diǎn)[29]���,現(xiàn)有已發(fā)布的相關(guān) RWD 用于藥械監(jiān)管決策的法規(guī)政策和指導(dǎo)原則對(duì)于樂(lè)城 RWD 的針對(duì)性非常有限。鑒于此���,近年來(lái)�,我國(guó)學(xué)者分析樂(lè)城先行區(qū)開(kāi)展 RWD 研究的關(guān)鍵特征[30]���,探討 RWD 研究合適的外對(duì)照設(shè)置方法[31]。為使得樂(lè)城數(shù)據(jù)滿足 CDE 指導(dǎo)原則中藥械監(jiān)管要求的 RWD 適用性標(biāo)準(zhǔn)[23]����,晉菲斐等[32]學(xué)者利用海南博鰲樂(lè)城國(guó)際醫(yī)療旅游先行區(qū)一個(gè)醫(yī)療器械 RWS 試點(diǎn)項(xiàng)目����,研究了采用自然語(yǔ)言處理的數(shù)據(jù)采集模式( 即醫(yī)院信息系統(tǒng)日常收集的研究數(shù)據(jù)可進(jìn)行自動(dòng)化提取�,研究特定采集數(shù)據(jù)仍然需要額外收集和錄入的方式) 并與傳統(tǒng)臨床研究數(shù)據(jù)采集模式( 根據(jù)病例報(bào)告表進(jìn)行數(shù)據(jù)收集并人工錄入研究數(shù)據(jù)庫(kù)) 進(jìn)行了比較研究���。自動(dòng)化數(shù)據(jù)采集模式能提高從醫(yī)院真實(shí)世界數(shù)據(jù)到臨床研究數(shù)據(jù)的采集效率���,也能保證數(shù)據(jù)的準(zhǔn)確性���,符合監(jiān)管要求,為RWS 提供高效���、可靠的數(shù)據(jù)采集模式。在此基礎(chǔ)上���,姚晨等[33] 學(xué)者積極探索 RWD 的標(biāo)準(zhǔn)轉(zhuǎn)化研究[34]和自然語(yǔ)言處理技術(shù)的應(yīng)用���,提出了適用于我國(guó)開(kāi)展 RWS 的數(shù)據(jù)采集���、治理和管理創(chuàng)新模式�。
為了應(yīng)對(duì)國(guó)內(nèi)普遍存在的 EMR 數(shù)據(jù)質(zhì)量與標(biāo)準(zhǔn)化程度不高導(dǎo)致 RWD 適用性不足�、可利用程度有限 的 困 境�,彭 曉 霞 等[35]學(xué) 者 提 出“開(kāi) 發(fā) 專 病CDISC-CRF 助力我國(guó) RWD 生態(tài)建設(shè)”的設(shè)想,并以兒童神經(jīng)母細(xì)胞瘤疾病為例���,構(gòu)建實(shí)現(xiàn) CDISC-CRF建設(shè) RWD 生態(tài)實(shí)現(xiàn)流程[35]���。通過(guò)病種遴選����、遵循當(dāng)前診療規(guī)范開(kāi)發(fā)電子病歷報(bào)告表 ( case report form�,CRF) �。開(kāi)發(fā)專病 CDISC-CRF 數(shù)據(jù)采集平臺(tái),以期未來(lái)可為我國(guó)高效啟動(dòng)新藥臨床試驗(yàn)���、開(kāi)展不同藥物或治療方案之間的療效比較研究等提供高質(zhì)量數(shù)據(jù)源。
針對(duì) CDE 指導(dǎo)原則中所涉及的 RWD 倫理考慮和質(zhì)量控制等問(wèn)題���,李延龍等[36]對(duì) RWD 研究數(shù)據(jù)“采集”和“使用”合規(guī)性進(jìn)行概述�,提出研究過(guò)程中需保證數(shù)據(jù)既滿足監(jiān)管和倫理審查要求���,又合理預(yù)防數(shù)據(jù)違規(guī)風(fēng)險(xiǎn)、保護(hù)患者隱私�,促進(jìn) RWD 研究數(shù)據(jù)安全有序流動(dòng)。
4����、展望
利用高質(zhì)量 RWD 生成 RWE 輔助監(jiān)管決策已成為全球藥械監(jiān)管機(jī)構(gòu)�、制藥工業(yè)界和學(xué)術(shù)界共同關(guān)注和討論的熱點(diǎn)話題。如何建立適合我國(guó)應(yīng)用環(huán)境的 RWD 平臺(tái)����,合理評(píng)價(jià)針對(duì)特定問(wèn)題 RWD 適用性���、相關(guān)性���、完整性以及數(shù)據(jù)質(zhì)量等問(wèn)題���,一定程度上決定著 RWE 用于監(jiān)管決策的力度和未來(lái)數(shù)十年的行業(yè)發(fā)展?jié)摿Α?/span>
盡管面臨諸多挑戰(zhàn)����,但也應(yīng)該清楚認(rèn)識(shí)到我國(guó)具有數(shù)據(jù)資源豐富���、體量大等戰(zhàn)略資源優(yōu)勢(shì)地位。當(dāng)前應(yīng)積極總結(jié)和借鑒國(guó)外監(jiān)管機(jī)構(gòu)的經(jīng)驗(yàn)�,在政策紅利支持下,系統(tǒng)提升 RWD 環(huán)境和體系建設(shè)����,特別是在罕見(jiàn)病用藥、兒童用藥和中醫(yī)藥等方面�,創(chuàng)建臨床創(chuàng)新數(shù)據(jù)網(wǎng)絡(luò)建設(shè),完善數(shù)據(jù)和研究方法相關(guān)的行業(yè)規(guī)范和指導(dǎo)原則����,為進(jìn)一步創(chuàng)新藥品研發(fā)和審評(píng)模式�,提高研發(fā)效率,科學(xué)監(jiān)管決策奠定扎實(shí)基礎(chǔ)����。
參考文獻(xiàn)/資料
[1]聶曉璐,王勝鋒,姚晨等.國(guó)內(nèi)外真實(shí)世界數(shù)據(jù)/證據(jù)的相關(guān)藥械監(jiān)管政策法規(guī)及指導(dǎo)原則比較研究[J].藥物流行病學(xué)雜志,2022,31(01):5-12+49.DOI:10.19960/j.cnki.issn10050698.2022.01.001.