醫(yī)療器械設(shè)計(jì)開發(fā)過程中對于終產(chǎn)品進(jìn)行生物相容性評價是必不可少的的環(huán)節(jié),因其周期往往較長��,評價的充分性和完整性往往是影響整個設(shè)計(jì)開發(fā)過程至關(guān)重要的環(huán)節(jié)���?;诖?����,作者針對性的對于生物學(xué)評價常用的生物學(xué)試驗(yàn)談?wù)勗趯?shí)踐過程中的一些心得,避免大家踩同樣的坑��。
首先我們結(jié)合器審中心中涉及生物學(xué)評價方面的問題����,先針對性的看看大家關(guān)注的問題以及器審中心的回答。我們在實(shí)際過程中最想省掉的可能就是生物學(xué)試驗(yàn)了���,那么我們先看下哪些材料可以豁免生物學(xué)試驗(yàn)?zāi)兀?/span>
生物學(xué)評價不能豁免,可通過等同性比較�,證明申報產(chǎn)品與已上市產(chǎn)品具有相同的生物相容性,從而確定申報產(chǎn)品的生物學(xué)試驗(yàn)的減化或免除���。對于符合YY 0341.1附錄B的材料,仍需通過等同性比較���,如論證生產(chǎn)過程是否引入新的生物學(xué)風(fēng)險�,兩者的生產(chǎn)過程(加工過程�����、滅菌過程���、包裝等)是否相同,因?yàn)樯a(chǎn)過程也可能會引入新的有害物質(zhì)(滅菌劑�、加工助劑、脫模劑等殘留物)�,若經(jīng)評價,生產(chǎn)過程不引入新的生物學(xué)風(fēng)險��,則可認(rèn)為豁免生物學(xué)試驗(yàn)����。
看到這里是不是覺得很爽,其實(shí)并不是所有材料都需要進(jìn)行生物學(xué)試驗(yàn)的��,是有許多材料可以豁免生物學(xué)試驗(yàn)的���。大家可以放心大膽的使用,這是來自器審中心的回復(fù)�����。
此外����,我們也可以選擇已上市同等產(chǎn)品(通常為自己家的已上市產(chǎn)品�,別家的通常也很難拿到等同性證據(jù))的數(shù)據(jù),但我們需要考慮一些影響生物相容性風(fēng)險的因素���,具體可參考器審中心的答復(fù)。
(1) 影響生物相容性風(fēng)險的主要因素有:產(chǎn)品的材料化學(xué)組成(包括各組成材料比例)���、產(chǎn)品物理結(jié)構(gòu)���、表面特性、生產(chǎn)工藝�、滅菌方法��、原材料供應(yīng)商及技術(shù)規(guī)范��、液體類產(chǎn)品/濕態(tài)保存類產(chǎn)品還需考慮內(nèi)包裝材料�����。
(2)若受試品與申報產(chǎn)品在以上所列可能影響生物相容性風(fēng)險的因素中存在不一致的情況�����,則需提供充分的理由和證據(jù)支持所提交的試驗(yàn)報告適用于申報產(chǎn)品����,必要時補(bǔ)充相應(yīng)的生物學(xué)評價資料,如可瀝濾物分析及毒理學(xué)風(fēng)險評定資料�����、相關(guān)生物學(xué)試驗(yàn)項(xiàng)目的補(bǔ)充試驗(yàn)等�����。
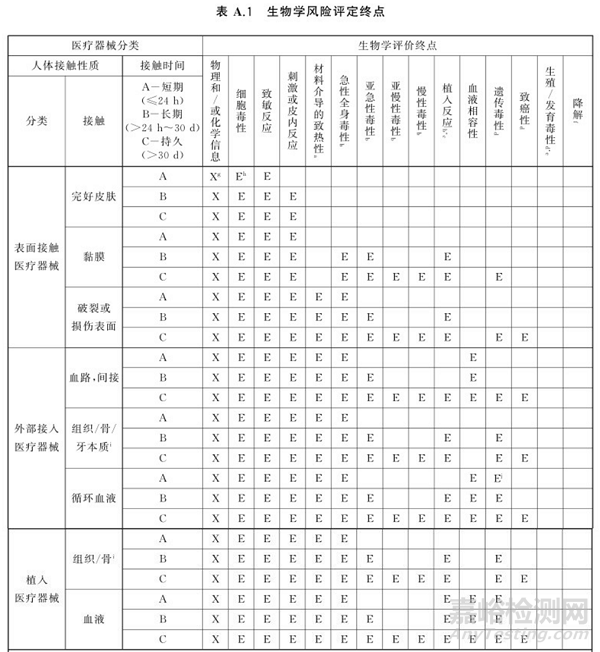
至于詳細(xì)的生物學(xué)試驗(yàn)需要進(jìn)行哪些����,這里不過多介紹�����,大家參照最新的GB/T 16886.1-2022(2023年5月1日生效)附錄A 生物學(xué)風(fēng)險評定涉及的終點(diǎn)���,根據(jù)醫(yī)療器械分類(人體接觸類型及接觸時間)選擇對應(yīng)的生物學(xué)評價終點(diǎn)(即生物學(xué)試驗(yàn)項(xiàng)目),如下表所示�����。
值得一提的是��,關(guān)于慢性毒性����,其周期是生物學(xué)試驗(yàn)中周期比較長的試驗(yàn)項(xiàng)目��,同時也容易存在一定的失敗性����,可采用化學(xué)表征+毒理學(xué)評價的方式代替�����,這一點(diǎn)在器審中心發(fā)表的論文(醫(yī)療器械生物相容性評價:現(xiàn)狀�����、進(jìn)展和趨勢�����,中國醫(yī)療器械信息�����,2021,27,11)中有提及��,感興趣的可自行下載查看���。此外,對于生殖和發(fā)育毒性以及降解是需要根據(jù)材料的特性進(jìn)行���,而不是都不需要做��。比如對于新材料或材料有已知的生殖或發(fā)育毒性,或者器械用于孕婦��,則需要進(jìn)行生殖與發(fā)育毒性測試�;若材料存在降解可能的,就要提供降解信息����。
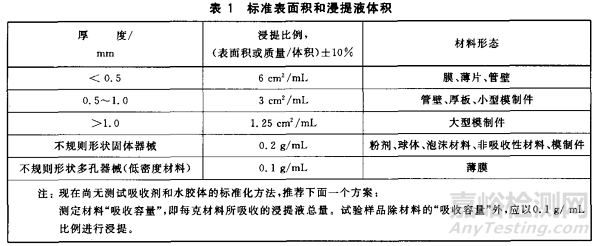
同時��,對于不同類型或與組織持續(xù)接觸時間不同的器械部件�,需要分別浸提和測試。這一點(diǎn)非常常見也非常重要�����,比如某一產(chǎn)品存在輸送和植入部分���,則輸送和植入部分需要分別進(jìn)行測試�����,也就是需要根據(jù)GB/T 16886.1附錄A的表進(jìn)行生物學(xué)評價終點(diǎn)分別選擇和測試。對于長期(大于24h小于30天)或持久接觸(大于30天)的醫(yī)療器械����,建議采用72h浸提時間��,同時對于植入部分��,浸提溫度建議選擇55±2攝氏度����。同時,我們最關(guān)心的浸提濃度���,通常我們會被告知為0.2g/mL(來自GB/T 16886.12表1����,可能因?yàn)槲覀兊钠餍禐椴灰?guī)則形狀)�,但關(guān)于浸提是使用表面積還是重量,建議優(yōu)先選擇表面積(至少FDA也是認(rèn)可的���,如果申報FDA建議選擇表面積),具體的可參考ISO 10993-12��。此外����,我們也看下器審中心關(guān)于濃度的答復(fù)。
對于試驗(yàn)中出現(xiàn)統(tǒng)計(jì)學(xué)差異的評價指標(biāo)��,試驗(yàn)報告需明確相關(guān)差異是否有生物學(xué)意義并提供理由���、分析判斷相關(guān)差異與受試產(chǎn)品的關(guān)系,而非僅簡單列出具有統(tǒng)計(jì)學(xué)差異的項(xiàng)目��。另外���,對于通過植入方式接觸受試品的亞慢性毒性試驗(yàn)���,需提供植入劑量的確定依據(jù)��,如��,在動物可耐受情況下�����,推薦樣本植入劑量為擬用人體臨床劑量的50~100倍。
浸提溶劑的選擇也是生物學(xué)試驗(yàn)中至關(guān)重要的��,對于浸提溶劑CMDE有相應(yīng)的答復(fù)����,值得注意的是這是2018年的答復(fù)��。GB/T 16886.3已更新至2019版�����,如果沒有記錯的話也是需要雙浸提的�。
對于細(xì)胞毒性試驗(yàn)��,由于含血清培養(yǎng)基是支持試驗(yàn)體系中細(xì)胞生長的必需介質(zhì),且具有浸提極性和非極性兩種物質(zhì)的能力��,應(yīng)當(dāng)考慮作為細(xì)胞毒性試驗(yàn)首選浸提介質(zhì)�����,此種情況下可僅選用含血清培養(yǎng)基一種浸提介質(zhì)��。對于致敏試驗(yàn)��、刺激或皮內(nèi)反應(yīng)試驗(yàn)����、急性全身毒性試驗(yàn)等項(xiàng)目�,需考慮選擇極性�、非極性兩種浸提介質(zhì);對于遺傳毒性試驗(yàn)�,根據(jù)GB/T 16886.3標(biāo)準(zhǔn)規(guī)定�,適當(dāng)時,應(yīng)使用兩種適宜的浸提溶劑�����,一種是極性溶劑,另一種是非極性溶劑或適合于醫(yī)療器械性質(zhì)和使用的液體���,兩種溶劑均應(yīng)與試驗(yàn)系統(tǒng)相容。
2018年器審中心共性問題回答生物學(xué)試驗(yàn)浸提介質(zhì)種類有何注意事項(xiàng)���?
此外�����,我們在設(shè)計(jì)開發(fā)過程中常見的問題,比如是否可以采用原材料或替代性樣品進(jìn)行生物學(xué)評價����,這個我們可以看看器審中心的答復(fù)�。值得一提的是因?yàn)橹踩霕悠烦32捎锰娲鷺悠愤M(jìn)行,尺寸要求在標(biāo)準(zhǔn)中有明確的規(guī)定(具體參照GB/T 16886.6)��,因此也常常成為發(fā)補(bǔ)的重點(diǎn)����。因此��,我們在生產(chǎn)植入樣品時,建議擬定一個制備方案����,并在其中從植入試驗(yàn)劑量���、樣品表面特性等方面綜合分析植入試驗(yàn)?zāi)芊翊矸N產(chǎn)品的局部植入反應(yīng)風(fēng)險�����。
生物學(xué)評價應(yīng)考慮產(chǎn)品制造所用材料���、預(yù)期的添加劑�、工藝污染物和殘留物、可濾瀝物質(zhì)��、 降解產(chǎn)物��、最終產(chǎn)品的物理特性�����、各個組件及他們在最終產(chǎn)品中的相互作用����、包裝材料和保存介質(zhì)對生物相容性的影響等因素,因此產(chǎn)品的生物相容性試驗(yàn)原則上應(yīng)采用終產(chǎn)品進(jìn)行或采用取自最終產(chǎn)品上有代表性的樣品����。如采用終產(chǎn)品進(jìn)行試驗(yàn)不可行,可考慮采用與終產(chǎn)品以相同的工藝過程制得的試樣進(jìn)行試驗(yàn)���,但需對試樣的代表性進(jìn)行充分的分析論證。另外�����,當(dāng)一個器械上有不同的組成材料時��,在選擇試驗(yàn)樣品時應(yīng) 考慮不同成分間可能存在的化學(xué)反應(yīng)���,以及不同成分對人體的綜合作用。但若醫(yī)療器械不同組件與人體接觸性質(zhì)和接觸時間不同���,應(yīng)考慮分別進(jìn)行生物學(xué)試驗(yàn)。
至此,我們講完了生物學(xué)試驗(yàn)��,那么一份完整的生物學(xué)評價報告應(yīng)包含哪些部分呢��。這一點(diǎn)我們可以從醫(yī)療器械注冊申報資料要求及說明中找到答案(完整版本可公眾號內(nèi)回復(fù) 注冊申報 獲?���。?/span>
(1)描述產(chǎn)品所用材料及與人體接觸性質(zhì)�,設(shè)計(jì)和生產(chǎn)過程中可能引入的污染物和殘留物,設(shè)計(jì)和生產(chǎn)過程中可能產(chǎn)生的析出物(包括濾瀝物和/或蒸發(fā)物)�����、降解產(chǎn)物��、加工殘留物��,與醫(yī)療器械直接接觸的包裝材料等相關(guān)信息����。
(2)描述申報產(chǎn)品的物理和/或化學(xué)信息并考慮材料表征(如適用)���,如器械的物理作用可能產(chǎn)生生物學(xué)風(fēng)險���,應(yīng)當(dāng)進(jìn)行評價。
(3)生物學(xué)評價的策略�、依據(jù)和方法。
(4)已有數(shù)據(jù)和結(jié)果的評價�。
(5)選擇或豁免生物學(xué)試驗(yàn)的理由和論證。
(6)完成生物學(xué)評價所需的其他數(shù)據(jù)��。
NMPA 醫(yī)療器械注冊申報資料要求及說明
到此通過生物學(xué)試驗(yàn)進(jìn)行的生物學(xué)評價就介紹完畢了��,那么待后期產(chǎn)品上市后���,如在實(shí)際生產(chǎn)過程中,修改了原材料或工藝發(fā)生了變化�,是否需要重新進(jìn)行生物學(xué)評價呢�����?我想答案是肯定的����,基本原則就是當(dāng)我們的風(fēng)險產(chǎn)生了變化則需要重新進(jìn)行生物學(xué)評價,這一點(diǎn)與風(fēng)險管理一樣是貫穿產(chǎn)品整個生命周期的�����。具體需要評價哪些問題可參考《無源醫(yī)療器械產(chǎn)品原材料變化評價指南》(2020年第33號)�����。