生物材料與人體各組織間的相互作用與影響是生物材料一直以來關(guān)注的焦點����,更是生物相容性研究的基礎(chǔ)。醫(yī)療器械作為現(xiàn)代人們醫(yī)療的必須手段�,其安全有效性的評價是保障我國醫(yī)療事業(yè)健康發(fā)展的基礎(chǔ)。
現(xiàn)有的醫(yī)療器械安全有效性評價是基于 GB/T 16886 系列標(biāo)準要求�,標(biāo)準中有些方法主要參考藥包材等檢驗方法,但由于醫(yī)療器械的材料����、預(yù)期用途�����、使用方法等與藥包材有很大區(qū)別,加上醫(yī)療器械本身的多樣性���,現(xiàn)有生物相容性項目是否足夠與完善就成為醫(yī)療器械生物相容性領(lǐng)域研究的焦點��。生物學(xué)試驗中樣品的制備條件作為生物學(xué)試驗的基礎(chǔ)�,直接影響著試驗數(shù)據(jù)的準確性和有效性�����,更應(yīng)受到足夠的重視�。
生物相容性作為生物材料研究中始終貫穿的主題,其并沒有一個固定化的概念�。一般是指材料與宿主之間的相容性,包括組織相容性和血液相容性���。通常意義上���,生物相容性是指材料與生物體之間相互作用后產(chǎn)生的各種生物��、物理��、化學(xué)等反應(yīng)����,也就是說材料植入人體后與人體的相容程度����。
按ISO會議的解釋,"生物相容性是指生命體組織對非活性材料產(chǎn)生反應(yīng)的一種性能�。近年來,生物相容性的概念發(fā)生了較大的變化�����,其對象不僅為非活性材料�����,而且也涉及活性材料如組織工程��。
生物材料對于宿主來說是一種外源性物質(zhì)�,不管是外科手術(shù)植入的器械,還是用于再生醫(yī)學(xué)的構(gòu)成物���、藥物或基因送遞的載體���、輔助診斷或成像的介質(zhì)���。無論想達到什么目的�,這些生物材料都不應(yīng)該在宿主或患者體內(nèi)產(chǎn)生明顯的臨床不良反應(yīng),因此要對生物材料進行生物安全性評價���。
1����、 醫(yī)療器械產(chǎn)品進行生物相容性檢測的意義
隨著生物醫(yī)學(xué)工程的發(fā)展�,醫(yī)療器械行業(yè)也在飛速地進步。許多新型的生物材料不斷涌現(xiàn)并不斷被應(yīng)用于醫(yī)療器械的研發(fā)與應(yīng)用中�����。
一方面各種三類醫(yī)療器械產(chǎn)品的結(jié)構(gòu)及組成成分越來越復(fù)雜���,特別是人體直接接觸的外部接入器械及植入器械結(jié)構(gòu)復(fù)雜�����、材質(zhì)多樣���;另一方面目前越來越多的一次性無菌醫(yī)療器械應(yīng)用于臨床���,在應(yīng)用前必須是無菌包裝,稍有不慎就容易造成細菌內(nèi)毒素及其他形式的污染�����,因而這類產(chǎn)品的醫(yī)療風(fēng)險越來越高��。
為了保證產(chǎn)品的安全有效�����,一種新的生物材料在進入臨床之前必須進行生物相容性的評價�,這就對生物材料的生物相容性評價提出了更高的要求。
2����、 醫(yī)用高分子材料生物相容性研究現(xiàn)狀
2.1 生物材料的分類
生產(chǎn)制造人工器官的材料有多種,但它和普通的材料最大的不同處�����,在于材料的生物相容性。只有能滿足生物相容性要求的材料����,才有可能成為制造人工器官的材料,人們通常稱這類材料為生物醫(yī)學(xué)材料 (biomedical material) 或 生物材料 (biomaterial)�����。
由于種類繁多�、應(yīng)用目的不同�,目前生物材料還沒有統(tǒng)一的分類標(biāo)準。當(dāng)今廣泛應(yīng)用的生物材料分類�����,主要有下列四種�。
(1)醫(yī)用高分子材料 ( 高聚物 )。如熱塑型�����、熱 固性���、合成橡膠彈性體���、合成纖維����、粘合劑等�����。
(2)天然高分子材料�����。如天然橡膠�、多肽類、白蛋白�����、絹絲類等�����。
(3)金屬材料��。如金屬(鈦、銅��、金�、銀、鉑等)和合金材料(鈦合金�、不銹鋼、鎳鉻合金等)�。
(4)無機材料。如陶瓷���、碳素�����、玻璃����、石膏等����。
2.2 醫(yī)用高分子材料生物相容性研究現(xiàn)狀
2.2.1 醫(yī)用高分子材料分類
醫(yī)用高分子材料作為生物材料的重要組成部分在我國 研究起步較早�,發(fā)展較快,現(xiàn)有醫(yī)用高分子材料 60 多種���,制品達 400 余種���,用于醫(yī)療的聚甲基丙烯酸甲酯每年近 300 噸����。然而���,我國醫(yī)用高分子材料的研究目前仍然處于經(jīng)驗和半經(jīng)驗階段���,還沒有能夠建立在分子設(shè)計的基礎(chǔ)上。
現(xiàn)代醫(yī)學(xué)的進步已經(jīng)越來越依賴于生物材料的發(fā)展�,醫(yī)用高分子材料作為其重要組成部分應(yīng)用更加廣泛,需求量也隨之越來越大�。按照醫(yī)學(xué)用途,主要可分為:
(1)一次性使用的醫(yī)用高分子材料�。如輸注器械、血袋�����、各種導(dǎo) 管及插管����、采血管���、高分子繃帶等。
(2)植入�����、介入類材料���。如人工血管�、人工心臟瓣膜�����、人工晶體�、人工關(guān)節(jié)、人工腎��、人工肺�、中心靜脈導(dǎo)管等。
(3)用于人體組織修復(fù)材料��。如人工皮膚���、疝修補片等�����。
(4)藥物和藥物控釋用高分子材料�。如載藥支架等。
(5)醫(yī)藥包裝用高分子材料�����。如預(yù)灌封注射器�����、藥用膠囊、大輸液瓶等。
2.2.2 我國醫(yī)用高分子材料技術(shù)水平主要體現(xiàn)在以下幾個方面。
(1)用于人造器官,如心 臟瓣膜�����、人工腎、人造皮膚�����、疝氣樸片等�����。
我國在此領(lǐng)域起步較晚��,但在初級的組織工程支架材料方面投入較大,浙江大學(xué)�、清華大學(xué)����、中科院成都有機所等均有課題小組進行相關(guān)研究�����,他們通過多層復(fù)合���、共聚等手段將聚乳酸�、聚乙內(nèi)酯、海藻酸鈉等生物相容性材料制備成支架材料。
(2) 用于醫(yī)療器械,如手術(shù)縫線����、導(dǎo)尿管�����、檢查器械����、植入器械等���。
目前的手術(shù)縫線多數(shù)來自于絲素蛋白��,其纖維不但具有優(yōu)良的生物相客性��,也具有很好的力學(xué)強度���;而可吸收縫線則主要采用聚乳酸��,我國目前已經(jīng)可以完全自主生產(chǎn)這幾種縫線��,同時在國內(nèi)擁有較大的市場份額���。
(3)用于藥物助劑����,如藥物控釋載體����、靶向材料等。
我國在這方面的研發(fā)位于世界前列���,中科院長春應(yīng)化所研究人員利用靜電紡絲技術(shù)制備的聚乳酸超細纖維可以包埋油溶、水溶藥物��,同時實現(xiàn)控制釋放���。
2.2.3 醫(yī)用高分子材料的生物相容性評價研究
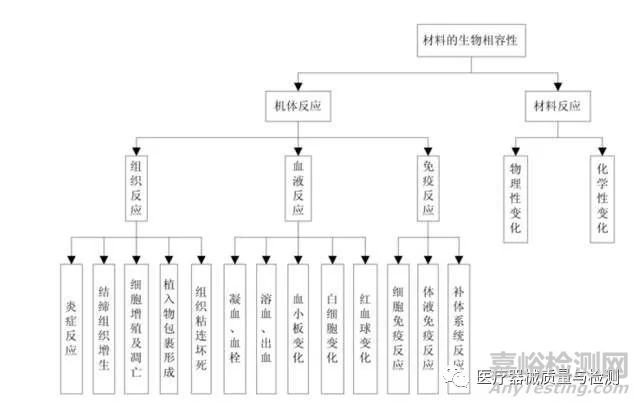
材料的生物相容性包含很多方面(圖 1)����。
圖 1 材料的生物相容性
目前國際上通用的高分子材料安全評價項目有:細胞毒性試驗���,皮膚刺激試驗����,全身急性毒性試驗,亞急性毒性試驗���,慢性毒性試驗�,皮內(nèi)試驗��,熱原試驗�����,長期植入試驗��,黏膜刺激試驗���,組織細胞的黏附性和增殖性試驗等�����。
其中細胞毒性試驗以其簡便�、快捷����、靈敏性高��、節(jié)省動物等優(yōu)點均被列為首選試驗項目�����,作為評價材料毒性的重要指標(biāo)�����。評價生物材料的體外細胞生物相容性試驗方法較多�,亦各有其特點�。各試驗方法之間雖然存在一定的相關(guān)性,但是很難達到完全一致性���。研究表明,不同細胞毒性評價法對不同生物材料的敏感程度不同���,原因可能在于不同的化學(xué)物質(zhì)其毒理作用機制不同�����,而立足于不同生物學(xué)終點的評價方法顯示出了不同的敏感度���。
2005 年 Weyermann 等對噻唑藍比色法(MTT法)����、乳酸脫氫酶釋放法(LDH法)和中性紅攝取試驗(NUR試驗)三種試驗方法進行了比較�, 并研究其毒性機制,結(jié)果發(fā)現(xiàn) LDH 試驗對于細胞膜完整性的破壞較敏感�����,而對于影響細胞內(nèi)活動的一些毒性物質(zhì)反應(yīng)不敏感�;MTT 試驗法主要對影響線粒體酶活性的毒性反 應(yīng)敏感,對于溶酶體破壞相關(guān)的細胞毒性�,NUR 檢測靈敏 度較高。因此在選擇試驗方法時����,必須根據(jù)“最接近應(yīng)用狀況”的原則,合理地選擇樣品與細胞的接觸方式和檢測生物學(xué)終點的評價指標(biāo)或評價方法�����。
綜合運用分子水平評價方法�,闡明材料對細胞的作用機制,全面地評價生物材料對細胞的毒性作用,將是生物材料細胞生物相容性評價的發(fā)展方向�。
2.2.4 新型醫(yī)用高分子材料在醫(yī)療器械方面的應(yīng)用
常用的醫(yī)用高分子材料,包括用于植入人體的高分子材料:人造器官如人工心臟�、人工血管等;用于治療的高分子材料�����,如牙科����、眼科、美容材料以及外用治療的高分子材料���。
隨著對生物材料的生物相容性的研究逐漸深入����,越來越多的新型生物材料進入了大家的視野�����。
在有機高分子材料方面��,水凝膠作為在水中既能溶脹而又不溶于水的一類親水性高分子材料���,它含水量高�����,柔軟性好�����,對小分子滲透能力強�����,因此對周圍組織的整合性好���,比其他類型的合成材料更宜用作生物醫(yī)用材料使用。
聚乙烯醇是自然界中唯一的水溶性高分子聚合物����,其親水性好、來源豐富���、價格低廉�。通過物理���、化學(xué)�、輻照等方式可將聚乙烯醇交聯(lián)制成具有優(yōu)良吸水溶脹性、生物降解性和穩(wěn)定性的水凝膠材料����,在軟骨、角膜��、髓核���、皮膚等組織的移植替換和修復(fù)重建中具有廣闊的應(yīng)用前景�����。
另外����,生物材料的血液相容性是指生物材料表面抑制血管內(nèi)血液形成血栓的能力和生物材料對血液的溶血現(xiàn)象�、血小板功能降低、白細胞暫時性減少���、功能下降以及補體激活等血液生理功能的影響�����。
有文章研究顯示聚酯類抗凝血生物材料和鈦類抗凝血生物材料溶血率低���,血小板黏附少,纖維蛋白原吸附少�,動態(tài)凝血時間和復(fù)鈣時間均延長,具有良好的血液相容性�,是目前較為理想的抗凝血生物材料。
綜上所述����,生物材料其未來發(fā)展可概括為四個方面:
一是生物可降解高分子材料的應(yīng)用前景更加廣闊,醫(yī)用可生物降解高分子材料因其具有良好的生物降解性和生物相容性而受到高度重視���,無論是作為緩釋藥物還是作為促進組織生長的骨架材料����,都將得到巨大的發(fā)展���。
二是復(fù)制具有人體各部天然組織的物理力學(xué)性質(zhì)和生物學(xué)性質(zhì)的生物醫(yī)用材料�����,達到高分子的生物功能化和生物智能化�,是醫(yī)用高分子材料發(fā)展的重要方向。
三是人工代用器官在材料本體及表面結(jié)構(gòu)的有序化���、復(fù)合化方面將取得長足進步��, 以達到與人體相似的結(jié)構(gòu)和功能�����,其生物相容性也將明顯提高�����。
四是藥用高分子和醫(yī)藥包裝用高分子材料的應(yīng)用將會繼續(xù)擴大�。
3����、無源醫(yī)療器械材料生物性研究的現(xiàn)狀及展望
3.1 目前無源醫(yī)療器械的種類
醫(yī)療器械,是指直接或者間接用于人體的儀器��、設(shè)備�����、器具��、體外診斷試劑及校準物、材料以及其他類似或者相 關(guān)的物品�,包括所需要的計算機軟件;其效用主要通過物理等方式獲得���,不是通過藥理學(xué)、免疫學(xué)或者代謝的方式獲得�,或者雖然有這些方式參與但是只起輔助作用。
其目的是:
(1)疾病的診斷�����、預(yù)防����、監(jiān)護、治療或者緩解�����;
(2)損傷的診斷����、監(jiān)護、治療�����、緩解或者功能補償;
(3)生理結(jié)構(gòu) 或者生理過程的檢驗�����、替代�、調(diào)節(jié)或者支持;
(4)生命的支持或者維持�����;
(5)妊娠控制�����;
(6)通過對來自人體的樣本進行檢查���,為醫(yī)療或者診斷目的提供信息����。
醫(yī)療器械相對于藥品而言�,種類更為繁多,成分更為復(fù)雜�,既包括人工合成的高分子材料���,又包括天然高分子 材料、無機材料�、金屬材料和動物源性組織工程材料等。
醫(yī)療器械的根據(jù)其結(jié)構(gòu)特征分為:有源醫(yī)療器械和無源醫(yī)療器械�。
其中,無源器械的使用形式有:藥液輸送保存器械����;改變血液�����、體液器械�����;醫(yī)用敷料�����;外科器械���;重復(fù)使用外科器械�;一次性無菌器械;植入器械���;避孕和計劃生育器械��;消毒清潔器械���;護理器械、體外診斷試劑���、其他無源接觸 或無源輔助器械等�����。
3.2 無源醫(yī)療器械生物相容性研究的依據(jù)���、項目
通過評價什么項目,才能反映出材料的生物相容性問題�����,是一個比較復(fù)雜的系統(tǒng)工程�����。國內(nèi)外都制定了許多方法和評價標(biāo)準,如ISO 10993 系列國際標(biāo)準��、我國GB/T 16886 系列標(biāo)準等�����。其主要精神是觀察研究材料植入體內(nèi)長期���、短期與機體組織�����、細胞、血液相接觸后所引起的各種不同的機體反應(yīng)���。
3.3 無源醫(yī)療器械生物相容性研究的現(xiàn)狀
無源醫(yī)療器械由于種類多�����,范圍廣����,其生物相容性的研究一直在飛速地進步中。
在高分子材料方面�����,一次性注射器已廣泛應(yīng)用于醫(yī)療機構(gòu)�,其質(zhì)量的好壞與人民群眾的生命安全息息相關(guān)。一次性使用注射器屬于體外與體內(nèi)相接觸中���,間接與血液接觸類器械��,作用時間為A類(<24 h)(表1)���。
表 1 醫(yī)院器械生物學(xué)評價項目
研究結(jié)果表明,一次性使用注射器具有一定的細胞毒性��;急性全身毒性試驗���、皮內(nèi)反應(yīng)試驗和遲發(fā)型超敏反應(yīng)試驗未見異常�。
醫(yī)用硅橡膠在生命科學(xué)����、醫(yī)療器械、藥物等領(lǐng)域中已得到廣泛而重要的應(yīng)用�,但還有巨大潛力可挖,隨著生命科學(xué)的發(fā)展及生物材料的研究,它將為人類社會做出更大的貢獻��。生物紙是一種新型的交聯(lián)多糖類生物材料���,通過按國家標(biāo)準 GB/T 16886 醫(yī)療器械生物學(xué)評價系列標(biāo)準進行了全面的生物學(xué)評價�,證明材料具有良好的生物相容性����。
聚乳酸 (polylactide,PLA)及其共聚物是一類可生物降解的高分子材料���,具有優(yōu)良的力學(xué)性能���、化學(xué)穩(wěn)定性,吸收度及強度高�,其在生物體內(nèi)的降解產(chǎn)物乳酸可參與到新陳代謝中, 最終生成二氧化碳和水排出體外�。參照我國醫(yī)療器械生物學(xué)評價標(biāo)準(GB/T 16886)的要求���,從致熱原�����、細胞毒性�����、溶血�����、急性全身毒性��、皮內(nèi)反應(yīng)���、致敏反應(yīng)���、皮下植入試驗、遺 傳毒性和亞慢性全身毒性等方面對制備的可降解材料聚乳酸進行了生物安全性評價����,結(jié)果證明該聚乳酸材料具有良好的生物相容性和生物安全性,可作為醫(yī)用材料使用����。
近年來已被廣泛應(yīng)用于緩釋藥物載體、外科手術(shù)縫合線��、骨科內(nèi)固定板、骨釘�、組織防粘連材料、組織工程細胞支架等�����,在抗腫瘤�����、骨缺損修復(fù)及眼部疾病治療等領(lǐng)域發(fā)揮著不可替代的作用�����。生物可吸收性植入物的出現(xiàn)及其在微創(chuàng)外科方面的廣泛應(yīng)用��,在過去幾十年中極大地改善了醫(yī)療衛(wèi)生診治水平�����。一種新型材料:生物可吸收性形狀記憶聚合物(BSMP)生物相容性良好���,體內(nèi)降解速率穩(wěn)定����,是一種良好的聚合材料�����。
3.4 對無源醫(yī)療器械生物相容性研究的展望
當(dāng)然�����,隨著社會的進步和科技的發(fā)展���,生物相容性的評價方法也在不斷完善中���。目前一種新的致熱原檢測方法正 在被學(xué)者研究,即細胞檢測法���,該方法主要以人源細胞在體外進行致熱原檢測 , 其原理為致熱原物質(zhì)能引起人源細胞釋放一些與發(fā)熱反應(yīng)有關(guān)的細胞因子 , 通過免疫化學(xué)方法定量檢測這些因子的含量來反映其致熱原的反應(yīng)情況��,其優(yōu)點是在不使用動物的情況下能夠達到家兔法的檢測效果�。
該方法操作簡便���、穩(wěn)定可靠�,有望成為替代現(xiàn)行熱原檢測方法的一種可以進行定量半定量檢測的方法����。因此���,用細胞來替代動物進行熱原試驗將成為今后的發(fā)展趨勢。
總之����,隨著科學(xué)技術(shù)的發(fā)展,特別是材料科學(xué)與生命科學(xué)的發(fā)展加快了醫(yī)療器械新產(chǎn)品研制���,隨之對醫(yī)療器械生物學(xué)評價提出新的課題�。關(guān)鍵是要科學(xué)地總結(jié)�、提高,正確地應(yīng)用 IS0 10993 系列標(biāo)準����,把握醫(yī)療器械的風(fēng)險,保證器械使用的安全有效���。
4����、浸提條件對無源醫(yī)療器械生物相容性影響的研究現(xiàn)狀
醫(yī)療器械生物學(xué)試驗中樣品制備是生物學(xué)試驗的第一步����,是生物學(xué)試驗成功開展的前提,是確保生物學(xué)實驗結(jié)果真實可靠的保證�����。
醫(yī)療器械生物學(xué)評價系列標(biāo)準 GB/T 16886.12 對樣品制備條件進行了推薦���,在生物學(xué)試驗中常需要使用樣品浸提液進行試驗�,即將試驗樣品浸入適宜的介質(zhì)中��,在一定的條件下進行浸提��,然后使用浸提液進行一系列的生物學(xué)試驗���,其目的在于檢測醫(yī)療器械可溶出物可能導(dǎo)致的生物學(xué)反應(yīng)��,以評價產(chǎn)品可能對病人或使用者的潛在危害���。
生物學(xué)評價系列標(biāo)準GB/T 16886-12對浸提法原理進行了說明, 并對浸提容器�����、浸提介質(zhì)、浸提條件和方法等均進行了推薦���。
此方法主要參考藥包材的浸提方法���,但由于醫(yī)療器械的材料、預(yù)期用途����、使用方法等與藥包材有很大區(qū)別,加上醫(yī)療器械本身的多樣性����,試驗人員應(yīng)該根據(jù)樣品的物理化學(xué)特性等選擇更加合理的浸提條件和方法。
在鄒文等中指出�,高分子聚合物經(jīng)浸提后3種材料為疑似反應(yīng),經(jīng)再次激發(fā)后確認2種為無超敏反應(yīng)��,1種為弱致敏物�。而其他生物醫(yī)用材料如金屬及合金、陶瓷���、生物修復(fù)材料等均無超敏反應(yīng)�,且在 121 ℃,1 h浸提條件下進行試驗 的生物醫(yī)用材料占80.4%�。我們是否可以認為高分子聚合物在同等的浸提條件下更易產(chǎn)生超敏反應(yīng)。同時我們也會產(chǎn)生疑問��,這種浸提條件的選擇是否為最佳的�����,其他生物醫(yī)用材料的浸提條件是否能夠完全反應(yīng)出該材料的生物相容性�����?
同時�����,在一次性使用注射器的生物相容性研究中發(fā)現(xiàn)�����,高溫對這一類材料有一定影響�����。在制作浸提液的過程中����,所用浸提介質(zhì)和浸提條件應(yīng)與最終產(chǎn)品的特性和使用以及使用目的相適應(yīng),在選擇浸提條件時應(yīng)考慮器械材料的物理化學(xué)特性��、可溶出物或殘留物。同時,浸提是一個復(fù)雜的過程�,受時間���,溫度�、表面積與體積比��、浸提介質(zhì)以及材料的相平衡的影響�����,要考慮高溫對浸提動力學(xué)及浸提液恒定性的影響����。
體外細胞毒性試驗是目前國內(nèi)外生物學(xué)評價標(biāo)準中重要的一環(huán),是評價直接或間接接觸人體組織和細胞的醫(yī)療器械的通用方法���,目前標(biāo)準推薦的實驗方法有:浸提液試驗���、直接接觸試驗�����、間接接觸試驗��。
浸提液試驗是目前用于檢測醫(yī)療器械的細胞毒性比較廣泛的一種方法���,選擇不同的浸提介質(zhì)可能對試驗結(jié)果有直接的影響。浸提介質(zhì)的選擇對評價產(chǎn)品體外細胞毒性結(jié)果的影響程度以及評價結(jié)果是否存在差異等問題目前尚無相關(guān)文獻報道����。
目前有關(guān)何種浸提條件最合適���,現(xiàn)有生物學(xué)評價是否足夠等問題的研究��,國內(nèi)外均開展得不多�����,可能是由于醫(yī)療器械產(chǎn)品發(fā)展較快�����,醫(yī)療器械生物學(xué)評價體系的建立相對較晚�����,加上醫(yī)療器械的多樣性�����,醫(yī)療器械材料種類眾多����,物理化學(xué)性能相差很大,如果一一進行研究�,時間成本和經(jīng)濟成本均太高。隨著醫(yī)療器械監(jiān)督管理的發(fā)展��,這種矛盾日益顯露����。因此通過研究浸提條件的改變對無源醫(yī)療器械,特別是以高分子材料為原料的無源醫(yī)療器械的部分生物相容性項目的影響�,可以有效地完善我國對無源醫(yī)療器械材料的生物相容性。
生物相容性評價的主要目標(biāo)
根據(jù)ISO 10993-1:2018的定義�,生物相容性是指醫(yī)療器械或材料在一個特定應(yīng)用中引起恰當(dāng)宿主反應(yīng)的能力。“生物相容”與“生物不相容”不是某種材料天然的或絕對的“標(biāo)簽”�����,而是需要結(jié)合材料的具體性能和特定的(臨床)應(yīng)用場景進行判斷。同時��,生物相容性是一個動態(tài)概念�����,植入物植入人體后會對特定生物組織環(huán)境產(chǎn)生物理和化學(xué)影響�����,引起生物學(xué)反應(yīng)��;反之���,生物組織也會對植入物產(chǎn)生影響���,使之發(fā)生物理或化學(xué)變化�����,兩者的相互作用會一直持續(xù)���。即使植入物被完全去除或被人體完全吸收����,其影響還將持續(xù)一段時間。
除了醫(yī)療器械獨有的評價方式�����,如細胞毒性���、植入后局部反應(yīng)�、血液相容性�、生物降解等,醫(yī)療器械生物相容性評價方法大多由化學(xué)品或藥物毒理學(xué)試驗方法發(fā)展而來�����,但醫(yī)療器械生物相容性評價與化學(xué)品或藥物毒理學(xué)評價的目標(biāo)有較大區(qū)別�。化學(xué)品或藥品的毒性大多來自主要成分或有效成分���,而多數(shù)醫(yī)療器械的主要組成材料本身是相對惰性的�����,引起生物學(xué)反應(yīng)的物質(zhì)往往是由原材料或由醫(yī)療器械生產(chǎn)過程引入的雜質(zhì)���、添加劑��、化學(xué)助劑��、污染物���,醫(yī)療器械在儲存或使用期間的降解產(chǎn)物(包括物理磨損、化學(xué)分解���、腐蝕或生物代謝產(chǎn)生的小分子物質(zhì)或細微顆粒等)�,以及上述物質(zhì)的交叉反應(yīng)產(chǎn)物��。因此�,醫(yī)療器械生物相容性評價的主要目的是評價這些小分子物質(zhì)造成的影響,而不僅僅是材料本身����。
需要注意的是,有些醫(yī)療器械�����,如以協(xié)助組織重塑和再生為目的的可吸收性植入性醫(yī)療器械�,其生物相容性評價不僅針對上述小分子物質(zhì)或降解產(chǎn)物,還包括其能否提供適合宿主細胞黏附��、遷移���、生長��、分化的微環(huán)境�����,這是生物相容性概念的拓展����。這里的“生物相容”與醫(yī)療器械的微結(jié)構(gòu)���、降解動力學(xué)���、生物力學(xué)性能、表面理化性能以及微量化學(xué)物質(zhì)釋放等密切相關(guān)����。
生物相容性評價方式
風(fēng)險管理是保證醫(yī)療器械安全的一項重要質(zhì)量管理活動,貫穿于醫(yī)療器械從設(shè)計開發(fā)到臨床應(yīng)用的全生命周期�����。生物相容性風(fēng)險作為醫(yī)療器械風(fēng)險管理的一個重要方面,也貫穿于產(chǎn)品全生命周期���。
在醫(yī)療器械早期研發(fā)階段�,生物相容性評價主要針對原材料�����、生產(chǎn)工藝參數(shù)�、加工助劑的篩選。對于醫(yī)療器械原材料的選擇��,主要考慮其是否滿足醫(yī)療器械的設(shè)計輸入���。原材料種類一旦選定�,則需要確認外購原材料級別或者自制原材料質(zhì)量是否適用于生產(chǎn)預(yù)期設(shè)計的醫(yī)療器械�����。目前����,對于“醫(yī)用級”材料或“植入級”材料尚無確切定義,有的材料供應(yīng)商對其材料有相應(yīng)級別區(qū)分�����,以用作不同用途����。醫(yī)療器械制造商在選擇材料時需考慮供應(yīng)商給出的建議,在篩選不同材料或材料級別時�,可以運用生物相容性評價方式。此階段的生物相容性評價需結(jié)合所能收集到的各種材料信息�����,如供應(yīng)商提供的材料安全數(shù)據(jù)單(MSDS)���、主文檔(MAF)登記信息����、材料在已上市醫(yī)療器械中的應(yīng)用史等���,但這些信息對于材料的篩選可能并不充分�����,還需通過化學(xué)表征對原材料雜質(zhì)進行分析�����,或者開展一些短期的體外生物學(xué)試驗����。對于不同種類的加工助劑,不僅需要考慮功能性�,還要考慮是否引入了毒性物質(zhì),以及毒性物質(zhì)是否容易在后續(xù)工序中去除����。此外,在對加工助劑殘留量可接受性的確認中也會用到生物相容性評價方法����,一般采用對殘留助劑的化學(xué)表征和毒理學(xué)評價相結(jié)合的方式。
對于已設(shè)計定型并在完善的質(zhì)量管理體系下生產(chǎn)的醫(yī)療器械終產(chǎn)品����,若預(yù)期與人體直接或間接接觸,則在進行人體臨床應(yīng)用或臨床試驗之前�����,需對其進行充分、完整的生物相容性評價��。終產(chǎn)品的生物相容性評價需要首先了解產(chǎn)品相關(guān)的化學(xué)組成�,如原材料��、加工助劑�����、工藝中可能引入的污染物�����、可能生成的材料降解產(chǎn)物等��,甚至需要考慮原材料制造過程引入的雜質(zhì)(可以從原材料供應(yīng)商處獲取相關(guān)信息)�。在此基礎(chǔ)上,還可對終產(chǎn)品進行材料表征和可瀝濾物分析�����,以進一步驗證其組成成分和雜質(zhì)水平����。建立在對產(chǎn)品化學(xué)組成和雜質(zhì)水平充分了解基礎(chǔ)上的生物相容性評價才更加可靠���。
生物相容性評價的結(jié)果是否可以接受,不能單獨依據(jù)生物學(xué)試驗的數(shù)據(jù)討論�����。醫(yī)療器械生物相容性是否可接受是基于對終產(chǎn)品的受益和風(fēng)險進行綜合分析判斷的��,需結(jié)合醫(yī)療器械各項非臨床和臨床研究數(shù)據(jù)��,以及相關(guān)產(chǎn)品的臨床應(yīng)用信息���。需要注意的是�,不是所有生物學(xué)反應(yīng)都是不良的或不期望的�����,有些反應(yīng)是材料或其降解產(chǎn)物結(jié)合特定物理作用(如生物力學(xué)作用)激發(fā)宿主作出的適當(dāng)應(yīng)答���。
醫(yī)療器械生物相容性評價貫穿于產(chǎn)品全生命周期��,產(chǎn)品上市后仍需持續(xù)關(guān)注其生物相容性�。例如,產(chǎn)品在運輸��、儲存過程中的變化是否引起其生物相容性的改變�����;持久植入的醫(yī)療器械�����,其遠期生物相容性信息如何在上市后評價中收集����;原材料和加工助劑的來源和技術(shù)條件���、產(chǎn)品配方�、生產(chǎn)工藝����、初包裝、滅菌����、適用范圍等的變化是否引入新的生物學(xué)風(fēng)險�����,如果引入則需補充進行生物相容性評價�。
生物相容性評價歷史和趨勢
國際上���,美國材料與試驗協(xié)會(ASTM)與國際標(biāo)準化組織第194技術(shù)委員會(ISO/TC 194)對生物相容性評價的方法一直在更新����。ISO/ TC 194自1989年成立以來�,相繼制定了ISO 10993《醫(yī)療器械生物學(xué)評價》系列標(biāo)準。同時���,很多國家和地區(qū)在國際標(biāo)準基礎(chǔ)上提出了自己的評價方式��,如美國食品藥品管理局(FDA)于2020年9月更新發(fā)布了關(guān)于如何使用I SO 10993的指導(dǎo)原則��。該指導(dǎo)原則是美國醫(yī)療器械行業(yè)和FDA工作人員關(guān)于醫(yī)療器械生物相容性評價的指南性文件�����,相較I SO 10993納入了一些新內(nèi)容�,包括如何基于風(fēng)險分析方法確定是否需要進行生物學(xué)試驗��,以及關(guān)于化學(xué)表征的建議和關(guān)于亞微米或納米材料、原位聚合材料�、可吸收材料生物相容性評價的特殊考慮等。
我國從20世紀70年代后期開始研究生物材料和醫(yī)療器械生物相容性評價�,先后制定了有機硅材料、醫(yī)用輸注器具和口腔材料生物相容性評價試驗方法標(biāo)準�����,并于1997年開始將ISO 10993系列標(biāo)準轉(zhuǎn)化為GB/T 16886系列標(biāo)準��。2014年以來�����,隨著醫(yī)療器械注冊相關(guān)法規(guī)的更新����,醫(yī)療器械生物相容性評價工作模式也發(fā)生了變化��,相關(guān)注冊申報資料由注冊檢驗形式轉(zhuǎn)變?yōu)橐匝芯抠Y料形式提供詳細的生物學(xué)評價報告(生物學(xué)試驗報告作為其附件)�����,提高了審評的充分性和科學(xué)性���,且在對符合良好實驗室規(guī)范(GLP)的國外實驗室出具的生物學(xué)試驗數(shù)據(jù)接受性上保持了與國際接軌���。但目前我國醫(yī)療器械生物相容性評價仍存在一些問題���,如部分企業(yè)未形成基于風(fēng)險評定的理念、生物相容性評價較依賴于試驗等���。因此�����,建議我國建立醫(yī)療器械生物相容性評價指導(dǎo)原則體系�����,以指導(dǎo)生物相容性評價的科學(xué)開展��。
隨著醫(yī)療器械產(chǎn)業(yè)的迅速發(fā)展���,創(chuàng)新醫(yī)療器械不斷涌現(xiàn),現(xiàn)行標(biāo)準中的常規(guī)生物學(xué)試驗方法不能完全滿足對新材料�、新技術(shù)、新工藝的創(chuàng)新產(chǎn)品進行充分、科學(xué)生物相容性評價的需求��。尤其是對于持久植入和具有介導(dǎo)組織再生功能的醫(yī)療器械�,其潛在遠期生物學(xué)風(fēng)險需要得到更充分的評估,在分子水平上進一步研究生物學(xué)反應(yīng)的關(guān)鍵因素和機理�����,開發(fā)可在產(chǎn)品生命周期早期發(fā)現(xiàn)和減輕其潛在生物相容性危害的具有高度靈敏性�����、特異性的生物相容性測試方法���、標(biāo)記物以及更先進的生物相容性評價工具����。這些新方法和新工具可以對傳統(tǒng)生物學(xué)評價方式進行補充����,甚至有望代替一些耗時����、耗力、犧牲動物的生物學(xué)試驗方法��,其開發(fā)有賴于大力開展醫(yī)療器械監(jiān)管科學(xué)研究。
2017年�����,美國FDA器械與放射健康中心(CDRH)把“醫(yī)療器械生物相容性和生物風(fēng)險評估的現(xiàn)代化”列為“監(jiān)管科學(xué)十大優(yōu)先項目”的第二項�����,進一步研究通過化學(xué)表征����、計算機建模、風(fēng)險評估獲取綜合性證據(jù)�。2021年3月,美國FDA更新了其監(jiān)管科學(xué)行動計劃����,生物相容性和毒理學(xué)研究仍是重要研究內(nèi)容之一,以解決生物學(xué)風(fēng)險評估準確性���、化學(xué)表征方法可靠性和標(biāo)準化����、長期生物學(xué)試驗替代以及創(chuàng)新醫(yī)療器械生物學(xué)風(fēng)險提前預(yù)測等問題。我國也需要以監(jiān)管科學(xué)研究方式���,進一步研究和開發(fā)生物相容性評價的科學(xué)工具�����、方法和途徑�����,使醫(yī)療器械生物相容性相關(guān)審評����、監(jiān)管工作更加科學(xué)���,提高審評和監(jiān)管效能�����,加快推動創(chuàng)新產(chǎn)品上市和臨床應(yīng)用����,降低醫(yī)療成本����,使患者受益