藥物非臨床研究是為評價藥品安全性���,在實驗室條件下���,用實驗系統(tǒng)進行的各種毒性試驗�����,包括單次給藥的毒性試驗�����、反復給藥的毒性試驗�����、生殖毒性試驗��、遺傳毒性試驗���、致癌試驗��、局部毒性試驗���、免疫原性試驗等。該研究是藥物研發(fā)的基礎工作�����,也是臨床試驗的重要基礎數(shù)據(jù)�����,被認為是人體試驗前的最后一道防線��。
據(jù)國家藥品監(jiān)督管理局食品藥品審核查驗中心(CFDI)發(fā)布的《2021年度藥品檢查工作報告》顯示,2021年GLP認證檢查任務38個�����,不通過的任務1個��。GLP認證檢查發(fā)現(xiàn)的主要問題包括:質(zhì)量保證部門履職能力不足�����;機構負責人資質(zhì)不符合要求��;實驗動物設施設計與管理不到位�����;室驗環(huán)節(jié)未能嚴格執(zhí)行操作規(guī)程��;計算機賬戶權限分級設置不合理等�����。國內(nèi)企業(yè)在藥物研發(fā)中�����,往往會忽略臨床前研發(fā)中的質(zhì)量管理��,下面本文就著重闡述一下藥物臨床前研發(fā)階段質(zhì)量管理體系的搭建所包含的內(nèi)容�����。
一��、臨床前質(zhì)量管理體系方面的法規(guī)
藥品臨床前研究質(zhì)量管理涉及的法規(guī)政策主要包括《中華人民共和國藥品管理法》《藥品注冊現(xiàn)場核查管理規(guī)定》《藥品生產(chǎn)質(zhì)量管理規(guī)范》(GMP)《藥物非臨床研究質(zhì)量管理規(guī)范》(GLP)這4個���。
其中���,只有GLP是專門針對臨床前研發(fā)質(zhì)量管理的,更具體的說�����,GLP更多關注安全評價實驗室的研發(fā)質(zhì)量管理�����。GLP是藥物非臨床研究的質(zhì)量管理和保證體系���。2006年��,我國《藥物非臨床研究質(zhì)量管理規(guī)范》正式實施���,2017年進行了修訂�����。
GLP適用于為申請藥品注冊而進行的藥物非臨床安全性評價研究��,并要求以注冊為目的的其他藥物臨床前相關研究活動參照該規(guī)范執(zhí)行��,關注組織機構和人員��、設施���、儀器設備和實驗材料、實驗系統(tǒng)��、標準操作規(guī)程��、研究工作的實施���、質(zhì)量保證及資料檔案等方面的行為規(guī)范和數(shù)據(jù)的真實���、準確、完整��。
二�����、臨床前質(zhì)量管理體系的建立
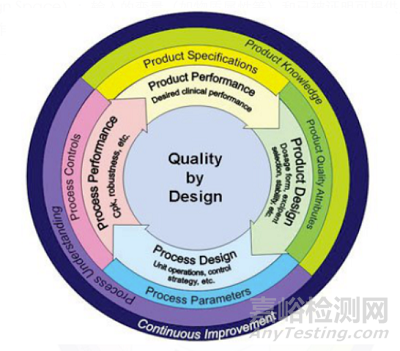
1��、風險控制理念
風險控制理念應貫穿藥品研發(fā)全程��,采用以質(zhì)量源于設計(QbD)的理念進行系統(tǒng)研究設計和風險評估��。如在藥學研究階段的風險評估連接了物料屬性�����、 工藝參數(shù)和藥品關鍵質(zhì)量屬性��,有助于實施QbD的研究設計�����,進而保證后續(xù)連續(xù)穩(wěn)定地生產(chǎn)出合格產(chǎn)品���。
圖1:質(zhì)量源于設計QbD(來源:網(wǎng)絡)
2���、組織機構和人員
(1)有明確的崗位職責�����,由指定具備資格的人員擔任�����,并設立獨立的臨床前研發(fā)質(zhì)量管理歸口部門或?qū)T���,提供包含人員、場地��、儀器在內(nèi)的基礎設施��,負責企業(yè)內(nèi)部臨床前研發(fā)質(zhì)量管理體系編制及質(zhì)量核查工作���,以此避免人員分工和權限上的交叉���。
(2)加強科研人員質(zhì)量體系培訓。為避免科研人員難以識別藥品研發(fā)過程中存在的質(zhì)量風險�����,應加強對其的質(zhì)量體系培訓。培訓包括但不限于入職培訓�����、崗前培訓和在職員工的持續(xù)培訓��,培訓類目包含但不限于基礎培訓�����、文件管理�����、項目管理�����、儀器設備管理��、物料管理��、質(zhì)量管理���、法律法規(guī)知識等��。
3�����、研究場所和儀器設備
實驗場所需保證環(huán)境條件滿足所開展研究項目的要求��,如溫濕度���、日常物料儲存/轉(zhuǎn)運、空間隔離��、安全措施�����、危廢處置等條件���。并注意設置日常出入清潔標準��,避免(交叉)污染���。
儀器設備要進行分類管理��,并建立可操作性的標準操作規(guī)范(SOP)�����,包括對相應的檢定或校準�����、驗證、維護�����、清潔工作進行規(guī)定���,專設負責人對設備的運行和日常維護進行監(jiān)督���,保障設備的正常運行。
全面規(guī)范化的設備檔案管理涵蓋設備購買到淘汰的全過程�����,其包括使用��、維護、借出�����、維修等各個環(huán)節(jié)�����,旨在確保研究活動的可追溯性��。另外�����,檔案保管設施應設有接觸權限�����、有效控制并監(jiān)測各種危害因素�����。電子檔案存儲的組件應確保電子檔案訪問和存儲安全���。
4��、實驗系統(tǒng)和實驗材料
實驗系統(tǒng)包括GLP中的動物���、植物�����、微生物 以及器官���、組織、細胞���、基因等;實驗材料包括廣泛的樣品或受試品���、對照品��、對照制劑及其他物料等��。這兩者統(tǒng)稱物料��。
對于物料���,需要指定專人進行保管并記錄使用情況��。管理內(nèi)容主要包括管理相關的資料信息�����、保證標簽準確清晰��、保證儲存條件�����、保證各種過程中的穩(wěn)定以及足夠的留樣量���。對于試制樣品、對照品�����、對照制劑��、受試品等關鍵物料���,其保存期限應保證審評的需要���。
如在藥理毒理研究的實驗動物管理中���,應注重動物福利、健康狀況�����、所處環(huán)境衛(wèi)生及營養(yǎng)狀態(tài)等方面�����。這些因素應被詳細記錄并妥善歸檔���,以確保實驗系統(tǒng)的質(zhì)量與適用性��。
5�����、確認與驗證
確認或驗證的目的是確保藥品生產(chǎn)關鍵要素可控,以保證持續(xù)產(chǎn)出符合要求的產(chǎn)品�����。如一般廠房��、設施、設備和儀器需確認���,生產(chǎn)工藝��、操作規(guī)程�����、檢驗方法和清潔方法則需保持持續(xù)驗證狀態(tài)�����。具體內(nèi)容要經(jīng)過風險評估來確定�����。
6���、文件及檔案
檔案管理基本包括體系文件、原始記錄�����、各種設備記錄、臺賬��、項目資料�����、試驗異?����;蚴∮涗?�、實驗變更記錄�����、研發(fā)相關文獻��、支持申報材料等��。
文件是體系完善和有效落實的依據(jù)�����,是質(zhì)量管理體系的核心。文件分為3個層次,依次為質(zhì)量手冊�����;管理標準(SMP)���、技術標準(STP)��、操作標準(SOP)��;記錄類��。原始記錄是指實驗數(shù)據(jù)��、文字�����、聲像等原始資料���,需格式統(tǒng)一、編號唯一���,確保真實���、準確���、完整。
對于臨床前研發(fā)階段的檔案�����,應按重要性分級并由不同職級人員負責管理保存��。
7�����、質(zhì)量管理
質(zhì)量管理包括質(zhì)量保證���、質(zhì)量控制�����、數(shù)據(jù)完整性��、偏差管理和變更管理���。
質(zhì)量保證被認為是貫徹執(zhí)行GLP精神��、確保研究質(zhì)量的關鍵環(huán)節(jié)。其一般通過質(zhì)量審計的形式體現(xiàn)���,在日常中的具體活動為研發(fā)記錄���、方案和報告的審計;體系運行過程中研究人員對問題的反饋���;質(zhì)管人員的審查評估��。
質(zhì)量控制在藥學生產(chǎn)階段屬歷年現(xiàn)場檢查缺陷的高發(fā)項��,其特殊項主要包括取樣人員需經(jīng)授權�����;檢驗方法需經(jīng)驗證或確認�����;所有的檢查檢驗標準都必須經(jīng)過批準;檢驗記錄應包含依據(jù)的質(zhì)量標準和檢驗操作規(guī)程��;完整規(guī)范的留樣管理等。
數(shù)據(jù)完整性目前主要需注意規(guī)范性問題�����,如數(shù)據(jù)與記錄無缺失�����、有效控制操作系統(tǒng)與軟件管理��、計算機系統(tǒng)管理等�����?����?蓮闹贫ㄟm宜的數(shù)據(jù)管理規(guī)定及對相關人員進行定期��、循環(huán)培訓考核這兩方面著手��。
偏差管理的形式和要求依據(jù)研發(fā)階段和性質(zhì)的不同而不同��,如若在研發(fā)初期則簡單記錄異常即可���,若在研發(fā)后期則需走偏差處理單。另外�����,只要涉及數(shù)據(jù)可靠性的偏差��,就需特別關注��。
變更管理:據(jù)GMP指南建議,在早期開發(fā)階段���,在QTPP不發(fā)生變更的情況下�����,任何實驗的變更無需啟動變更控制規(guī)程�����,只需要記錄在實驗本上即可��。建議按照項目管理的方式實施管理�����。若QTPP發(fā)生變更�����,參照項目管理的方式應組織相關人員進行評估���。臨床前試驗方案 變更需遵循GLP法規(guī)。
圖1:藥品研發(fā)階段的質(zhì)量系統(tǒng)建立建議(來源:藥品GMP指南�����,第二版)
8��、工作實施
藥學生產(chǎn)中的工作實施部分為“生產(chǎn)管理” 的內(nèi)容���,不同于其他實驗室的方案報告���,實施的依據(jù)是批準的規(guī)程文件和記錄模板,并完全執(zhí)行�����,一旦出現(xiàn)偏差,應進行全面的調(diào)查評估���;生產(chǎn)管理中注重對清潔的要求��,防止污染�����。
總結(jié):隨著藥物研發(fā)監(jiān)管的不斷發(fā)展成熟���,臨床前研發(fā)階段的質(zhì)量管理必將成為國家藥監(jiān)局未來法律法規(guī)體系完善的一個重點���。而建立完善的質(zhì)量管理體系�����,是企業(yè)在開展研發(fā)生產(chǎn)質(zhì)量管理工作中最重要的一點。藥品研發(fā)企業(yè)提前在此進行規(guī)劃部署��,有利于規(guī)避合規(guī)風險���,保障藥物質(zhì)量��,提升藥物注冊申報成功率�����,促進企業(yè)的長遠發(fā)展�����。
參考資料:
[1]陳一飛,唐黎明,李剛.中國藥物非臨床安全性評價研究機構現(xiàn)場檢查類型與常見問題討論[J].中國醫(yī)藥工業(yè)雜志,2021,52(05):709-713.DOI:10.16522/j.cnki.cjph.2021.05.019.
[2]梅妮,張皖晉,陳一飛.美國FDA發(fā)布的藥物非臨床研究警告信分析[J].中國新藥與臨床雜志,2023,42(06):406-410.DOI:10.14109/j.cnki.xyylc.2023.06.13.
[3]程英,汪飛,黃麗晶等.藥物研發(fā)全過程質(zhì)量管理體系的構建和運行[J].中國藥事,2021,35(06):631-640.DOI:10.16153/j.1002-7777.2021.06.004.
[4]趙靜.淺談新監(jiān)管環(huán)境下藥物研發(fā)的質(zhì)量管理[J].化工管理,2020(02):27-28.
[5]藥物研發(fā)管理第一道防線——創(chuàng)新藥企藥物臨床前研發(fā)質(zhì)量管理體系的建立與完善. 安永EY.2023-06-06.