今日頭條
尚健抗腫瘤1類新藥獲批臨床��。尚健生物1類生物制品注射用SG1827獲國家藥監(jiān)局臨床試驗默示許可����,擬開發(fā)用于治療晚期惡性實體瘤�。SG1827可以在TCR刺激信號存在的情況下,特異性介導共刺激信號����,激活T淋巴細胞。臨床前研究顯示����,SG1827單藥在多種腫瘤模型中顯示出積極抗腫瘤活性;與PD-1抗體等免疫檢查點抑制劑聯用��,協同發(fā)揮抗腫瘤活性����。
國內藥訊
1.強生BCMA/CD3雙抗中國報產。強生旗下楊森BCMA/CD3雙特異性抗體特立妥單抗注射液(teclistamab)的上市申請獲CDE受理����,用于治療復發(fā)或難治性多發(fā)性骨髓瘤(r/rMM)。特立妥單抗旨在將CD3陽性T細胞募集到表達BCMA的骨髓瘤細胞附近�,并且激活T細胞對腫瘤細胞進行攻擊����。去年8月��,該新藥首次獲歐盟批準上市����,用于治療接受至少三種前期療法的r/rMM患者�,成為全球首款BCMA/CD3雙抗�。
2.天境長效生長激素III期臨床成功����。天境生物在2023年H1財報中透露��,該公司引進的新型伊坦生長激素(TJ101,eftansomatropin alfa)在治療兒童生長激素缺乏癥的III期研究達到主要終點����。與Norditropin(諾澤)相比����,TJ101組第52周患者年化身高生長速率(AHV)達到非劣效性(10.76cm/年vs10.28cm/年����,P<0.0001)�。天境生物計劃明年提交伊坦生長激素的上市申請。
3.和黃MET抑制劑擬納入胃癌突破性品種����。和黃醫(yī)藥口服小分子MET-TKI沃利替尼片(savolitinib)獲CDE擬納入突破性治療品種��,用于治療既往至少二線標準治療失敗的MET基因擴增的局部晚期或轉移性胃癌或胃食道連接部腺癌��。savolitinib可阻斷因突變(例如外顯子14跳躍突變或其它點突變)����、基因擴增或蛋白質過表達而導致的MET受體酪氨酸激酶信號通路的異常激活�。此前,該新藥已獲批用于治療MET外顯子14跳躍突變的非小細胞肺癌患者����。
4.石藥CLDN6/CD137雙抗獲批實體瘤臨床。石藥集團旗下公司Novarock開發(fā)的CLDN6/CD137雙抗NBL-028獲FDA批準��,即將開展用于治療CLDN6表達晚期腫瘤患者的臨床試驗��。NBL-028在與TME中的腫瘤細胞表面CLDN6結合的同時��,選擇性地激活T細胞及其他免疫細胞中的CD137共激通路��,從而達到選擇性殺傷腫瘤細胞的作用��。該新藥有望為睪丸癌����、卵巢癌�、非小細胞肺癌及子宮內膜癌等腫瘤患者提供新的治療選擇�。
5.恒瑞上半年創(chuàng)新藥營收50億元����。恒瑞醫(yī)藥公布2023年上半年業(yè)績報告,上半年營收111.68億元��,同比增長9.19%����;歸屬于上市公司股東的凈利潤23.08億元,同比增長8.91%����;研發(fā)投入23.31億元�,同比增長6.73%�。目前,恒瑞醫(yī)藥已有13款自研創(chuàng)新藥��、2款引進創(chuàng)新藥在國內獲批上市��,報告期內公司創(chuàng)新藥收入達到49.62億元(含稅)����。
國際藥訊
1.再生元新一代C5單抗獲批上市。再生元補體因子C5靶向單抗Veopoz(pozelimab)獲FDA批準上市��,成為針對CD55缺陷型蛋白丟失性腸病(CHAPLE)的首款療法。這是一種由編碼CD55蛋白的基因突變而無法調節(jié)補體活動導致的罕見遺傳免疫疾病��。在Ⅱ/Ⅲ期臨床中�,24周治療結果顯示����,100%患者的血清白蛋白快速且持續(xù)恢復正常,且臨床癥狀改善或無惡化�。
2.VMAT2抑制劑獲批治療亨廷頓式病����。Neurocrine公司VMAT2抑制劑Ingrezza(纈苯那嗪,Valbenazine)獲FDA批準新適應癥�,用于治療亨廷頓式病成人患者的舞蹈癥狀�。III期研究結果顯示�,與安慰劑相比��,Valbenazine治療組患者16周時疾病評定量表(UHDRS)最大舞蹈癥(TMC)評分顯著降低(-4.6 vs. -1.4分����;P<0.0001)。2017年4月�,FDA已批準INGREZZA上市��,用于治療遲發(fā)性運動障礙(tardive dyskinesia)����。
3.再生元CD3/CD20雙抗向EMA報MAA�。歐洲藥品管理局(EMA)受理再生元CD3/CD20雙抗odronextamab(REGN1979)上市許可申請(MAA)����,用于治療復發(fā)/難治性濾泡性淋巴瘤(FL)和彌漫性大B細胞淋巴瘤(DLBCL)����。在II期試驗中�,隨訪為17.1個月時��,該新藥在DLBCL患者中ORR和CR分別為53%和37%��;在FL患者中�,odronextamab的ORR和CR分別為82%和75%��。再鼎醫(yī)藥擁有該產品的中國開發(fā)和商業(yè)化權益��。
4.默沙東HIF-2α抑制劑腎癌Ⅲ期臨床積極。默沙東“first-in-class” 缺氧誘導因子-2α(HIF-2α)抑制劑Welireg�,在治療經治晚期腎細胞癌的Ⅲ期臨床LITESPARK-005達到主要終點。與活性對照相比�,Welireg顯著改善患者的無進展生存期(PFS);總生存期(OS)也呈改善趨勢��,但未達到統計學顯著性�。2021年8月,FDA已加速批準Welireg上市����,成為首個HIF-2α抑制劑����,用于治療包括腎細胞癌(RCC)等von Hippel-Lindau(VHL)疾病相關癌癥����。
5.UGT1A1靶向基因療法肝病早期臨床積極�。Généthon實驗室靶向UGT1A1的AAV8基因療法GNT0003治療Crigler-Najjar綜合征的Ⅰ/Ⅱ期臨床結果發(fā)表在《新英格蘭醫(yī)學雜志》上��。Généthon旨在通過一次性治療����,恢復患者的肝臟細胞生成UGT1A1的功能,降低膽紅素的水平��。試驗結果顯示�,最高劑量組的3例患者的血清膽紅素水平顯著下降,且療效可維持長達80周��。此外����,臨床中沒有發(fā)現嚴重副作用��。
6.神經疾病口服腸菌療法獲罕見兒科疾病認定����。Bloom Science公司口服腸道微生物治療產品BL-001獲FDA授予罕見兒科疾病認定,用于治療Dravet綜合征神經疾病�。BL-001旨在復制生酮飲食的抗癲癇作用,調節(jié)γ-氨基丁酸(GABA)和其他關鍵的生物能量途徑��。在Ⅰ期臨床中,BL-001在所有4個劑量組中均表現出良好的安全性和耐受性�,支持比動物模型中的有效劑量水平高出10倍的用藥劑量。
醫(yī)藥熱點
1.2023年國家醫(yī)保目錄調整結果公布�。8月18日,國家醫(yī)保局發(fā)布《關于公示2023年國家基本醫(yī)療保險�、工傷保險和生育保險藥品目錄調整通過初步形式審查的藥品及相關信息的公告》,公示時間為:2023年8月18日-8月24日(一周)�。此輪參與醫(yī)保目錄調整的申報信息共計629份,涉及藥品570個��,申報藥品數目較去年有一定增加����。經初步審查,390個藥品通過初步形式審查��。通過形式審查不等于納入國家醫(yī)保藥品目錄��,后續(xù)還有專家評審�、談判競價��,預計11月公布新版目錄。
2.湖南省鄉(xiāng)村醫(yī)生等級評定試點方案出臺�。近日,湖南省衛(wèi)健委印發(fā)《湖南省鄉(xiāng)村醫(yī)生等級評定試點工作方案》,旨在通過分級評定�、分類保障,績效考核�、安排入編等指標來加強基層人才隊伍建設����,保障鄉(xiāng)村醫(yī)生合理收入。根據《方案》補貼政策:一級村醫(yī)每月補貼不低于800元��;二級村醫(yī)不低于500元����;三級村醫(yī)補貼標準是不低于300元��。
3.中南大學湘雅醫(yī)院揭示二甲雙胍新藥效����。近日,中南大學湘雅醫(yī)院大型研究團隊使用小鼠模型來確定二甲雙胍在骨質疏松和正常骨折愈合中的骨再生潛力的研究論文最新發(fā)表在《Bone Research》上。研究發(fā)現����,在骨折愈合過程中�,二甲雙胍增加了H型血管和骨形成��。其機制可能是二甲雙胍通過抑制內皮細胞YAP1/TAZ����,增加HIF-1α表達�,從而促進體內外血管生成��。
評審動態(tài)
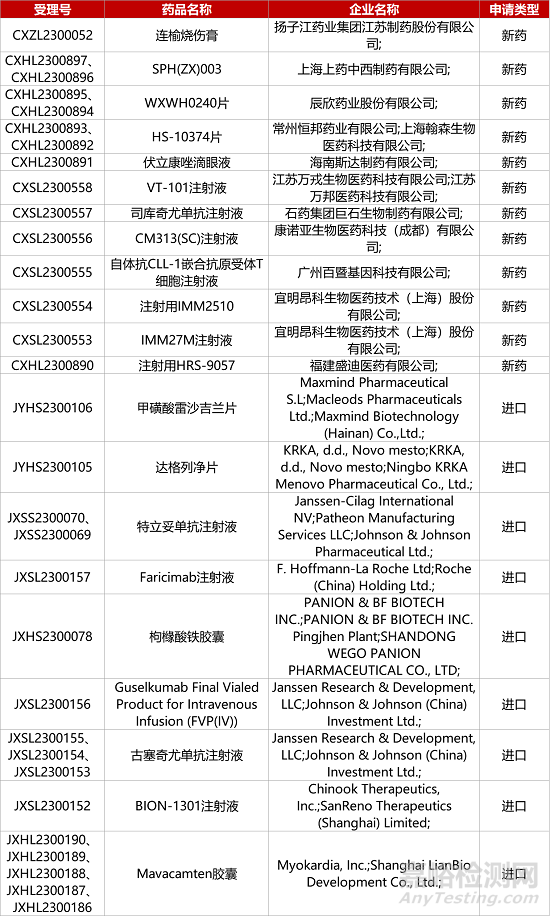
1. CDE新藥受理情況(08月19日)
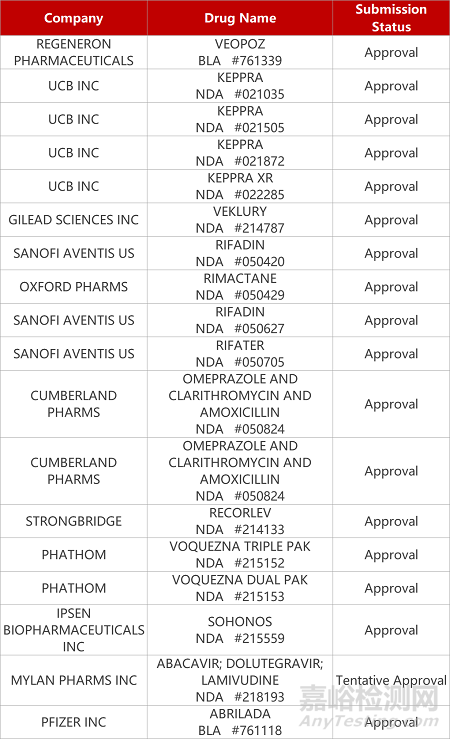
2. FDA新藥獲批情況(北美08月20日)