摘要
通過分析2016—2021年化學(xué)藥改良型新藥的申報審批情況�,從化學(xué)藥改良型新藥的治療領(lǐng)域分布�、改良的劑型統(tǒng)計、優(yōu)先審評審批數(shù)據(jù)等角度分別比較分析�,以期為化學(xué)藥改良型新藥的研究開發(fā)提供思路和參考。結(jié)果表明在研發(fā)分類選擇方面,選擇2.2和2.4類改良型新藥治療往往會獲得較高的注冊成功率�,其研發(fā)風(fēng)險和技術(shù)難度相對較低�,可以作為未來研究與開發(fā)的重點�;在治療領(lǐng)域方面�,抗腫瘤藥和免疫機能調(diào)節(jié)藥、神經(jīng)系統(tǒng)用藥等是改良型新藥的研發(fā)熱門�,符合我國政策導(dǎo)向�;在劑型選擇方面�,高端制劑技術(shù)可作為2.2類改良型新藥的研發(fā)切入口;在審評審批通過率方面�,避免如注射用紫杉醇聚合物膠束等品種的“扎堆”申報�。
關(guān)鍵詞
改良型新藥�;新藥開發(fā)�;優(yōu)先審評審批�;化學(xué)藥
2015年8月9日,國務(wù)院發(fā)布《關(guān)于改革藥品醫(yī)療器械審評審批制度的意見》(以下簡稱《意見》)�,開啟了我國藥品審評審批制度的改革?!兑庖姟氛{(diào)整了藥品的注冊分類�,將藥品分為新藥和仿制藥�,新藥分為創(chuàng)新藥和改良型新藥。2016年3月�,原國家食品藥品監(jiān)督管理總局發(fā)布《化學(xué)藥品注冊分類改革工作方案》�,改良型新藥正式面世�。此后,國家陸續(xù)出臺改良型新藥相關(guān)的申報資料要求和臨床試驗指導(dǎo)原則�。
與全新靶點和結(jié)構(gòu)的創(chuàng)新藥相比�,改良型新藥具有更多可以借鑒的已知活性成分藥品的研究數(shù)據(jù)�,可縮短臨床研發(fā)的周期[1]�。因此隨著制藥工業(yè)技術(shù)的快速發(fā)展�,介于創(chuàng)新藥和仿制藥之間的改良型新藥逐漸成為醫(yī)藥企業(yè)研發(fā)的新熱點。根據(jù)公開數(shù)據(jù)及報道�,化學(xué)藥2類改良型新藥的注冊受理走勢整體呈上升趨勢�。在健康中國戰(zhàn)略背景下,為做好新藥研發(fā)布局�,開辟藥物的多層次創(chuàng)新通道,本文在分析化學(xué)藥改良型新藥的注冊申請�、批準(zhǔn)數(shù)量的基礎(chǔ)上�,從化學(xué)藥改良型新藥的治療領(lǐng)域分布、改良的劑型統(tǒng)計�、優(yōu)先審評審批數(shù)據(jù)等角度分別比較分析�,以期為化學(xué)藥改良型新藥的研究開發(fā)提供思路和參考�。
1、數(shù)據(jù)與方法
1.1改良型新藥的定義及注冊分類
改良型新藥是指在已知活性成分的基礎(chǔ)上�,對其結(jié)構(gòu)�、劑型、處方工藝�、給藥途徑�、適應(yīng)證等進(jìn)行優(yōu)化�,且具有明顯臨床優(yōu)勢的藥品[2]�。明顯臨床優(yōu)勢指患者未被滿足的臨床需求,可以表現(xiàn)在通過改良已上市藥品而提高有效性�、改善安全性和/或提高依從性等[3]。
根據(jù)《國家藥監(jiān)局關(guān)于發(fā)布化學(xué)藥品注冊分類及申報資料要求的通告(2020年第44號)》�,化學(xué)藥改良型新藥注冊分類分為以下4種�,見表1。
1.2研究方法
本文將米內(nèi)網(wǎng)、藥渡數(shù)據(jù)庫和戊戌數(shù)據(jù)庫中檢索的數(shù)據(jù)使用Excel2016進(jìn)行分類�、整理�,并按受理號進(jìn)行申報、批準(zhǔn)數(shù)量(臨床試驗或生產(chǎn))�、治療領(lǐng)域分布�、劑型等情況的描述性統(tǒng)計分析。
2�、化學(xué)藥改良型新藥申報情況及特點分析
2.1申報數(shù)量
2.1.1總覽申報趨勢
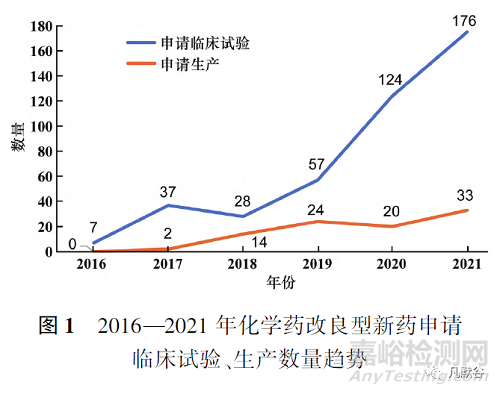
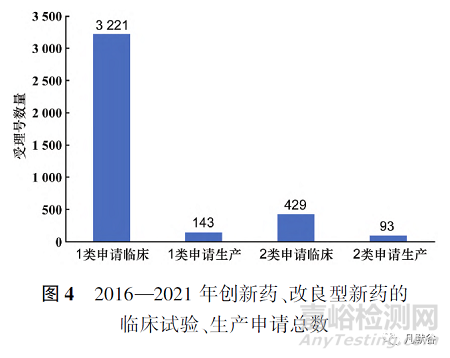
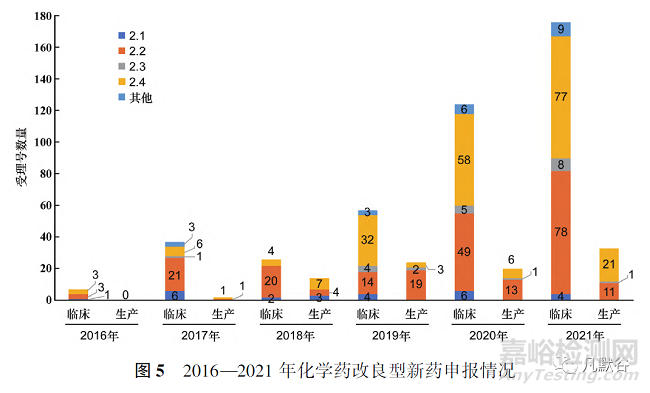
2016—2021年化學(xué)藥改良型新藥申請臨床試驗與申請生產(chǎn)的數(shù)量逐年上升�,研究積極性高漲。6年間受理號共522個�,其中申請臨床數(shù)為429個,申請生產(chǎn)數(shù)為93個�,見圖1。
2.1.2對比創(chuàng)新藥與改良型新藥的申報情況
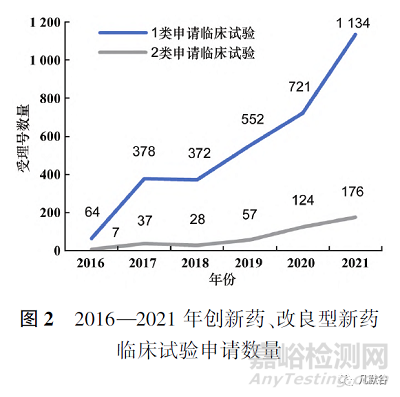
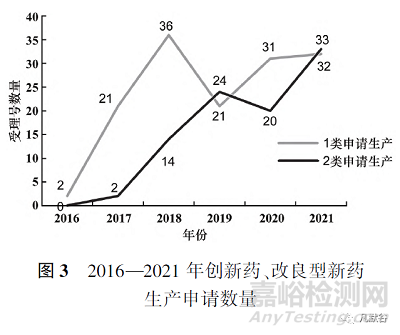
根據(jù)國家藥品監(jiān)督管理局藥品審評中心(CDE)《2021年度藥品審評報告》中1類創(chuàng)新藥申請數(shù)據(jù)以及藥渡數(shù)據(jù)庫相關(guān)數(shù)據(jù)�,與2類改良型新藥相比,總體數(shù)量上創(chuàng)新藥在臨床試驗申請和生產(chǎn)申請上都遠(yuǎn)超改良型新藥[4]�。臨床試驗申請上,如圖2所示�,創(chuàng)新藥和改良型新藥的申請數(shù)量都不斷上升,但改良型新藥的申請數(shù)量與創(chuàng)新藥相比還存在一定差距�,改良型新藥的發(fā)展水平仍有待提升�。生產(chǎn)申請上,2019和2021年改良型新藥的申請數(shù)量出現(xiàn)小幅度反超�,見圖3。
此外�,2016—2021年化學(xué)藥改良型新藥,無論是申請臨床試驗還是申請生產(chǎn)�,申報的注冊分類大部分集中在2.2類和2.4類,2.1類和2.3類數(shù)量較少�,甚至為0,見圖4和圖5�。
2.2申報所涉及治療領(lǐng)域
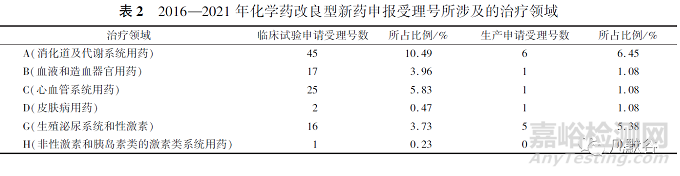
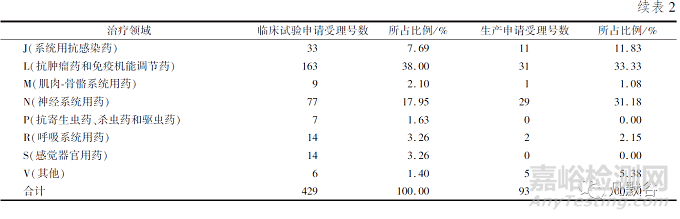
本文采用ATC代碼(解剖學(xué)治療學(xué)及化學(xué)分類系統(tǒng)�,簡稱ATC系統(tǒng),是WHO對藥品的官方分類系統(tǒng))進(jìn)行分析統(tǒng)計�,發(fā)現(xiàn)治療領(lǐng)域占比如表2所示。從臨床試驗申請來看�,受理號數(shù)量排在前列的依次是抗腫瘤藥和免疫機能調(diào)節(jié)藥、神經(jīng)系統(tǒng)用藥�、消化系統(tǒng)及代謝用藥和系統(tǒng)用抗感染藥�,這些領(lǐng)域占總申報量的74.13%�。從生產(chǎn)申請看,受理號數(shù)量排在前列的依次是抗腫瘤藥和免疫機能調(diào)節(jié)藥�、神經(jīng)系統(tǒng)用藥、系統(tǒng)用抗感染藥和消化系統(tǒng)及代謝用藥�,這些占總申報量的82.79%。
2.3申報品種的改良劑型分布
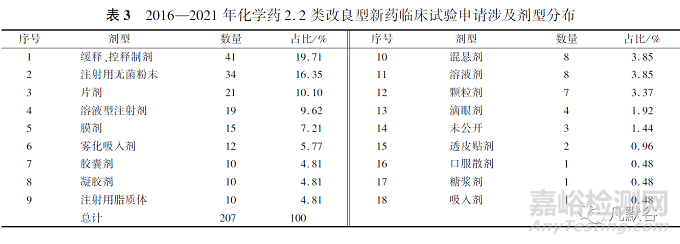
根據(jù)劑型對2016—2021年2.2類化學(xué)藥申請臨床試驗的數(shù)據(jù)進(jìn)行統(tǒng)計�,改良后的劑型為緩控釋制劑、注射用無菌粉末和片劑的數(shù)量位列前3�,見表3。
3�、獲批情況及特點分析
3.1品種獲批數(shù)量
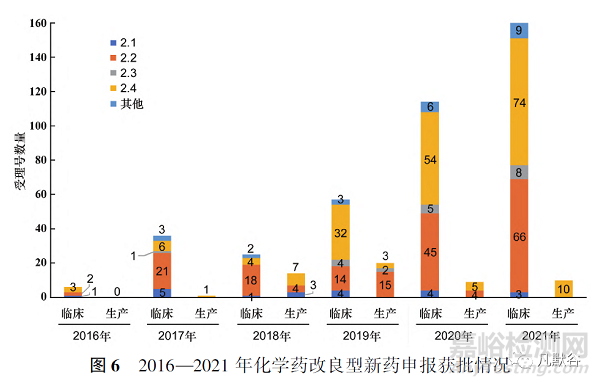
從圖6可見,2016—2021年化學(xué)藥改良型新藥申報臨床試驗的批準(zhǔn)數(shù)量�,總體呈上升趨勢,2016年批準(zhǔn)臨床試驗的數(shù)量只有6個�,而2021年就已達(dá)到160個。
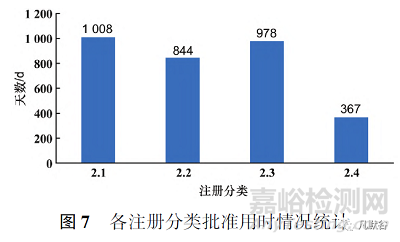
此外�,批準(zhǔn)臨床試驗申請和生產(chǎn)申請的2類化學(xué)藥�,在申報的注冊分類上數(shù)量依然集中在2.2和2.4類,和申請臨床試驗�、生產(chǎn)的數(shù)量呈現(xiàn)相似的特點。本文對批準(zhǔn)生產(chǎn)的2類化學(xué)藥用時(從國家或地方藥品監(jiān)督管理局受理生產(chǎn)申請之日起�,到批件發(fā)放之日止所用時長)進(jìn)行統(tǒng)計后發(fā)現(xiàn)�,平均批準(zhǔn)用時最短的是2.4類�,最長的為2.1類�,各注冊分類具體平均批準(zhǔn)用時見圖7。而納入優(yōu)先審評審批通道的改良型新藥品種平均批準(zhǔn)用時少于一般品種�,見圖8�。
3.2化學(xué)藥改良型新藥審批通過率
2016—2021年化學(xué)藥改良型新藥申請生產(chǎn)的通過率見圖9。其中部分藥品仍在審評審批中�,因此在統(tǒng)計時�,本文僅針對有審評結(jié)論的藥品計算審批通過率�。對未批準(zhǔn)受理號分析發(fā)現(xiàn),2020年未被批準(zhǔn)上市藥品�,如丁苯酞注射液(用于急性缺血性腦卒中患者神經(jīng)功能缺損的改善)申請集中度較高�。有藥企在2020年就提交了該藥的上市申請�,但未被批準(zhǔn),2021年又再次提交�。此外2021年還有多家企業(yè)提交了丁苯酞注射液的臨床試驗申請�,除去改良型新藥還有仿制藥申報�,丁苯酞的競爭激烈程度越來越明顯�。因此,該藥集中度較高�,也存在一定的研發(fā)風(fēng)險�,這些藥品也并不在國家倡導(dǎo)優(yōu)先審評審批的政策范圍內(nèi)。
3.3批準(zhǔn)品種涉及治療領(lǐng)域
從表4中可以看出,2016—2021年批準(zhǔn)臨床試驗的品種其治療領(lǐng)域集中在抗腫瘤藥和免疫機能調(diào)節(jié)藥及神經(jīng)系統(tǒng)用藥、消化系統(tǒng)及代謝用藥等�;批準(zhǔn)生產(chǎn)的品種其治療領(lǐng)域集中在抗腫瘤藥和免疫機能調(diào)節(jié)藥�、神經(jīng)系統(tǒng)用藥�、系統(tǒng)用抗感染藥等�。
4�、2016—2021年化學(xué)藥改良型新藥優(yōu)先審評審批數(shù)量分析
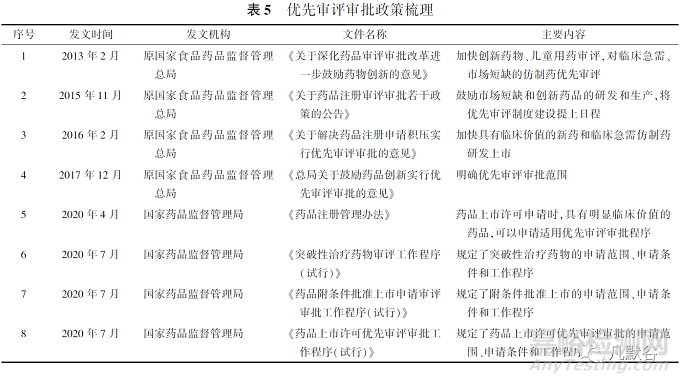
4.1優(yōu)先審評審批政策梳理
2016年起�,CDE正式開啟優(yōu)先審評審批工作�,我國關(guān)于優(yōu)先審評審批的政策梳理見表5�。
4.2�、2016—2021年化學(xué)藥改良型新藥優(yōu)先審評審批的數(shù)據(jù)分析
新版《藥品注冊管理辦法》于2020年10月1日實施,其中首次提出4個藥品審評審批的加快通道:突破性治療藥物�、附條件批準(zhǔn)�、優(yōu)先審評審批和特別審批程序�。根據(jù)藥渡數(shù)據(jù)庫�,2016—2021年期間CDE共受理了45個符合加快通道的改良型新藥的受理號�。由于附條件批準(zhǔn)、突破性治療�、特殊審批3個加快通道的受理號過少�,現(xiàn)對CDE受理的優(yōu)先審評審批的30個符合加快通道的改良型新藥的受理號做以下分析�,見圖10,其顯示了優(yōu)先審評審批通道中不同藥品優(yōu)先審評審批通過理由的分布情況�。
其中�,16個受理號通過優(yōu)先審評審批的原因是國家藥品監(jiān)督管理局規(guī)定的其他優(yōu)先審評審批的情形�。圖11展示了由國家藥品監(jiān)督管理局規(guī)定的其他情形獲得優(yōu)先審評審批的受理號原因分布�,超過一半的受理號獲得優(yōu)先審批的原因是使用先進(jìn)制劑技術(shù)、創(chuàng)新治療手段和具有明顯治療優(yōu)勢�。而在重大疾病防治中具有清晰的臨床定位的中藥注冊申請、專利到期前3年的藥品臨床試驗申請和專利到期前1年的藥品受理號數(shù)量暫時為0�。
5�、分析與討論
5.1數(shù)據(jù)分析
5.1.1不同分類的改良型新藥其改良方向難易有別�、研發(fā)成本存在差異
申報和批準(zhǔn)數(shù)據(jù)主要以2.2和2.4類為主�,2.2類和2.3類數(shù)量較少�,原因是不同改良方向的難易有別,研發(fā)成本上也存在一定的差異�。2.2類改良型新藥主要通過劑型優(yōu)勢體現(xiàn)藥物臨床優(yōu)勢。2.4類改良型新藥將新適應(yīng)證作為改良的方向�。由前述治療領(lǐng)域分布情況可知�,抗腫瘤藥領(lǐng)域的改良型新藥數(shù)量較多�,尤其是以改適應(yīng)證為方向的2.4類藥。其原因是新出的抗腫瘤藥滿足治療某一種腫瘤的條件�,但隨著研究深入和治療時間延長后,發(fā)現(xiàn)對其他腫瘤也有效�,于是藥企會以此作為改良的新適應(yīng)證再次申報。
2.1類和2.3類改良型新藥申報和批準(zhǔn)的數(shù)量較少�,一方面目前國內(nèi)藥企研發(fā)實力仍有待提高,只有極少數(shù)藥企具有開發(fā)這類新藥的能力�;另一方面這2類新藥必然需要做大型臨床研究以證明其療效,研發(fā)時間長�、風(fēng)險相對較大、研發(fā)成本高�。
5.1.2藥品治療領(lǐng)域的分布集中在抗腫瘤藥等領(lǐng)域
由表4和表8可以看出,改良型新藥的申請和批準(zhǔn)所涉及治療領(lǐng)域分布均集中在抗腫瘤藥和免疫機能調(diào)節(jié)藥及神經(jīng)系統(tǒng)用藥�,由此可見抗腫瘤藥和神經(jīng)系統(tǒng)用藥是當(dāng)前改良型新藥研發(fā)的熱點。
5.1.3藥品依靠先進(jìn)制劑技術(shù)等通過優(yōu)先審評審批
2016—2021年化學(xué)藥改良型新藥優(yōu)先審評審批通過的受理號數(shù)量為30個�,占總批準(zhǔn)受理號數(shù)量的55.56%。此外�,改良型新藥的研發(fā)其根本要求是具有明顯的臨床優(yōu)勢和價值�,從數(shù)據(jù)中可以發(fā)現(xiàn)大部分藥品優(yōu)先審評審批的原因是使用了先進(jìn)的制劑技術(shù)�、創(chuàng)新治療手段和藥品具有明顯治療優(yōu)勢�,以此適應(yīng)臨床需求、滿足臨床價值�。
5.1.4從審批通過率中發(fā)現(xiàn)存在“扎堆”現(xiàn)象
通過觀察2016—2021年化學(xué)藥改良型新藥申請生產(chǎn)的通過率,發(fā)現(xiàn)有些藥品的研發(fā)狀態(tài)漸至飽和�,如上述分析中提到的丁苯酚注射液�,已存在“扎堆”研發(fā)的情況�,此外該藥品也不在國家鼓勵倡導(dǎo)的藥品研發(fā)政策范圍內(nèi)�,因此建議企業(yè)盡量規(guī)避研發(fā)這些方向的藥品�。
5.2化學(xué)藥改良型新藥研發(fā)的啟示
5.2.1優(yōu)先研發(fā)2.2和2.4類改良型新藥�,探索藥物的新劑型和新適應(yīng)證
具備一定研發(fā)實力的藥企或者正在轉(zhuǎn)型的仿制藥企業(yè)�,若想將思路聚焦于改良型新藥的研發(fā)�,可以優(yōu)先考慮研發(fā)2.2類和2.4類的化學(xué)藥改良型新藥�,探索藥物的新劑型和新適應(yīng)證�。從以上統(tǒng)計可以看出2.2類改劑型的改良型新藥研發(fā)勢頭向好�。相比于其他的改良類型,做劑型改造時技術(shù)的可復(fù)制性會更高�,藥企可以“摸著石頭過河”�,參考目前我國正在做的劑型改良,并結(jié)合具體的品種申報書來看改良后的優(yōu)勢所在�,從而為2.2類改良型新藥的研制提供啟發(fā)�。
5.2.2以政策為導(dǎo)向聚焦抗腫瘤藥物與神經(jīng)系統(tǒng)用藥的改良
根據(jù)數(shù)據(jù)分析可知,抗腫瘤藥物和神經(jīng)系統(tǒng)用藥是目前的研發(fā)熱點�。2021年《“十四五”醫(yī)藥工業(yè)發(fā)展規(guī)劃》中提出要重點發(fā)展針對腫瘤、自身免疫性疾病�、神經(jīng)退行性疾病�、心血管疾病�、糖尿病�、肝炎�、呼吸系統(tǒng)疾病�、耐藥微生物感染等重大臨床需求的化學(xué)新藥[5]�??鼓[瘤藥�、神經(jīng)系統(tǒng)用藥不僅是我國化學(xué)藥改良型新藥的研究熱點�,也是政策支持的導(dǎo)向。建議藥企從以下2個思路去探索:①抗腫瘤藥物和神經(jīng)系統(tǒng)用藥的研發(fā)成功率較高�,且符合政策導(dǎo)向,藥企可以繼續(xù)在該2類治療領(lǐng)域深入研究改良型新藥的研發(fā)�。②抗腫瘤藥物和神經(jīng)系統(tǒng)用藥已成為研發(fā)熱門�,為避免這2類治療領(lǐng)域過于飽和,競爭激烈度較大�,藥企也可以另辟蹊徑�,去探索研發(fā)其他冷門治療領(lǐng)域的改良型新藥。
5.2.3以高端制劑技術(shù)為切入口開展2.2類改良型新藥研發(fā)
從上述劑型統(tǒng)計可以看出,申請臨床的2.2類改良型新藥中�,改良后的劑型有不少屬于高端制劑�。高端制劑通常具有改變藥物的作用方式和速度�、影響藥物療效�、降低藥物毒性等特點�,而改良型新藥所要求的“具有明顯臨床優(yōu)勢”,根據(jù)CDE發(fā)布的《化學(xué)藥品改良型新藥臨床試驗技術(shù)指導(dǎo)原則》[3]�,臨床優(yōu)勢即患者未被滿足的臨床需求�。在目標(biāo)適應(yīng)證中�,對比已有的標(biāo)準(zhǔn)治療�,新藥或新的治療手段可顯著提高療效�;或在不降低療效的同時,顯著降低當(dāng)前用藥患者的不良反應(yīng)或用藥的相關(guān)風(fēng)險�,或顯著提高患者用藥依從性?;瘜W(xué)藥改良型新藥的臨床優(yōu)勢也遵循上述原則�,因此高端制劑技術(shù)所能達(dá)到的效果與改良型新藥的要求契合度較高�,利用高端制劑技術(shù)作為2.2類改良型新藥的切入口是一條可行之路。
5.2.4避免某些品種的扎堆申報
在數(shù)據(jù)統(tǒng)計時發(fā)現(xiàn)�,注射用紫杉醇聚合物膠束�、注射用紫杉醇(白蛋白結(jié)合型)�、孟魯司特鈉口溶膜、孟魯司特鈉凝膠�、膠體果膠鉍片、葡萄糖酸鋅片液等品種�,存在3家及以上企業(yè)共同申報的現(xiàn)象,建議企業(yè)在做改良型新藥研發(fā)時提前了解品種競爭格局�,避免扎堆申報造成研發(fā)資源的浪費。
6�、結(jié)語
當(dāng)前我國創(chuàng)新藥的發(fā)展已迎來“黃金時代”,越來越多的醫(yī)藥企業(yè)爭相涌入創(chuàng)新藥賽道[6]�。在仿制藥競爭越來越大、新藥靶點開發(fā)越來越難的情況下,相較于一類創(chuàng)新藥而言�,改良型新藥無疑是一個好的選擇。自2015年藥品審評審批改革之后�,我國不斷出臺一系列推動新藥發(fā)展的政策,改良型新藥申報數(shù)據(jù)不斷上升�。我國是仿制藥大國,在完全創(chuàng)新和仿制之間開辟出一條新通道�,對創(chuàng)新藥、改良型新藥�、仿制藥進(jìn)行差異化分類,實施更為精準(zhǔn)高效的監(jiān)管�,既能避免不必要的低水平重復(fù),提高“新”的質(zhì)量�,又能為創(chuàng)新能力較低的企業(yè)提供一條可行之路。完全創(chuàng)新是一座難以逾越的高山�,改良型新藥的出現(xiàn)給積極轉(zhuǎn)型的仿制藥企業(yè)帶來了曙光�,在改良型新藥市場持續(xù)擴大的情況下,醫(yī)藥企業(yè)想要趁機加入并突出重圍�,就要腳踏實地根據(jù)申報現(xiàn)狀并結(jié)合自身研發(fā)實力做好立項。