創(chuàng)新醫(yī)療器械的設(shè)計(jì)輸出往往和傳統(tǒng)產(chǎn)品按部就班的進(jìn)行有很大的差別,通常我們需要進(jìn)行多次設(shè)計(jì)更改和動(dòng)物試驗(yàn)才能夠?qū)a(chǎn)品最終設(shè)計(jì)定型�����。因此創(chuàng)新醫(yī)療器械的設(shè)計(jì)輸出就比較復(fù)雜了,在此今天給大家介紹下創(chuàng)新醫(yī)療器械的設(shè)計(jì)輸出--前期個(gè)人經(jīng)驗(yàn)供大家參考��!
1.主要任務(wù) Main Task
1.1產(chǎn)品設(shè)計(jì)及輸出 Product Design and Output
本階段應(yīng)結(jié)合設(shè)計(jì)輸入的要求���,對(duì)產(chǎn)品進(jìn)行整體設(shè)計(jì)���。針對(duì)結(jié)合在一起形成產(chǎn)品的所有子系統(tǒng)�����、零件、組件和原材料的設(shè)計(jì)輸出應(yīng)形成文件�����,這些文件包括:產(chǎn)品圖紙(包括原材料�、零件����、組件�����、半成品或成品圖紙)��,適當(dāng)時(shí)�����,建立原材料質(zhì)量標(biāo)準(zhǔn)(適當(dāng)時(shí)輸出原材料規(guī)格說明書)��。適當(dāng)時(shí)�����,應(yīng)輸出設(shè)計(jì)產(chǎn)品設(shè)計(jì)方案且應(yīng)經(jīng)過評(píng)審,評(píng)審結(jié)果應(yīng)形成文件���。
1.2過程設(shè)計(jì)及輸出 Process Design and Output
1.2.1工藝研究與輸出Process Research and Output
本階段應(yīng)結(jié)合設(shè)計(jì)輸入的要求����,對(duì)產(chǎn)品工藝進(jìn)行設(shè)計(jì)����,適當(dāng)時(shí)輸出工藝開發(fā)方案且應(yīng)經(jīng)過評(píng)審����,評(píng)審結(jié)果應(yīng)形成文件��。適當(dāng)時(shí)�����,應(yīng)分析和確定本階段需完成的工藝研究實(shí)驗(yàn)����,輸出先行試驗(yàn)報(bào)告。對(duì)于無菌提供產(chǎn)品����,至少應(yīng)完成內(nèi)包裝��、滅菌等工藝與現(xiàn)有工藝等同分析或工藝研究報(bào)告或過程確認(rèn)�����。如無等同性�,則應(yīng)在設(shè)計(jì)輸出評(píng)審前完成。本階段的過程確認(rèn)包含IQ和OQ��,且應(yīng)在設(shè)計(jì)輸出評(píng)審前完成����。
1.2.2過程設(shè)計(jì)與輸出Process Design and Output
過程設(shè)計(jì)輸出是針對(duì)產(chǎn)品制造����、維修���、服務(wù)、環(huán)境�����、庫存�、運(yùn)輸?shù)戎圃斐绦虻妮敵?���,本階段應(yīng)輸出產(chǎn)品制造過程文件����,包括:工藝流程圖����、工藝規(guī)范����、生產(chǎn)批記錄表、設(shè)備規(guī)范等�����。適用時(shí)��,工藝規(guī)范包括:生產(chǎn)工裝圖紙�、標(biāo)準(zhǔn)操作規(guī)程��、工藝參數(shù)表��、電子程序等。適用時(shí),設(shè)備規(guī)范包括:生產(chǎn)設(shè)備及清單�����、生產(chǎn)工夾模具及清單�、設(shè)備操作規(guī)程及維護(hù)保養(yǎng)規(guī)程����。
1.3生產(chǎn)輔料設(shè)計(jì)及輸出 Design and Output of Production Auxiliary Materials
本階段應(yīng)對(duì)重要度為A、B類的生產(chǎn)輔料進(jìn)行設(shè)計(jì)���,并輸出可接收的質(zhì)量標(biāo)準(zhǔn)�。
1.4標(biāo)準(zhǔn)測試方法Standard Test Method
需要建立標(biāo)準(zhǔn)測試方法(STM)時(shí),應(yīng)優(yōu)先分析和采用法規(guī)/標(biāo)準(zhǔn)(如:ASTM�、ISO、GB、YY等)中的方法��。非法規(guī)/標(biāo)準(zhǔn)中的測試方法應(yīng)在設(shè)計(jì)驗(yàn)證完成前(注冊(cè)送檢前)完成方法學(xué)驗(yàn)證����。適用時(shí),本階段應(yīng)輸出相應(yīng)的檢測工裝圖紙�����、檢測設(shè)備及工裝夾具清單�����。
1.5設(shè)計(jì)評(píng)價(jià) Design Evaluation
產(chǎn)品設(shè)計(jì)評(píng)價(jià)應(yīng)識(shí)別本階段需要采用的產(chǎn)品設(shè)計(jì)評(píng)價(jià)方式����,可以包括:原樣研究����、早期性能及指標(biāo)研究�、可行性動(dòng)物試驗(yàn)研究、早期生物學(xué)評(píng)價(jià)研究、早期可行性臨床研究���、設(shè)計(jì)定型驗(yàn)證�����、工藝研究�����、以及可用性的形成性評(píng)價(jià)等方面�����。依據(jù)產(chǎn)品規(guī)范中所列各項(xiàng)性能,就上述各評(píng)價(jià)方式的選擇進(jìn)行判斷�,輸出產(chǎn)品設(shè)計(jì)評(píng)價(jià)方案和報(bào)告��。
1.5.1原樣研究 Research of original Samples
原樣研究為驗(yàn)證關(guān)鍵性能是否滿足要求��。原樣應(yīng)經(jīng)過評(píng)審���,評(píng)審要求按照技術(shù)評(píng)審方式進(jìn)行����,通過該評(píng)審是產(chǎn)品設(shè)計(jì)/過程設(shè)計(jì)進(jìn)一步開展的前提條件。
本階段應(yīng)對(duì)原樣進(jìn)行相應(yīng)的測試�����,測試至少包括關(guān)鍵物理性能指標(biāo)��、功能實(shí)現(xiàn)��、可用性評(píng)價(jià)等,輸出原樣測試報(bào)告。適用時(shí)��,本階段應(yīng)輸出先行試驗(yàn)報(bào)告��,其至少應(yīng)包括試驗(yàn)?zāi)康暮鸵饬x�、適用范圍��、性能指標(biāo)測試結(jié)果���、結(jié)果分析、穩(wěn)定性分析等�。樣品或樣機(jī)生產(chǎn)及檢驗(yàn)的可追溯性。
當(dāng)產(chǎn)品的材料包含可降解材料或潛在降解材料時(shí)��,應(yīng)在本階段應(yīng)完成產(chǎn)品儲(chǔ)存環(huán)境研究和早期產(chǎn)品加速老化研究����,并輸出研究報(bào)告���。
1.5.2早期性能及指標(biāo)研究與輸出Early performance and index research and output
本階段活動(dòng)包括測試方法研究���、產(chǎn)品與對(duì)比產(chǎn)品性能對(duì)比評(píng)價(jià)和產(chǎn)品性能及指標(biāo)制定依據(jù)研究����。
當(dāng)產(chǎn)品為無菌醫(yī)療器械或微限醫(yī)療器械時(shí)�����,注冊(cè)檢驗(yàn)送檢前應(yīng)完成微生物�、無菌方法學(xué)確認(rèn)���;當(dāng)為EO滅菌時(shí)����,應(yīng)在注冊(cè)送檢前完成EO殘留方法學(xué)確認(rèn)�����。
當(dāng)產(chǎn)品為免臨床目錄內(nèi)產(chǎn)品或通過同品種比對(duì)豁免臨床試驗(yàn)時(shí)����,應(yīng)進(jìn)行產(chǎn)品與對(duì)比產(chǎn)品性能對(duì)比評(píng)價(jià)��。該評(píng)價(jià)應(yīng)至少包括:目的����、檢驗(yàn)設(shè)備要求、樣品信息�����、對(duì)比項(xiàng)目及檢驗(yàn)方法�、測試結(jié)果��、結(jié)果分析等����。該評(píng)價(jià)應(yīng)在設(shè)計(jì)輸出評(píng)審?fù)瓿汕巴瓿?。產(chǎn)品與對(duì)比產(chǎn)品性能對(duì)比評(píng)價(jià)結(jié)果是產(chǎn)品性能及指標(biāo)制定依據(jù)的輸入來源���。
應(yīng)識(shí)別本階段產(chǎn)品性能及指標(biāo)制定依據(jù)研究方法���,可以包括引用標(biāo)準(zhǔn)��、文獻(xiàn)分析���、產(chǎn)品與對(duì)比產(chǎn)品性能測試對(duì)比、產(chǎn)品實(shí)際測定結(jié)果等����。在注冊(cè)送檢前應(yīng)輸出產(chǎn)品性能及指標(biāo)制定依據(jù)研究資料,同時(shí)更新設(shè)計(jì)輸入���。
1.5.3可行性動(dòng)物試驗(yàn)研究與輸出Feasibility animal experiment research and output
可行性動(dòng)物試驗(yàn)樣品可使用未定型產(chǎn)品。適用時(shí)�����,本階段應(yīng)基于非臨床研究文獻(xiàn)�,輸出可行性動(dòng)物試驗(yàn)研究方案���,應(yīng)至少包括實(shí)驗(yàn)?zāi)康?���、受試器械���、試?yàn)用動(dòng)物����、動(dòng)物模型選擇依據(jù)、動(dòng)物數(shù)量�����、觀察時(shí)間����、評(píng)價(jià)指標(biāo)、偏差信息等���。試驗(yàn)結(jié)束時(shí)��,本階段應(yīng)形成可行性動(dòng)物試驗(yàn)研究報(bào)告����,應(yīng)至少包括信息參照2021年國家藥監(jiān)局關(guān)于發(fā)布醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則《醫(yī)療器械動(dòng)物試驗(yàn)研究注冊(cè)審查指導(dǎo)原則第二部分:試驗(yàn)設(shè)計(jì)����、實(shí)施質(zhì)量保證》。
適用時(shí)�,非臨床研究文獻(xiàn)應(yīng)進(jìn)行匯總形成文件(用于注冊(cè)資料儲(chǔ)備)�����。
1.5.4早期可行性臨床研究與輸出Early feasibility clinical research and output
關(guān)于早期可行性臨床可行性在前期撰寫過一篇醫(yī)療器械研發(fā)能否開展小樣本臨床試驗(yàn)�����,詳細(xì)的可以點(diǎn)擊藍(lán)色字體進(jìn)行了解���。
適用時(shí)��,本階段應(yīng)基于臨床研究文獻(xiàn),輸出可行性臨床研究方案����,應(yīng)至少包括方案摘要、申報(bào)者信息��、臨床研究機(jī)構(gòu)和研究者列表����、臨床試驗(yàn)?zāi)康暮晚?xiàng)目內(nèi)容�、臨床研究的背景資料、產(chǎn)品的特點(diǎn)結(jié)構(gòu)組成����、產(chǎn)品的適應(yīng)癥與禁忌癥、總體設(shè)計(jì)����、數(shù)據(jù)管理等���。
適用時(shí)�,臨床研究文獻(xiàn)應(yīng)進(jìn)行匯總形成文件(用于注冊(cè)資料儲(chǔ)備)����。適用時(shí)�,早期可行性臨床研究應(yīng)進(jìn)行且輸出至少3-5例符合預(yù)期用途要求的表明產(chǎn)品有效性的臨床數(shù)據(jù)結(jié)果��。
1.6包裝/標(biāo)簽設(shè)計(jì)與輸出 Packaging/Label Design and Output
應(yīng)在本階段輸出包裝設(shè)計(jì)��、工藝和接收的質(zhì)量標(biāo)準(zhǔn)(如圖紙)����。
1.7進(jìn)貨/過程/半成品/成品檢驗(yàn)規(guī)程 Receiving/ In-Process/ Semi-finished/Product
針對(duì)產(chǎn)品制造過程的檢驗(yàn)要求應(yīng)形成文件����,輸出進(jìn)貨、過程���、半成品或成品檢驗(yàn)規(guī)程及其空白檢驗(yàn)記錄單。
1.8 設(shè)計(jì)定型及輸出 Design Freeze and output
設(shè)計(jì)定型驗(yàn)證用以支持設(shè)計(jì)定型���,設(shè)計(jì)定型驗(yàn)證評(píng)價(jià)包括:產(chǎn)品性能設(shè)計(jì)定型、產(chǎn)品工藝設(shè)計(jì)定型���。本階段應(yīng)輸出支持設(shè)計(jì)定型驗(yàn)證的DMR清單��,包括文件編號(hào)���、文件版本號(hào)��。適用時(shí)�����,產(chǎn)品性能設(shè)計(jì)定型應(yīng)進(jìn)行早期可行性臨床研究(詳見1.5.4)以確認(rèn)產(chǎn)品性能設(shè)計(jì)定型����;適用時(shí),產(chǎn)品工藝設(shè)計(jì)定型應(yīng)進(jìn)行設(shè)計(jì)定型樣品的生產(chǎn)����,并按照技術(shù)要求的項(xiàng)目進(jìn)行全性能檢測��。在進(jìn)行產(chǎn)品工藝設(shè)計(jì)定型樣品生產(chǎn)前����,應(yīng)輸出物料清單(BOM)。
適用時(shí)��,本階段應(yīng)輸出注冊(cè)送檢典型型號(hào)規(guī)格研究資料��,用于工藝設(shè)計(jì)定型樣品的規(guī)格型號(hào)�����。本活動(dòng)應(yīng)經(jīng)過評(píng)審�����,通過是進(jìn)行工藝設(shè)計(jì)定型驗(yàn)證的前提條件��。工藝設(shè)計(jì)定型樣品的樣本規(guī)格和所用DMR文件應(yīng)與注冊(cè)檢驗(yàn)的原則保持一致����,且數(shù)量應(yīng)不小于10套����。
設(shè)計(jì)定型驗(yàn)證應(yīng)經(jīng)技術(shù)評(píng)審即設(shè)計(jì)定型評(píng)審�����,并輸出設(shè)計(jì)定型報(bào)告���,包括本次驗(yàn)證所對(duì)應(yīng)樣品的設(shè)計(jì)輸出及生產(chǎn)過程文件清單及版本��。設(shè)計(jì)定型評(píng)審是開展設(shè)計(jì)輸出評(píng)審的前提條件�����。
1.9產(chǎn)品說明書/技術(shù)要求Instructions for Use/Technical Requirements
完善產(chǎn)品技術(shù)要求�,產(chǎn)品說明書等技術(shù)文件。完整的產(chǎn)品使用說明書分為產(chǎn)品使用說明書內(nèi)容和包含產(chǎn)品使用說明書排版在內(nèi)的最終整合兩項(xiàng)活動(dòng)����。排版的產(chǎn)品使用說明書��,需臨床試驗(yàn)的產(chǎn)品在設(shè)計(jì)驗(yàn)證完成前輸出�,其他產(chǎn)品在設(shè)計(jì)確認(rèn)完成前輸出�����。最終銷售使用的產(chǎn)品使用說明書版本應(yīng)在獲得注冊(cè)證后輸出��。同時(shí)注意在各個(gè)階段更新該文件����。
應(yīng)識(shí)別本階段產(chǎn)品性能及指標(biāo)制定依據(jù)研究方法,并在設(shè)計(jì)定型后輸出產(chǎn)品技術(shù)要求�����。研究方法包括���,引用標(biāo)準(zhǔn)�����、文獻(xiàn)分析�����、產(chǎn)品與對(duì)比產(chǎn)品性能測試對(duì)比���、產(chǎn)品實(shí)際測定技術(shù)水平等。結(jié)果應(yīng)形成文件���,同時(shí)更新至設(shè)計(jì)輸入。必要時(shí)����,進(jìn)行產(chǎn)品與對(duì)比產(chǎn)品性能對(duì)比評(píng)價(jià)�。
1.10材料評(píng)價(jià)Material Evaluation
本階段應(yīng)根據(jù)“物料清單和原材料質(zhì)量標(biāo)準(zhǔn)”等信息���,制定“材料評(píng)價(jià)計(jì)劃”��,材料評(píng)價(jià)包括原材料的安全性評(píng)價(jià)資料��、物料小樣確認(rèn)評(píng)價(jià)���、小批量材料評(píng)價(jià)(包括多批次評(píng)價(jià))、材料的生產(chǎn)適用性評(píng)價(jià)(來源歸屬類別為物料類的偏差)以及材料對(duì)產(chǎn)品性能影響的評(píng)價(jià)��。適用時(shí)�����,原材料的安全性評(píng)價(jià)資料包括:MSDS��、生物學(xué)試驗(yàn)報(bào)告��、化學(xué)成分檢測報(bào)告�、供應(yīng)商生產(chǎn)資質(zhì)���、采購合同、質(zhì)量協(xié)議�����、進(jìn)貨檢驗(yàn)表等。
根據(jù)材料評(píng)價(jià)計(jì)劃�,設(shè)計(jì)定型評(píng)審前輸出原材料的安全性評(píng)價(jià)資料�����、物料小樣確認(rèn)評(píng)價(jià)�����。
小批量材料評(píng)價(jià)(包括多批次評(píng)價(jià))��、材料的生產(chǎn)適用性評(píng)價(jià)(來源歸屬類別為物料類的偏差)以及材料對(duì)產(chǎn)品性能影響的評(píng)價(jià)應(yīng)在應(yīng)在設(shè)計(jì)驗(yàn)證完成(T5)并形成材料評(píng)價(jià)報(bào)告����。
1.11風(fēng)險(xiǎn)管理Risk management
1.11.1設(shè)計(jì)故障模式與效應(yīng)分析(FMEA)
利用故障模式與效應(yīng)分析(FMEA)方法分析產(chǎn)品設(shè)計(jì)的風(fēng)險(xiǎn)����,本階段應(yīng)識(shí)別故障模式�����、故障原因�����、故障結(jié)果、探測方法��,進(jìn)行風(fēng)險(xiǎn)估計(jì)和風(fēng)險(xiǎn)評(píng)價(jià)�,適用時(shí)制訂風(fēng)險(xiǎn)控制計(jì)劃,輸出設(shè)計(jì)故障模式與效應(yīng)分析報(bào)告(DFMEA)���。
1.11.2過程故障模式與效應(yīng)分析(PFMEA)
利用故障模式與效應(yīng)分析(FMEA)方法分析產(chǎn)品制造過程的風(fēng)險(xiǎn),本階段應(yīng)識(shí)別故障模式����、故障原因、故障結(jié)果�、探測方法,進(jìn)行風(fēng)險(xiǎn)估計(jì)和風(fēng)險(xiǎn)評(píng)價(jià)��,適用時(shí)制訂風(fēng)險(xiǎn)控制計(jì)劃�����,輸出過程故障模式與效應(yīng)分析報(bào)告(PFMEA)�����。
1.12(必要時(shí))專利申請(qǐng) (If necessary)
根據(jù)產(chǎn)品設(shè)計(jì)或工藝設(shè)計(jì)情況�����,必要時(shí)進(jìn)行專利申請(qǐng)�����。
1.13生物學(xué)評(píng)價(jià) Biological evaluation
本活動(dòng)適用于與人體直接接觸和/或間接接觸的產(chǎn)品����。
1.13.1生物學(xué)評(píng)價(jià)計(jì)劃 Biological evaluation Plan
本階段應(yīng)輸出生物學(xué)評(píng)價(jià)計(jì)劃�����,設(shè)計(jì)驗(yàn)證完成前完成生物學(xué)評(píng)價(jià)報(bào)告��。生物學(xué)評(píng)價(jià)應(yīng)按照ISO 10993-1:2018的要求確認(rèn)生物學(xué)測試項(xiàng)目�����。生物學(xué)評(píng)價(jià)計(jì)劃應(yīng)形成文件��,至少包括:生物學(xué)終點(diǎn)測試項(xiàng)目�����、各項(xiàng)目的明確途徑�����、試驗(yàn)方法���、樣本量需求數(shù)量、試驗(yàn)周期����、獲得報(bào)告時(shí)間等。
生物學(xué)終點(diǎn)測試項(xiàng)目應(yīng)根據(jù)“注冊(cè)路徑”����,按照ISO10993-1:2018或GB/T 16886.1-2022的要求結(jié)合醫(yī)療器械分類及接觸類型選擇�。
1.13.2生物學(xué)試驗(yàn)樣品 Biological test samples
原則上生物學(xué)試驗(yàn)樣品應(yīng)采用終產(chǎn)品。適用時(shí)���,應(yīng)輸出生物學(xué)試驗(yàn)樣品生產(chǎn)方案����。適用時(shí),應(yīng)明確采用半成品的原因和依據(jù)����。適用時(shí),應(yīng)輸出典型型號(hào)規(guī)格和樣品制備說明�。
最后篩選符合資質(zhì)的檢測中心��,按照檢測中心要求將送檢資料和生物學(xué)試驗(yàn)樣品一并送至檢測中心��。在設(shè)計(jì)驗(yàn)證完成前應(yīng)獲得生物學(xué)試驗(yàn)報(bào)告�����。
1.14 設(shè)計(jì)驗(yàn)證策劃 Design Verification Plan
本階段可根據(jù)設(shè)計(jì)輸入要求”輸出“設(shè)計(jì)驗(yàn)證追溯表”��,設(shè)計(jì)驗(yàn)證項(xiàng)目應(yīng)追溯到“設(shè)計(jì)輸入”的全部要求�,設(shè)計(jì)驗(yàn)證完成前更新追溯表��,并增加設(shè)計(jì)驗(yàn)證結(jié)果��。
1.15設(shè)計(jì)轉(zhuǎn)移策劃 Design Transfer Plan
本階段應(yīng)輸出設(shè)計(jì)轉(zhuǎn)移計(jì)劃,該計(jì)劃應(yīng)至少包括以下內(nèi)容:
轉(zhuǎn)移小組����;
接受標(biāo)準(zhǔn)���;
統(tǒng)計(jì)學(xué)方法、樣本量信息�����;
典型性樣品選擇依據(jù)�;
過程能力驗(yàn)證方式(試生產(chǎn)或評(píng)估);
轉(zhuǎn)移小組各職能人員職責(zé)��。
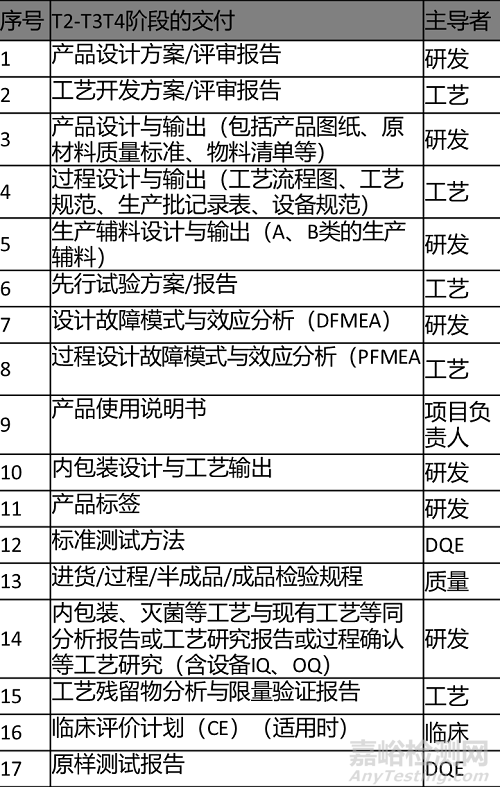
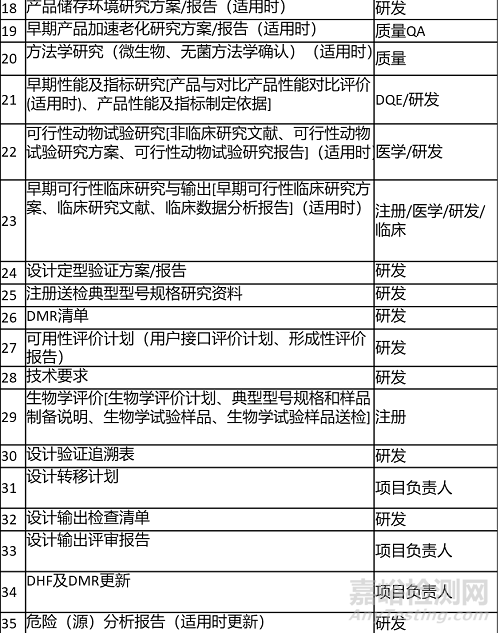
2.輸出清單 Output List
輸出內(nèi)容及清單如下表所示�。
3.設(shè)計(jì)輸出評(píng)審 Design outputs review
根據(jù)策劃階段形成的檢查清單對(duì)輸出的適宜性和完整性進(jìn)行評(píng)審���。