今日頭條
江蘇迪哲EGFR-TKI獲批上市。迪哲醫(yī)藥EGFR-TKI創(chuàng)新藥舒沃替尼片(舒沃哲)獲國家藥監(jiān)局批準(zhǔn)上市,用于既往經(jīng)含鉑化療出現(xiàn)疾病進(jìn)展��,或不耐受含鉑化療��,并且經(jīng)檢測確認(rèn)存在表皮生長因子受體(EGFR)20號(hào)外顯子插入突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)患者。公布于ASCO2023年會(huì)上的注冊研究(WU-KONG6)數(shù)據(jù)顯示��,經(jīng)獨(dú)立影像評(píng)估委員會(huì)(IRC)確認(rèn)的客觀緩解率達(dá)到60.8%��。
國內(nèi)藥訊
1.羅氏IL-6R單抗皮下劑單藥方案獲批上市��。羅氏托珠單抗注射液皮下注射劑型的單藥方案獲國家藥監(jiān)局批準(zhǔn)�,用于治療對一種或多種改善病情抗風(fēng)濕藥物(DMARDs)既往治療應(yīng)答不充分或不耐受的,及甲氨蝶呤(MTX)應(yīng)答不充分或不耐受MTX治療的成人中重度活動(dòng)性類風(fēng)濕關(guān)節(jié)炎(RA)患者����。托珠單抗是首個(gè)作用于IL-6R的創(chuàng)新抗體��。此前該產(chǎn)品的靜脈注射和皮下注射劑型的聯(lián)合治療方案均已在中國獲批用于RA患者。
2.恒瑞改良型右美托咪定獲批用于兒童��。恒瑞醫(yī)藥2.2類新藥鹽酸右美托咪定鼻噴霧劑獲國家藥監(jiān)局批準(zhǔn)新適應(yīng)癥,用于兒童術(shù)前鎮(zhèn)靜(如兒童全身麻醉)����。此前,該產(chǎn)品已被批準(zhǔn)用于成人術(shù)前鎮(zhèn)靜/抗焦慮����。右美托咪定是一種相對選擇性α2-腎上腺素受體激動(dòng)劑,原研產(chǎn)品由Oricon Pharma與雅培聯(lián)合研發(fā)�,商品名為Precedex。
3.康方IL-12/23單抗報(bào)銀屑病NDA��。康方生物IL-12/23單克隆抗體依若奇單抗(AK101)上市申請獲CDE受理��,推測申報(bào)的適應(yīng)癥為用于中重度銀屑病的治療��。依若奇單抗通過靶向IL-12和IL-23的p40亞基并與之結(jié)合�,同時(shí)抑制IL-12和IL-23與細(xì)胞表面受體的相互作用����,進(jìn)而減少T細(xì)胞對干擾素��、TNF-α、IL-17等相關(guān)細(xì)胞因子的釋放��,阻斷各自介導(dǎo)的細(xì)胞免疫反應(yīng)。此前����,該新藥已在一項(xiàng)治療中重度銀屑病的III期注冊臨床中達(dá)到主要研究終點(diǎn)����。
4.甘李「甘精胰島素」歐洲報(bào)MAA����。甘李藥業(yè)開發(fā)的甘精胰島素注射液用于糖尿病適應(yīng)癥的上市許可申請獲歐洲EMA受理。這是一種長效胰島素類似物��,已于2005年在中國獲批上市����,商品名為長秀霖��,只需每日注射1次����,用于糖尿病患者控制血糖�。在臨床試驗(yàn)中,與賽諾菲原研藥甘精胰島素(商品名:Lantus)相比����,該產(chǎn)品具有生物等效性。
5.凌科JAK1抑制劑脊柱炎Ⅱ期臨床積極����。凌科藥業(yè)JAK1抑制劑LNK01001治療強(qiáng)直性脊柱炎的Ⅱ期臨床達(dá)到主要終點(diǎn)。12周治療數(shù)據(jù)顯示��,與安慰劑相比����,LNK01001高、低兩個(gè)劑量組達(dá)到ASAS40應(yīng)答的患者比例顯著更高����;其他療效指標(biāo)的改善與主要終點(diǎn)一致����;藥物總體安全性及耐受性良好����。此前,LNK01001已在治療類風(fēng)濕關(guān)節(jié)炎、特應(yīng)性皮炎的兩項(xiàng)Ⅱ期研究取得積極結(jié)果����。
6.康方PD-1/VEGF雙抗擬納入優(yōu)先審評(píng)��。康方生物PD-1/VEGF雙抗依沃西單抗獲國家藥監(jiān)局?jǐn)M納入優(yōu)先審評(píng),聯(lián)合培美曲塞和卡鉑用于經(jīng)EGFR酪氨酸激酶抑制劑(EGFR-TKI)治療后進(jìn)展的EGFR突變的局部晚期或轉(zhuǎn)移性非鱗非小細(xì)胞肺癌(NSCLC)的治療。在Ⅱ期臨床中����,依沃西單抗聯(lián)合化療在這類患者中達(dá)到68.4%的客觀緩解率(ORR)����,疾病控制率(DCR)為94.7%�,中位無進(jìn)展生存期(PFS)為8.2個(gè)月,6個(gè)月PFS率為69.3%����。
國際藥訊
1.羅氏TIGIT單抗聯(lián)合治療肺癌Ⅲ期臨床積極�。羅氏旗下基因泰克TIGIT抗體tiragolumab聯(lián)合PD-L1抑制劑Tecentriq(atezolizumab)一線治療PD-L1高表達(dá)的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌的Ⅲ期試驗(yàn)SKYSCRAPER-01最新結(jié)果積極。中位隨訪為15.5個(gè)月時(shí)��,聯(lián)合治療較Tecentriq單藥改善患者的總生存期(中位OS:22.9個(gè)月vs16.7個(gè)月;HR:0.81)�,聯(lián)合療法的耐受性良好。目前數(shù)據(jù)尚未成熟�。
2.恩扎盧胺聯(lián)合治療nmCSPC獲優(yōu)先審評(píng)資格。輝瑞與安斯泰來開發(fā)的特異性雄激素受體(AR)抑制劑Xtandi(enzalutamide��,恩扎盧胺)獲FDA授予優(yōu)先審評(píng)資格��,用于治療非轉(zhuǎn)移性去勢敏感性前列腺癌(nmCSPC)患者����。在Ⅲ期EMBARK試驗(yàn)中,與安慰劑+亮丙瑞林組患者相比����,Xtandi+亮丙瑞林組患者的無轉(zhuǎn)移生存期(MFS)明顯改善����,其轉(zhuǎn)移或死亡風(fēng)險(xiǎn)統(tǒng)計(jì)學(xué)顯著降低58%(HR:0.42;95% CI:0.30-0.61��;p<0.0001)����。
3.眼科AAV2基因療法歐盟獲批臨床。ViGeneron GmbH公司AAV2基因療法VG901獲歐洲藥品管理局(EMA)臨床許可��,擬開發(fā)用于治療CNGA1相關(guān)的視網(wǎng)膜色素變性癥(RP)�。VG901通過玻璃體內(nèi)注射(IVT)遞送CNGA1基因�,降低了視網(wǎng)膜損傷風(fēng)險(xiǎn)����。在臨床前研究中����,VG901已顯示出可補(bǔ)充RP小鼠模型CNGA1基因的潛力,而且單次玻璃體內(nèi)注射給藥��,VG901具有良好的安全性��。
4.AZ布局強(qiáng)效mRNA貼片疫苗�。阿斯利康與Vaxess公司將利用后者M(jìn)IMIX緩釋貼片技術(shù),合作開發(fā)季節(jié)性流感RNA疫苗貼片�。這種新型疫苗可通過耐儲(chǔ)的皮膚貼片上的微針而非注射的方式給藥�,有利于未來在流感大流行時(shí)疫苗的分發(fā)和普及����。這種微針貼片是用蠶絲蛋白尖端制成的,可在皮膚中溶解以產(chǎn)生更持久��、強(qiáng)效的免疫反應(yīng)。此次合作交易金額高達(dá)1030萬美元��。
5.拜耳宣布制藥部門新的人事任命����。8月22日,拜耳宣布新的人事任命�,原拜耳執(zhí)行副總裁(EVP)兼“拜耳飛躍計(jì)劃(Leaps by Bayer)”負(fù)責(zé)人Juergen Eckhardt將任職拜耳制藥部業(yè)務(wù)發(fā)展和許可/開放創(chuàng)新(BDL/OI)總監(jiān)����。Juergen Eckhardt將向拜耳制藥部總裁Stefan Oelrich直接匯報(bào)�。此外,Juergen Eckhardt仍然擔(dān)任拜耳飛躍計(jì)劃負(fù)責(zé)人�,并向董事長Bill Anderson匯報(bào)。
醫(yī)藥熱點(diǎn)
1.第四批鼓勵(lì)研發(fā)申報(bào)兒童藥品清單公布��。為進(jìn)一步做好保障兒童用藥工作����,促進(jìn)兒童適宜品種��、劑型����、規(guī)格的研發(fā)創(chuàng)制和申報(bào)審評(píng),國家衛(wèi)健委會(huì)同科技部����、工業(yè)和信息化部、國家醫(yī)保局和國家藥監(jiān)局����,通過組織專家遴選����、社會(huì)公示等,研究制定《第四批鼓勵(lì)研發(fā)申報(bào)兒童藥品清單》�。第四批清單有24個(gè)品種,涉及30個(gè)品規(guī)�、9種劑型,覆蓋神經(jīng)系統(tǒng)用藥�、消化道和新陳代謝用藥、抗腫瘤藥及免疫調(diào)節(jié)劑等治療領(lǐng)域��。
2.河北醫(yī)科大學(xué)建設(shè)新校區(qū)�。近日,河北醫(yī)科大學(xué)新校區(qū)一期建設(shè)項(xiàng)目環(huán)境影響評(píng)審公示�,項(xiàng)目位于河北省石家莊正定新區(qū),夢龍街以東,太行北大街以西��,安濟(jì)路以南�,華光路以北。新校區(qū)總用地面積為1160畝�,總建筑面積為48.9萬平方米。新校區(qū)項(xiàng)目將分兩期進(jìn)行建設(shè)��,其中一期項(xiàng)目總投資估算達(dá)到314000萬元����。
3.2023年國家醫(yī)?;痫w行檢查啟動(dòng)。8月23日����,2023年全國醫(yī)保基金飛行檢查正式在貴州畢節(jié)市啟動(dòng)��。本次飛行檢查將重點(diǎn)聚焦于醫(yī)學(xué)影像檢查�、臨床檢驗(yàn)、康復(fù)三個(gè)領(lǐng)域納入醫(yī)保基金支付范圍的醫(yī)療服務(wù)行為和醫(yī)療費(fèi)用。針對定點(diǎn)零售藥店�,主要檢查是否存在違規(guī)刷卡�、偽造信息、串換收費(fèi)����、為非定點(diǎn)機(jī)構(gòu)結(jié)算醫(yī)保費(fèi)用等行為�。針對醫(yī)保經(jīng)辦機(jī)構(gòu),主要檢查對定點(diǎn)醫(yī)藥機(jī)構(gòu)和參保人申報(bào)的費(fèi)用日常審核��、支付以及核查情況��,DRG/DIP付費(fèi)方式下年度預(yù)算額度確定情況��,智能審核系統(tǒng)使用情況等。
評(píng)審動(dòng)態(tài)
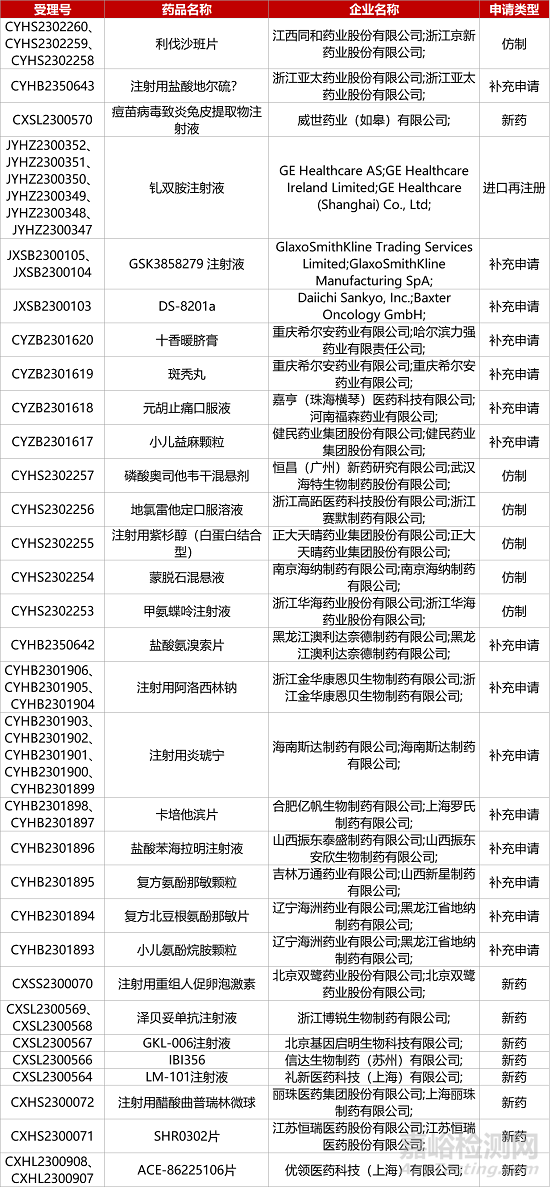
1. CDE新藥受理情況(08月24日)
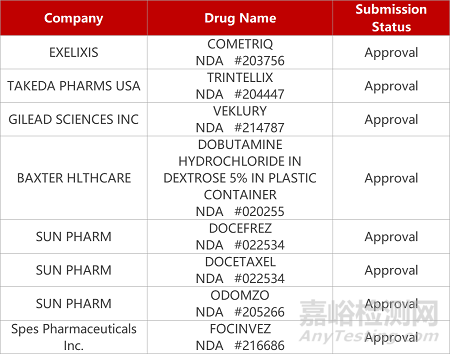
2. FDA新藥獲批情況(北美08月23日)