摘要
目的:分析我國與美國血液系統(tǒng)抗腫瘤新藥上市情況�����、藥品特點及差異�����,為我國醫(yī)藥管理、新藥研發(fā)和審評審批提供參考�����。
方法:檢索美國食品和藥物管理局(FDA)網(wǎng)站和我國國家藥品監(jiān)督管理局網(wǎng)站及相關藥品說明書,收集美國1997—2021年�����、我國1999—2021年批準上市的血液系統(tǒng)抗腫瘤新藥�����,提取藥品名稱�����、批準類型�����、批準日期�����、加速上市注冊程序、藥品作用機制及適應證等信息�����,并分析兩國新藥審評審批情況和時效性�����,以及不同類別藥品的批準數(shù)量�����。
結果:1997—2021年�����,美國共批準69個血液系統(tǒng)抗腫瘤新藥�����,新分子實體和新生物制品分別為42個、27個�����,65個藥品通過加速上市注冊程序獲批�����。1999—2021年�����,我國共批準36個血液系統(tǒng)抗腫瘤新藥�����,化藥、生物制品和中藥分別為24個�����、11個和1個�����,25個藥品的獲批使用加速上市程序�����。兩國上市藥品數(shù)量在2017—2021年明顯增多�����,美國30個新藥中26個(87%)為全球首批�����,我國25個新藥中8個(32%)為全球首批新藥,17個國外首批新藥的獲批時間平均遲于美國6年�����。我國批準的血液系統(tǒng)抗腫瘤化藥已覆蓋多個作用機制靶點�����,與美國批準的新分子實體靶點較為接近�����,可用于治療多類血液系統(tǒng)腫瘤;但生物制品靶點與美國相比仍較為局限�����,主要用于淋巴組織腫瘤�����,未有用于髓系腫瘤的藥品�����,且種類較顯單一。2017—2021年�����,我國17個批準上市且已在美國獲批的血液系統(tǒng)抗腫瘤新藥中�����,僅6個藥品的適應證與美國相同�����,1個藥品的適應證多于美國。
結論:我國近年來血液系統(tǒng)抗腫瘤新藥批準數(shù)量有了明顯提升�����,多種藥品加快上市注冊程序已用于新藥審評審批�����,批準新藥靶點類型增多�����,但新藥審評審批時效性和國產(chǎn)藥品的國際影響力仍有待增強�����,相關研發(fā)應避免靶點單一聚集,注重藥品新適應證和新聯(lián)合治療方案探索�����。
關鍵詞
血液腫瘤�����;抗腫瘤藥�����;生物制品�����;化學藥品;新藥上市情況
近年來�����,抗腫瘤制藥領域進展迅速,腫瘤治療從細胞毒性藥物治療時代進入了以細胞遺傳學�����、分子生物學�����、免疫學為基礎的靶向治療和免疫治療時代�����。血液系統(tǒng)腫瘤是最早使用靶向藥物治療的疾病?����?鼓[瘤新藥的不斷問世,極大地改善了血液系統(tǒng)腫瘤的治療效果�����,患者5年生存率提高�����,總生存期延長[1]。加速創(chuàng)新藥品研發(fā)�����,已經(jīng)成為全球的共識�����。我國是全球第二大處方藥市場�����,隨著腫瘤發(fā)病率的不斷攀升�����,對腫瘤藥尤其是抗腫瘤新藥的需求也日漸增加�����。我國已成為制藥大國�����,但離制藥強國尚有一定差距�����。近年來�����,我國在醫(yī)藥領域進行了一系列重大改革�����,對新藥研發(fā)�����、審批、臨床應用產(chǎn)生巨大影響�����。本文對1997—2021年美國食品和藥物管理局(FDA)與1999—2021年我國批準的血液系統(tǒng)抗腫瘤新藥相關信息進行匯總分析�����,探討兩國上市藥品的不同特點并提出相關建議�����,旨在為我國醫(yī)藥改革背景下醫(yī)藥管理�����、新藥研發(fā)、臨床用藥提供參考�����。
資料與方法
資料來源
以美國FDA網(wǎng)站Drugs@FDA數(shù)據(jù)庫[2]和美國藥品審評和研究中心(CDER)新藥年度審評報告[3]為美國批準上市血液系統(tǒng)抗腫瘤新藥的主要數(shù)據(jù)來源�����,檢索時間為1997—2021年�����。以國家藥品監(jiān)督管理局(藥監(jiān)局)[4]網(wǎng)站的公開數(shù)據(jù)庫為我國血液系統(tǒng)抗腫瘤新藥的主要數(shù)據(jù)來源,檢索時間為1999—2021年�����。
研究方法和數(shù)據(jù)收集
檢索美國FDA網(wǎng)站數(shù)據(jù)庫、CDER新藥年度審評報告和其他文獻[5, 6]以及我國藥監(jiān)局網(wǎng)站的公開數(shù)據(jù)庫�����、年度藥品審評報告來獲取藥品批準上市信息�����,提取藥品名稱�����、批準類型�����、批準日期等信息。根據(jù)美國的孤兒藥認定和4種加快上市注冊程序[7-9](快速通道認定�����、突破性療法認定�����、優(yōu)先審評認定和加速審批程序)以及我國的3種加快上市注冊程序[10](突破性治療藥物程序�����、附條件批準程序�����、優(yōu)先審評審批程序)�����,記錄美國血液系統(tǒng)抗腫瘤新藥是否通過孤兒藥認定、是否為首創(chuàng)性新藥以及兩國新藥審評審批是否采用加快上市注冊程序�����,分析兩國血液系統(tǒng)抗腫瘤新藥的審評審批情況及時效性。
根據(jù)血液系統(tǒng)抗腫瘤新藥最后更新的說明書(截至2021年12月)�����,獲取藥品作用機制及適應證相關信息�����,對不同作用機制和作用靶點新藥進行分類�����,分析不同類別藥品的批準數(shù)量。根據(jù)2016年世界衛(wèi)生組織(WHO)造血及淋巴組織腫瘤的分類標準[11, 12]對血液系統(tǒng)腫瘤進行分類�����,分析兩國用于急性髓系白血病�����、骨髓增殖性腫瘤�����、骨髓增生異常綜合征、前驅(qū)淋巴性腫瘤�����、霍奇金淋巴瘤、B細胞淋巴瘤�����、漿細胞腫瘤�����、T細胞淋巴瘤等疾病的血液系統(tǒng)抗腫瘤新藥種類和數(shù)量。
結果
新藥上市情況
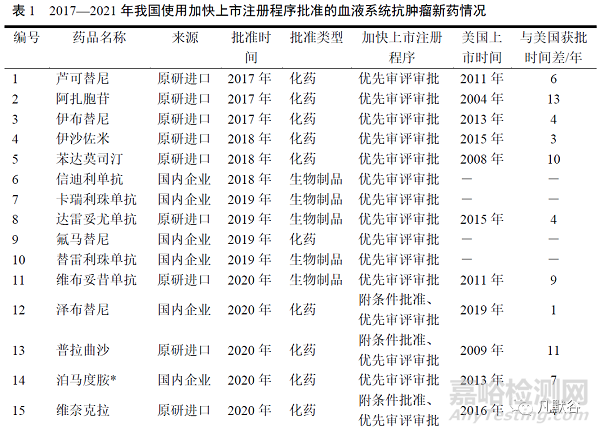
自1997年抗CD20單抗利妥昔單抗被批準上市�����,至2021年�����,美國FDA共批準血液系統(tǒng)抗腫瘤新藥69個。69個新藥中有3個以其他適應證首批上市�����,之后批準用于血液系統(tǒng)腫瘤�����。藥品批準數(shù)量呈逐年上升趨勢�����,1997—2001年、2002—2006年�����、2007—2011年�����、2012—2016年新藥獲批數(shù)量分別為6個�����、9個�����、8個和16個�����,而2017—2021年獲批新藥達30個�����。69個新藥均被認定為孤兒藥,其中32個為首創(chuàng)性新藥�����,占46%�����。
我國自1999年三氧化二砷批準上市起�����,至2021年共批準36個血液系統(tǒng)抗腫瘤新藥上市。1999—2001年�����、2002—2006年�����、2007—2011年、2012—2016年新藥獲批數(shù)量分別為2個�����、2個、5個和2個�����,而2017—2021年�����,我國獲批新藥數(shù)量有了明顯提升,共25個�����,其中我國國產(chǎn)新藥10個�����,9個為1類新藥�����。
新藥審評審批情況
美國批準上市的69個血液系統(tǒng)抗腫瘤新藥中,有65個通過不同的加快上市注冊程序加快新藥研發(fā)和審評審批�����,其中通過快速通道認定的藥品38個(55%)�����,優(yōu)先審評認定的藥品58個(84%)�����,加速審批程序的藥品36個(52%)。美國FDA于2012年設置突破性療法認定�����,在2012—2021年美國FDA批準的46個血液系統(tǒng)抗腫瘤藥中,有22個(48%)藥品獲得突破性療法認定�����。對藥品使用加快上市注冊程序的數(shù)量進行分析,使用2種加快上市注冊程序獲批的新藥數(shù)量最多(26個)�����,使用3種加快上市注冊程序的有24個�����,使用4種、1種和未使用加快上市注冊程序獲批的新藥較少�����,分別為5個�����、10個和4個�����。
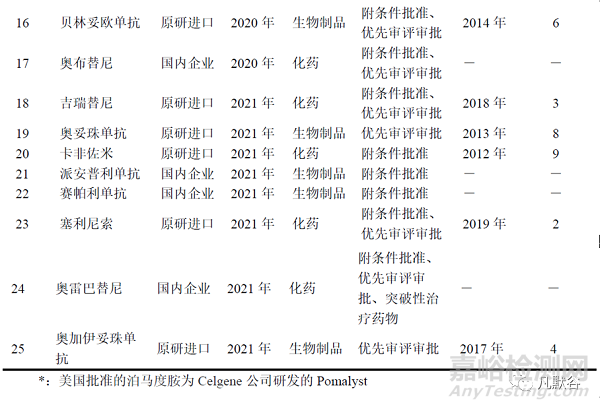
我國在2016年—2020年逐步建立藥品加快上市注冊制度�����。2017—2021年批準的25個血液系統(tǒng)抗腫瘤新藥中�����,22個(88%)藥品使用優(yōu)先審評認定程序。2020—2021年批準的15種血液系統(tǒng)抗腫瘤新藥中�����,11個(73%)藥品使用附條件批準程序�����。奧雷巴替尼(olverembatinib)在2021年獲批當年還因使用突破性治療藥物程序得以加快上市�����。25個藥品中,使用1種加快上市注冊程序獲批的新藥數(shù)量最多(17個)�����,使用2種�����、3種加快上市注冊程序的分別為7個和1個�����,見表1�����。
上市新藥時效性對比
美國2017—2021年批準上市的30個新藥中�����,26個(87%)為全球首批。我國2017—2021年批準上市的25個新藥中�����,信迪利單抗�����、卡瑞利珠單抗、氟馬替尼�����、替雷利珠單抗、奧布替尼�����、派安普利單抗、賽帕利單抗�����、奧雷巴替尼等8個(32%)國產(chǎn)創(chuàng)新藥為全球首批,17個藥品在國外獲得全球首批�����,其中15個藥品于美國獲得全球首批(除奧加伊妥珠單抗�����、吉瑞替尼在美國獲批當年先于歐洲�����、日本首批)�����。17個新藥在我國的獲批時間平均遲于美國6年。見表1�����。
上市新藥靶點分析
美國評審新藥類型主要為新分子實體和新生物制品�����。1997—2021年美國FDA批準上市的血液系統(tǒng)抗腫瘤新藥中,以新分子實體批準的藥品42個�����,以新生物制品批準的藥品27個�����,新分子實體數(shù)量大于新生物制品。我國評審新藥類型主要為化藥�����、生物制品�����、中藥。1999—2021年我國批準上市的血液系統(tǒng)新型抗腫瘤藥中�����,化藥24個�����,生物制品11個�����,中藥1個�����。獲批的化藥數(shù)量也遠大于生物制品。
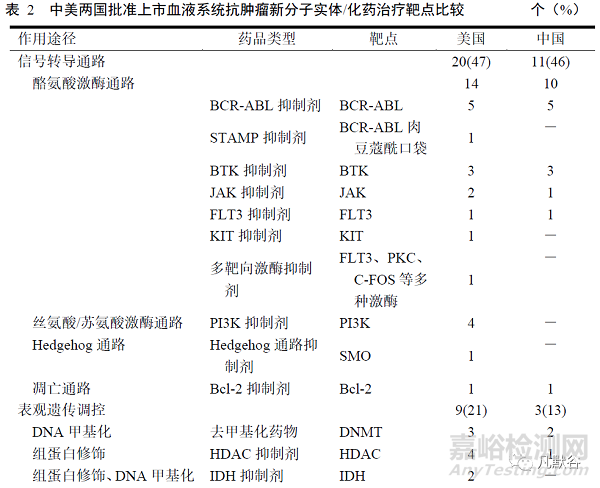
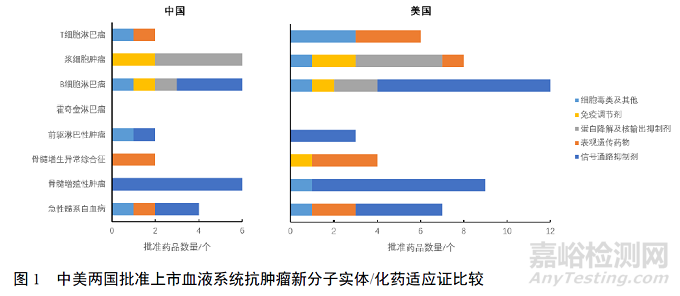
美國批準上市的血液系統(tǒng)抗腫瘤新分子實體以分子靶向藥為主�����,通過抑制信號轉(zhuǎn)導通路�����、表觀遺傳學調(diào)控和蛋白質(zhì)水平調(diào)控等機制發(fā)揮作用�����,其中以信號轉(zhuǎn)導通路蛋白為靶點的藥品最多,共14個�����,涉及10余個不同靶點�����。2012年之前批準的藥品僅為靶向BCR-ABL和JAK的酪氨酸激酶抑制劑,2012年之后靶點更為多元;其次是作用于表觀遺傳學相關靶點的藥品�����,共9個。
盡管我國批準上市的血液系統(tǒng)新型抗腫瘤藥數(shù)量低于美國�����,但從作用靶點來看�����,我國批準的化藥與FDA批準的新分子實體差距已不大。在我國批準的血液系統(tǒng)新型抗腫瘤化藥中�����,數(shù)量最多的也是以信號轉(zhuǎn)導通路蛋白為靶點的藥品�����,2017年后批準上市的藥品靶點更為多元�����。見表2。
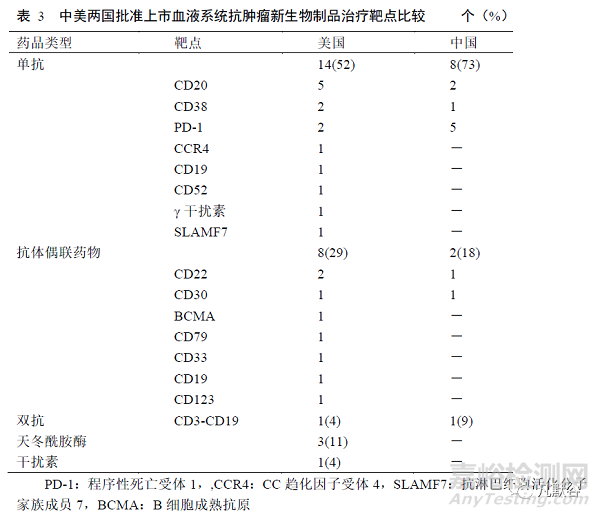
美國批準上市的血液系統(tǒng)抗腫瘤新生物制品包括單克隆抗體(單抗)�����、抗體偶聯(lián)藥物(ADC)�����、雙特異性抗體(雙抗)等�����,其中單抗類藥品最多�����,共14個;其次為ADC�����,共8個�����。10個單抗類藥品靶點主要為腫瘤細胞表面特異性白細胞分化抗原�����,藥品可通過作用于腫瘤細胞發(fā)揮作用�����。2012—2021年�����,作用于其他靶點的單抗如γ干擾素(γ干擾素單抗)、骨髓瘤細胞和自然殺傷(NK)細胞表面SLAMF7(SLAMF7單抗)�����、免疫檢查點抑制劑[程序性死亡受體(PD)-1單抗]等新藥陸續(xù)獲批上市�����,還批準了利用雙特異性T細胞連接蛋白(BiTE)同時靶向B細胞和T細胞的CD3-CD19雙抗上市�����;ADC批準數(shù)量也明顯增加。對于大分子生物制品�����,我國盡管已有單抗�����、雙抗�����、ADC上市�����,但目前生物制品上市新藥中PD-1單抗占據(jù)主要地位,其他靶點新藥仍較為局限�����。見表3�����。
上市新藥適應證分析
美國批準上市的新分子實體中�����,用于B細胞淋巴瘤的藥品數(shù)量最多(12個)�����,其次為骨髓增殖性腫瘤(9個)�����。我國批準上市的血液系統(tǒng)新型抗腫瘤化藥用于骨髓增殖性腫瘤�����、B細胞淋巴瘤和漿細胞腫瘤的藥品數(shù)量最多�����,均為6個�����。兩國血液系統(tǒng)腫瘤的新分子實體與化藥的用藥結構較為接近�����,信號轉(zhuǎn)導通路抑制劑主要用于骨髓增殖性腫瘤�����、B細胞淋巴瘤和急性髓系白血病�����;表觀遺傳藥物主要用于急性髓系白血病�����、骨髓增生異常綜合征等髓系腫瘤及T細胞淋巴瘤�����,美國還批準用于漿細胞腫瘤。從蛋白水平進行調(diào)控的蛋白酶體抑制劑和核輸出抑制劑目前僅局限于漿細胞腫瘤和B細胞淋巴瘤�����。見圖1。
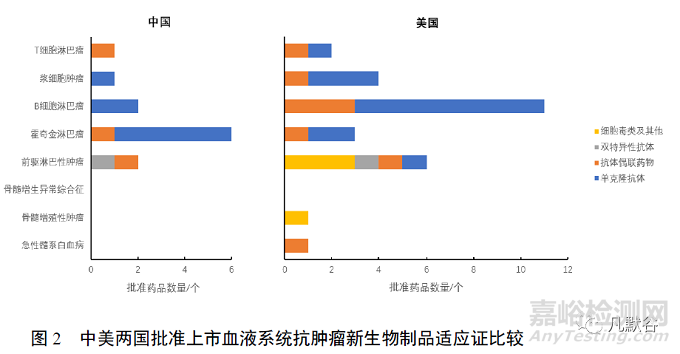
美國批準上市的新生物制品主要用于淋巴組織腫瘤�����,包括B細胞淋巴瘤、漿細胞腫瘤�����、霍奇金淋巴瘤�����、T細胞淋巴瘤等�����,且以單抗類藥品為主�����。批準用于前驅(qū)淋巴性腫瘤的新生物制品較為多元,雖主要為天冬酰胺酶�����,但還包括ADC�����、雙抗類等突破性和首創(chuàng)性新藥�����。用于髓系腫瘤的新生物制品僅有2個�����,遠不及淋巴組織腫瘤�����。我國批準上市的血液系統(tǒng)新型抗腫瘤生物制品主要用于淋巴組織腫瘤�����,未有用于髓系腫瘤的藥品,且藥品以單抗類藥品為主�����,PD-1單抗占5種,種類較顯單一�����。見圖2�����。
盡管部分藥品在我國和美國均有上市�����,但是適應證存在一定差異。2017—2021年我國批準上市的血液系統(tǒng)抗腫瘤新藥中有17個藥品已在美國上市�����,對比說明書發(fā)現(xiàn)6個藥品(阿扎胞苷、伊沙佐米�����、普拉曲沙�����、泊馬度胺�����、吉瑞替尼�����、奧加伊妥珠單抗)兩國適應證相同�����。澤布替尼在我國批準的適應證疾病譜多于美國�����,4個藥品(蘆可替尼�����、伊布替尼、苯達莫司汀�����、貝林妥歐單抗)在美國批準的適應證疾病譜多于我國,卡非佐米在美國批準的適應證藥品聯(lián)合用藥多于我國�����,5個藥品(達雷妥尤單抗�����、維布妥昔單抗�����、維奈克拉�����、奧妥珠單抗�����、塞利尼索)在美國批準的適應證疾病譜和藥品聯(lián)合用藥均多于我國。
討論
近年來�����,小分子化學靶向藥和大分子生物藥等療效確切的抗腫瘤新藥陸續(xù)上市�����,改變了血液系統(tǒng)腫瘤的治療策略�����,抗腫瘤藥成為目前新藥研發(fā)焦點�����。本研究結果顯示�����,中美兩國血液系統(tǒng)抗腫瘤新藥批準數(shù)量均有明顯提升�����,多種藥品通過加快上市注冊程序獲批�����,批準新藥靶點類型增多,為臨床提供多種選擇�����。
美國FDA在創(chuàng)新藥審評上制度較為完善,其使用多種調(diào)控途徑加速藥品審評審批[13, 14]�����。我國參考國際經(jīng)驗�����,也陸續(xù)設立加快上市注冊程序�����,覆蓋從藥品研發(fā)到上市監(jiān)管的全生命周期[10]。本研究發(fā)現(xiàn)�����,1997至2021年�����,美國FDA批準血液系統(tǒng)抗腫瘤新藥數(shù)量呈現(xiàn)明顯上升趨勢�����,所批準新藥全部通過孤兒藥認定�����,大多數(shù)藥品通過2~3種加快通道獲批上市�����。2017年以來�����,我國批準上市血液系統(tǒng)新型抗腫瘤新藥大多數(shù)通過加快上市注冊程序獲批�����,上市數(shù)量明顯提升�����。加速藥品審評審批途徑在保證藥品安全性和有效性的同時�����,有助于縮短新藥上市時間,使患有嚴重疾病的患者盡快獲得新療法�����,提升了藥品的可及性[15]。但也應看到�����,我國的血液系統(tǒng)抗腫瘤新藥仍多為進口原研藥�����,在審批上市的時效性方面與美國仍有一定的差距�����。
我國新藥加快審評審批政策仍處于起步階級�����,因此,在推進我國新藥審評審批速度的同時�����,應在執(zhí)行過程中不斷完善所存在的不足之處,主要有以下幾個方面:(1)注重藥品研發(fā)審評全流程管理。(2)完善審評審批流程�����,確保審評審批時長。(3)加強審評審批人員�����、制藥企業(yè)�����、學術機構�����、醫(yī)院、患者等利益相關方的溝通�����,提升新藥審評的公開性和合理性�����。(4)健全審評審批機構的監(jiān)管與服務職能�����,保障新藥的有效性和安全性。(5)定期回顧性分析加快審評審批政策的具體執(zhí)行情況�����,不斷完善政策法規(guī)�����。
血液系統(tǒng)腫瘤是最早使用靶向藥物治療的疾病�����,新藥極大地改善了患者預后�����,顛覆了多種血液系統(tǒng)腫瘤的傳統(tǒng)治療方案[16, 17]�����。本研究結果顯示�����,在美國和我國批準的新分子實體/化藥中�����,信號轉(zhuǎn)導通路抑制劑數(shù)量最多�����。兩國前期批準上市的信號轉(zhuǎn)導通路抑制劑主要為以BCR-ABL�����、JAK等為靶點的酪氨酸激酶抑制劑,以治療骨髓增殖性腫瘤�����。隨著對多條信號轉(zhuǎn)導通路研究的深入�����,美國上市藥品的靶點涉及到如絲氨酸/蘇氨酸激酶通路�����、Hedgehog通路�����、凋亡通路等其他通路�����。BCR-ABL酪氨酸激酶抑制劑、表觀遺傳藥物�����、蛋白酶體抑制劑等較早用于血液系統(tǒng)腫瘤�����,但仍不斷有新藥被批準上市�����,通過對藥品的升級�����、改變用藥途徑或選用更為精準的靶點,解決了治療中的耐藥問題�����,提高了患者依從性�����。盡管我國批準的血液系統(tǒng)新型抗腫瘤藥數(shù)量低于美國�����,但從藥品作用靶點來看�����,我國批準的血液系統(tǒng)新型抗腫瘤化藥與美國批準的新分子實體的結構差距已逐漸縮小�����。
本研究結果還顯示,美國批準上市的新生物制品主要以單抗�����、ADC為主�����,藥品的靶點主要為腫瘤細胞表面特異性抗原�����。血液系統(tǒng)腫瘤的腫瘤細胞呈克隆性增殖�����,且不同途徑用藥�����,藥品均易到達腫瘤部位,而新生物制品因靶向腫瘤特異性抗原的藥品更易發(fā)揮直接作用。2012年后�����,更多類型的靶點被用于單抗類藥品[18]�����,ADC�����、雙抗也成為研發(fā)熱點�����,藥品的作用機制和靶點更為多元�����,作用更為精準。我國批準上市的生物制品主要為單抗�����,且以PD-1單抗為主�����,其他靶點新藥較為局限�����,藥品上市數(shù)量、類型及自主研發(fā)能力仍有待提高�����。
中美兩國批準的新藥適用于不同類型的血液系統(tǒng)腫瘤�����,涉及的疾病較廣�����。部分新藥目前已躋身于一線治療,通過與化療聯(lián)合�����、單一用藥、多種不同靶點新藥聯(lián)合等方式治療血液系統(tǒng)腫瘤�����,如在慢性髓系白血病�����、慢性淋巴細胞白血病/小淋巴細胞淋巴瘤[19]�����、多發(fā)性骨髓瘤[20]中�����,新藥的出現(xiàn)使一線治療中細胞毒類抗腫瘤藥的使用減少,為腫瘤的“慢病化管理”提供了可能�����。部分新藥被批準用于復發(fā)難治性患者�����,為患者提供了更多的治療機會�����。本研究結果顯示�����,用于淋巴系統(tǒng)腫瘤的新藥多于髓系腫瘤�����,期待未來有更多的新藥用于髓系腫瘤�����。
在腫瘤領域,我國對新藥的臨床需求較大�����。目前,我國創(chuàng)新藥研發(fā)還主要為“fast follow”模式�����,可理解為快速追蹤新藥的模仿性創(chuàng)新模式,通過布局已有臨床驗證�����、風險相對較小且較為成熟的靶點,我國的制藥企業(yè)迅速向創(chuàng)新型企業(yè)轉(zhuǎn)型�����,但如果在這一過程中靶點扎堆,則可能面臨市場的激烈爭奪和價格戰(zhàn)�����。為此,我國藥品審評中心于2021年11月發(fā)布《以臨床價值為導向的抗腫瘤藥物臨床研發(fā)指導原則》�����,提出新藥研發(fā)應以為患者提供更優(yōu)(更有效�����、更安全或更便利等)的治療選擇作為更高目標,明確指出了“對照藥”是體現(xiàn)新藥臨床價值的基礎�����,應該關注陽性對照藥是否反映和代表了臨床實踐中目標患者的最佳治療選擇。
隨著我國血液系統(tǒng)抗腫瘤新藥審批速度的提升,我國臨床指南的更新速度不斷加快�����,并日趨與國際接軌�����,極大改善了臨床診療�����,使患者獲益�����。國家醫(yī)保談判大大提升了藥品的可及性和可負擔性�����。但也應當看到�����,我國血液系統(tǒng)抗腫瘤新藥的獲批時效與美國仍有一定差距�����,新藥的適應證也較為單一�����。未來,在新藥審評中�����,還應密切結合我國血液系統(tǒng)腫瘤的臨床特點�����,加快臨床急需新藥的上市�����。另外�����,應重視藥品適應證的拓展�����、聯(lián)合治療方案及個體化治療的探索�����,發(fā)揮藥品的最大效能。
來源:《中國新藥與臨床雜志》2023年