注射用微球無菌檢查既要關(guān)注“球外無菌”又要關(guān)注“球內(nèi)無菌”�,而檢測的難點(diǎn)是“球內(nèi)無菌”�,即微球內(nèi)部的無菌性檢查���。該研究在調(diào)研注射用微球生產(chǎn)工藝的基礎(chǔ)上��,選擇代表性品種���,模擬潛在微生物污染物存在條件下的微球溶解過程,建立了2種內(nèi)部無菌檢查方法:一是采用二甲基亞砜(DMSO) 溶解微球��;二是采用pH 10.0緩沖液溶解微球�。2種方法制備的無菌檢查供試液均以細(xì)菌耐受性芽孢作為試驗(yàn)菌,采用直接接種法進(jìn)行無菌檢查���,并探討供試液制備�、試驗(yàn)用菌株�、方法適用性等關(guān)鍵技術(shù)環(huán)節(jié)的科學(xué)性和合理性。該研究是注射用微球無菌檢查方法開發(fā)和驗(yàn)證策略的有益探索���,可為此類藥物制劑的質(zhì)量控制和標(biāo)準(zhǔn)提高提供研究思路和數(shù)據(jù)支撐���。
隨著制藥工業(yè)的發(fā)展,為適應(yīng)疾病的治療或預(yù)防需要而采用的藥物劑型層出不窮[1—2]�。藥物與適宜載體(生物可降解材料) 經(jīng)過一定的分散包埋技術(shù)制得的微米或納米級固態(tài)����、液態(tài)或氣態(tài)藥物�,包括微囊、微球��、微晶���、脂質(zhì)體和納米粒等����,稱為微粒制劑�����,其中注射用微球是應(yīng)用最廣泛的微粒制劑之一��。從國家藥品監(jiān)督管理局網(wǎng)站上可查詢到30余個(gè)注射用微球的進(jìn)口�����、國產(chǎn)品種的批準(zhǔn)文號���,代表性品種有注射用醋酸亮丙瑞林微球����、注射用利培酮微球����、注射用醋酸奧曲肽微球、注射用全氟丁烷微球等�。這些品種的質(zhì)量控制和分析方法備受關(guān)注,其中無菌檢查法的科學(xué)性和合理性是其關(guān)注的重要內(nèi)容�����。
關(guān)于微粒制劑的質(zhì)量控制�����,美國藥典(USP42)<71>���、歐洲藥典(EP 11.0)<2.6.1>�、日本藥典(JP18)<4.06> 等均未單獨(dú)收載通用性技術(shù)要求的章節(jié)���,僅在制劑通則中對處方設(shè)計(jì)和制備工藝進(jìn)行了介紹性說明���,未涉及微生物檢查方法的特殊規(guī)定�����;美國注射劑協(xié)會(PDA) 技術(shù)報(bào)告����、人用藥品技術(shù)要求國際協(xié)調(diào)理事會(ICH) 指導(dǎo)原則中也未涉及相關(guān)規(guī)范性要求�;《中華人民共和國藥典》2010 年版(ChP2010) 附錄首次收載《微球、微囊和脂質(zhì)體制劑指導(dǎo)原則》�,ChP 2015 修訂為《微粒制劑指導(dǎo)原則》(通則9014),一直沿用至ChP 2020���。通則9014 中對于藥物載體類型����、常用輔料載體和質(zhì)量控制的檢查項(xiàng)目等進(jìn)行了規(guī)定�,但未對微生物質(zhì)量控制提出明確的技術(shù)要求[3]。
目前����,注射用微球品種標(biāo)準(zhǔn)中無菌項(xiàng)下規(guī)定主要分為3類�。
①指向通則,未規(guī)定具體操作方法,如:取本品�,加所附的助懸劑制成混懸液,依照無菌檢查法進(jìn)行檢查���,應(yīng)符合規(guī)定����。
②指向通則�����,規(guī)定了具體操作方法��,如:取本品����,每支按說明書,用所附的注射器和針頭���,加入所附的溶劑使分散均勻�,采用直接接種法����,取每支全量接種至培養(yǎng)基50 ml中�,以金黃色葡萄球菌為陽性對照�,依照無菌檢查法進(jìn)行檢查,應(yīng)符合規(guī)定���。
③規(guī)定分別進(jìn)行微球內(nèi)部和外部的無菌性檢查�����,如:取本品���,分別溶解于相應(yīng)培養(yǎng)基2 ml 中,過濾�,以金黃色葡萄球菌為陽性對照菌,進(jìn)行外部無菌檢查���;取本品�����,分別溶解于無菌二甲基亞砜(DMSO)2 ml 中����,過濾����,且每膜過濾體積不超過10 ml,以金黃色葡萄球菌為陽性對照菌�,進(jìn)行內(nèi)部無菌檢查。
注射用微球無菌檢查的難點(diǎn)聚焦在“球內(nèi)無菌”�,即微球內(nèi)部的無菌性檢查[4]。一般而言��,產(chǎn)品采用終端滅菌工藝�,且粒度分布小于微生物污染物,生產(chǎn)工藝過程中微生物不易存在或不易存在于制劑內(nèi)部的����,進(jìn)行微球外部無菌性檢查;產(chǎn)品采用無菌生產(chǎn)工藝�,但粒度分布大于或類似于微生物污染物,在生產(chǎn)過程可能存在潛在污染風(fēng)險(xiǎn)時(shí)����,應(yīng)分別進(jìn)行微球內(nèi)部和外部的無菌性檢查。
經(jīng)調(diào)研�,大部分注射用微球采用無菌生產(chǎn)工藝,以聚乳酸- 羥基乙酸共聚物(PLGA) 作為輔料[5—6]�,與原料混合后,在密閉系統(tǒng)中包裹形成制劑���,生產(chǎn)過程涉及二氯甲烷����、乙酸等有機(jī)溶劑[7],這種條件不利于微生物的生長和存活�,但存在耐受性芽孢的污染風(fēng)險(xiǎn)。代表性品種( 如注射用醋酸奧曲肽微球等) 在進(jìn)行微球內(nèi)部無菌檢查時(shí)�,采用DMSO 作為溶劑制備供試液,但高濃度DMSO 具有抑菌作用����,是否影響無菌檢查方法的適用性和有效性尚待評估。此外����,在某些品種( 如注射用利培酮微球) 的方法建立過程中,曾對其生產(chǎn)工藝各環(huán)節(jié)進(jìn)行風(fēng)險(xiǎn)評估���,認(rèn)為涉及的無菌操作均在微球硬化之后����,潛在的污染物僅可能存在于外表面����,故在標(biāo)準(zhǔn)變更時(shí)取消了內(nèi)部無菌檢查���。上述評估的規(guī)范性如何在藥品標(biāo)準(zhǔn)中進(jìn)行通用性技術(shù)規(guī)定,尚未進(jìn)行深入探討���。
本研究選擇注射用醋酸亮丙瑞林微球、注射用利培酮微球�、注射用醋酸奧曲肽微球等國內(nèi)外代表性品種,聚焦微球內(nèi)部的無菌性檢查����,考察供試液制備、試驗(yàn)用菌株����、檢查方法等關(guān)鍵技術(shù)環(huán)節(jié)的科學(xué)性和合理性,以期為注射用微球無菌檢查方法的建立和藥品標(biāo)準(zhǔn)的制定和修訂提供研究思路和數(shù)據(jù)支撐�。
1、儀器與試藥
Phenom Nano 型掃描電鏡( 荷蘭Phenom 公司) ����;Supro150 型濺射儀[ 復(fù)納科學(xué)儀器(上海) 有限公司] ;MIR254型恒溫培養(yǎng)箱(日本Panasonic 公司) �;FOM4/9 型高壓蒸汽滅菌器(意大利Fedegari 公司) ;Steritest Equinox 型集菌儀和Milliflex 型薄膜過濾系統(tǒng)均購自德國Merck-Millipore公司�����。
注射用醋酸亮丙瑞林微球(上海麗珠制藥有限公司)、注射用利培酮微球(瑞士Janssen-Cilag 公司)��、注射用奧曲肽微球(瑞士Novartis Pharma Schweiz 公司) 和注射用全氟丁烷微球(美國GE HealthCare AS 公司)�����,上述產(chǎn)品均在有效期內(nèi)�。
硫乙醇酸鹽流體(FTM) 培養(yǎng)基(批號VM859391903)、胰酪大豆胨液體(TSB) 培養(yǎng)基(批號VM884759920) 和胰酪大豆胨瓊脂(TSA) 培養(yǎng)基(批號VM873358915) 均購于德國Merck Millipore 公司����;沙氏葡萄糖液體(SDB) 培養(yǎng)基(英國Oxoid 公司,批號2202463)����;沙氏葡萄糖瓊脂(SDA)培養(yǎng)基(批號1086835) 和pH 7.0 無菌氯化鈉- 蛋白胨緩沖液(批號1086984) 均購于廣東環(huán)凱微生物科技有限公司;0.1%無菌蛋白胨水溶液(北京奧博星生物技術(shù)有限責(zé)任公司����,批號20200812);DMSO(國藥集團(tuán)化學(xué)試劑有限公司���,批號20131225)�;其他試劑均為分析純,水為滅菌純化水�。
金黃色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、大腸埃希菌(Escherichia coli)[CMCC(B)44102]���、銅綠假單胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]��、枯草芽孢桿菌(Bacillus subtilis)[CMCC(B)63501]、短小芽孢桿菌(Bacillus pumilus)[CMCC(B)63202]�、生孢梭菌(Clostridium sporogenes)[CMCC(B)64941]、白念珠菌(Candida albicans)[CMCC(F)98001]���、黑曲霉(Aspergillus niger)[CMCC( F)98003] 等無菌檢查用標(biāo)準(zhǔn)菌株均為本實(shí)驗(yàn)室保藏����。
2�、方法與結(jié)果
2.1試驗(yàn)菌液的制備
參照ChP 2020 無菌檢查法(通則1101),制備大腸埃希菌����、銅綠假單胞菌、金黃色葡萄球菌���、枯草芽孢桿菌�����、白念珠菌�����、黑曲霉和生孢梭菌的試驗(yàn)菌液�;參照ChP 2020 抗生素微生物檢定法(通則1201),制備枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的試驗(yàn)菌液���。分別用pH 7.0 無菌氯化鈉- 蛋白胨緩沖液制成每1 ml 含菌數(shù)為108 cfu 和不大于100 cfu的菌懸液�。
2.2供試液的制備
DMSO 供試液:取注射用微球粉末(裝量約為每瓶30 mg)��,每瓶加入DMSO 溶液2 ml�,混勻。另取樣品�����,分別加入10% DMSO�、25% DMSO、50% DMSO�����、75% DMSO 溶液,均無法溶解形成均一的供試液���。根據(jù)ChP 2020 通則1101 關(guān)于供試液接種比例不大于培養(yǎng)基體積10%的規(guī)定�,后續(xù)試驗(yàn)中分別采用100% DMSO( 高濃度)�����、10%DMSO 溶液(低濃度)��,考察溶劑對試驗(yàn)菌生長的影響�����。
水溶性供試液:精密稱取氯化銨2.7 g����,置500 ml量瓶中����, 用水450 ml 溶解, 量取三乙胺6.0 ml加入瓶中����,混勻����,用水定容��,用三乙胺調(diào)至pH10.0±0.1��,制成pH 10.0 緩沖液����,滅菌[8]。取注射用微球粉末(裝量約為每瓶30 mg)��,轉(zhuǎn)移至含上述滅菌緩沖液25 ml 的玻璃瓶中�,密封,置45 ℃�、120 r/min 的恒溫?fù)u床,至微球完全溶解�����。
2.3方法適用性試驗(yàn)
參照ChP 2020 無菌檢查法(通則1101) 配制相應(yīng)培養(yǎng)基����,經(jīng)培養(yǎng)基的適用性和靈敏度檢查����,符合藥典標(biāo)準(zhǔn)規(guī)定���。方法適用性試驗(yàn)的設(shè)置共分為3組�,其中空白對照組用于判定試驗(yàn)方法體系是否正常��,溶劑組用于判定溶劑對試驗(yàn)方法是否有干擾����,試驗(yàn)組用于判定試驗(yàn)方法是否符合規(guī)定。
試驗(yàn)組:取注射用微球����,加入相應(yīng)溶劑(DMSO或pH 10.0 緩沖液),在上述溶液中分別加入含菌量不大于100 cfu 的試驗(yàn)菌液���,混勻;將含有大腸埃希菌����、銅綠假單胞菌、金黃色葡萄球菌和生孢梭菌的混合溶液轉(zhuǎn)移至FTM 培養(yǎng)基50 ml 中��,于33 ℃培養(yǎng)不少于5 d,將含有枯草芽孢桿菌�、白念珠菌、黑曲霉�、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的混合溶液轉(zhuǎn)移至TSB 培養(yǎng)基50 ml 中,于23 ℃培養(yǎng)不少于5 d�����,觀察試驗(yàn)菌是否生長���。
溶劑對照組:取相應(yīng)溶劑(DMSO 或pH 10.0緩沖液)�,加入含菌量不大于100 cfu 的試驗(yàn)菌液���,混勻����,其他同試驗(yàn)組操作�����。
空白對照組:取滅菌純化水��,加入含菌量不大于100 cfu 的試驗(yàn)菌液�����,混勻,其他同試驗(yàn)組操作����。
2.4注射用微球的形態(tài)考察
分別取少量注射用微球,用小藥勺取出少許粉體或粉塊����,均勻撒至石英玻璃臺上,使用一次性刻刀�����,反復(fù)��、隨機(jī)刻切10 次���;將上述粉體或粉塊均勻撒至樣品臺導(dǎo)電膠上��,使用洗耳球輕吹樣品表面,清理未黏附牢固的樣品�,采用濺射儀(設(shè)置濺射功率20 W,鍍金時(shí)間30 s) 處理�,然后裝載入掃描電鏡(SEM) 儀��,根據(jù)不同的成像比例��,設(shè)置加速電壓為5 或10 kV����。
分別以注射用醋酸亮丙瑞林微球����、注射用利培酮微球和注射用醋酸奧曲肽微球?yàn)榭疾鞂ο螅銼EM 照片如圖1 所示����。
A—注射用醋酸亮丙瑞林微球(×2000,加速電壓5 kV����,比例尺30 μm) ;B—注射用利培酮微球(×2000 倍���,加速電壓5 kV���,
比例尺30 μm) ;C—注射用醋酸奧曲肽微球(×2 000 倍����,加速電壓10 kV�����,比例尺30 μm) ��;D—注射用醋酸亮丙瑞林微球( 剖面
圖���,×5000 倍,加速電壓10 kV���,比例尺10 μm) ��;E—注射用利培酮微球(剖面圖�,×6800 倍����,加速電壓5 kV,比例尺10 μm) �����;
F—注射用醋酸奧曲肽微球(剖面圖,×2000 倍���,加速電壓10 kV,比例尺30 μm)�。
圖1 注射用微球代表性品種的SEM 照片
結(jié)果顯示,3 種微球均為實(shí)心球體����,球面直徑為30 ~ 100 μm ;其中注射用醋酸亮丙瑞林微球?yàn)榉涓C狀實(shí)心球體��,球體內(nèi)孔徑為1 ~ 3 μm�����,球面和球內(nèi)的直徑均在微米級�����,與常見細(xì)菌的大小處于同數(shù)量級����。雖然PLGA 是緩釋或控釋制劑的常用輔料[6],具有生物可降解性���,但在無菌檢查供試液的常規(guī)制備時(shí)間內(nèi)無法完全溶解����。
2.5DMSO 溶解微球后的無菌檢查方法適用性試驗(yàn)
2.5.1 DMSO 對試驗(yàn)菌生長抑制作用考察
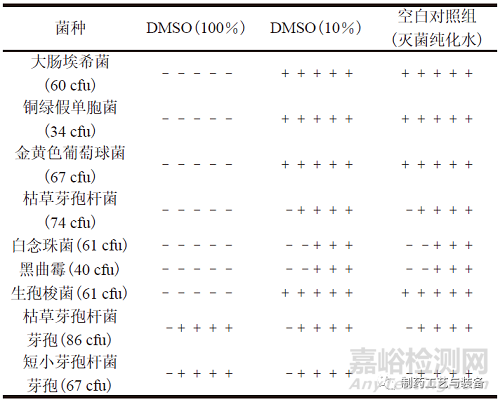
分別取“2.2”項(xiàng)下100% DMSO(高濃度)、10% DMSO 溶液(低濃度) 適量��,依照ChP 2020通則1101�����,分別加入不大于100 cfu 的各試驗(yàn)菌懸液����,混勻。將含有大腸埃希菌����、銅綠假單胞菌、金黃色葡萄球菌和生孢梭菌的混合溶液轉(zhuǎn)移至FTM培養(yǎng)基50 ml 中����,于33 ℃培養(yǎng)不少于5 d,將含有枯草芽孢桿菌�、白念珠菌、黑曲霉����、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的混合溶液轉(zhuǎn)移至TSB培養(yǎng)基50 ml 中���,于23 ℃培養(yǎng)不少于5 d。結(jié)果如表1所示�,100% DMSO 具有抑菌作用��,藥典規(guī)定的試驗(yàn)菌(營養(yǎng)體) 均無法生長�����;枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢可以生長�����。10% DMSO 溶液無抑菌作用�,ChP 2020 規(guī)定的試驗(yàn)菌(營養(yǎng)體)和耐受性芽孢均可以生長,但微球無法溶解��。
注:1) 每個(gè)單元格有5 個(gè)正負(fù)號�,依次顯示試驗(yàn)菌接種后d1至d5的
生長情況:“–”表示無菌生長,“+”表示有菌生長���。
表1 DMSO 對試驗(yàn)菌生長的抑制作用1)
2.5.2 方法適用性試驗(yàn)
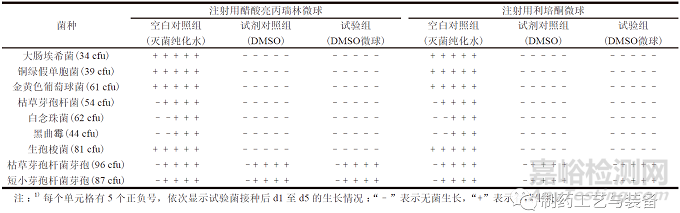
分別選擇注射用醋酸亮丙瑞林微球和注射用利培酮微球2個(gè)代表性品種���,進(jìn)行微球內(nèi)部無菌檢查的方法適用性試驗(yàn)��。取上述樣品�,每瓶用DMSO溶液2 ml 溶解微球��,以此作為供試液�����。供試液冷凍干燥后鏡檢���,結(jié)果顯示SEM 視野下未見完整的微球形態(tài)���,提示輔料已被DMSO 溶液溶解。依照ChP 2020 通則1101���,在注射用微球與DMSO 溶液混合后�,分別加入不大于100 cfu 的各試驗(yàn)菌懸液���,混勻����。將含有大腸埃希菌、銅綠假單胞菌���、金黃色葡萄球菌和生孢梭菌的混合溶液轉(zhuǎn)移至FTM 培養(yǎng)基50 ml 中���,于33 ℃培養(yǎng)不少于5 d,將含有枯草芽孢桿菌���、白念珠菌、黑曲霉�、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的混合溶液轉(zhuǎn)移至TSB 培養(yǎng)基50 ml,于23 ℃培養(yǎng)不少于5 d�,作為試驗(yàn)組;同時(shí)�,以滅菌純化水作為空白對照組、100% DMSO 作為試劑對照組����,同法操作。結(jié)果如表2所示���。
表2 DMSO 溶解注射用微球無菌檢查方法的適用性試驗(yàn)結(jié)果1)
100% DMSO 可溶解上述2個(gè)品種的注射用微球�,但“2.5.1”項(xiàng)下結(jié)果顯示100% DMSO 對于藥典規(guī)定的試驗(yàn)菌(營養(yǎng)體) 的生長均具有抑制作用�,因此可選擇枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢作為試驗(yàn)菌����,進(jìn)行方法適用性試驗(yàn)�。10% DMSO溶液雖然未見對于藥典規(guī)定的試驗(yàn)菌(營養(yǎng)體) 的生長抑制作用,但其無法溶解微球制成供試液���。結(jié)果提示����,以上2個(gè)注射用微球代表性品種的內(nèi)部無菌性檢查可采用100%DMSO作為溶劑制備供試液�,結(jié)合生產(chǎn)工藝過程中潛在污染的風(fēng)險(xiǎn)評估,以耐受性芽孢作為試驗(yàn)菌����,進(jìn)行方法適用性試驗(yàn)。
2.6水溶性緩沖液溶解微球后的無菌檢查方法適用性試驗(yàn)
根據(jù)注射劑的應(yīng)用情況����,無菌檢查一般制備水溶性供試液,通過薄膜過濾法進(jìn)行無菌性檢查�。DMSO 為有機(jī)溶劑,且對營養(yǎng)體狀態(tài)的試驗(yàn)菌的生長具有抑制作用�����,為尋求水溶性的“破球”方法,通過模擬注射用微球的體外釋放度���,制備水溶性供試液����。由于PLGA 輔料的酯鍵斷裂后產(chǎn)酸���,調(diào)節(jié)緩沖體系pH 值至堿性�,可加速輔料降解[8—9]����。
2.6.1 pH 10.0 緩沖液對試驗(yàn)菌生長抑制作用的考察
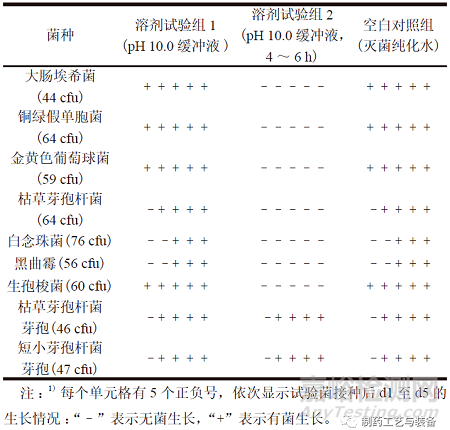
取“2.2”項(xiàng)下pH 10.0 緩沖液適量�,依照ChP2020 通則1101,分別加入不大于100 cfu 的各試驗(yàn)菌��,混勻����。將含有大腸埃希菌、銅綠假單胞菌���、金黃色葡萄球菌和生孢梭菌的混合溶液轉(zhuǎn)移至FTM培養(yǎng)基50 ml 中����,于33 ℃培養(yǎng)不少于5 d ;將含有枯草芽孢桿菌�、白念珠菌、黑曲霉���、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的混合溶液轉(zhuǎn)移至TSB培養(yǎng)基50 ml 中���,于23 ℃培養(yǎng)不少于5 d。同時(shí)��,為確證pH 10.0 緩沖液中試驗(yàn)菌株的穩(wěn)定性����,另取適量pH 10.0 緩沖液,加入試驗(yàn)菌后�,置45 ℃、120 r/min 的恒溫?fù)u床中孵育4 ~ 6 h��,然后分別轉(zhuǎn)移至不同培養(yǎng)基����,觀察菌株生長情況。將上述采用新鮮配制pH 10.0 緩沖液的試驗(yàn)組作為溶劑試驗(yàn)組1���,采用經(jīng)孵育4 ~ 6 h 的pH 10.0 緩沖液的試驗(yàn)組作為溶劑試驗(yàn)組2�����。
表3 pH 10.0 緩沖溶液對試驗(yàn)菌生長的抑制作用1)
結(jié)果如表3所示����,依照ChP 2020 通則1101 的試驗(yàn)步驟,pH 10.0 緩沖液對藥典規(guī)定的試驗(yàn)菌(營養(yǎng)體)����、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的生長均無影響;但當(dāng)溫度升高��、振蕩增加����、緩沖液經(jīng)孵育處理時(shí)�����,試驗(yàn)菌株的生長狀態(tài)不穩(wěn)定����,僅耐受性芽孢可以生長�。
2.6.2 方法適用性試驗(yàn)
分別選擇注射用醋酸亮丙瑞林微球和注射用奧曲肽微球2 個(gè)代表性品種�,進(jìn)行無菌檢查方法適用性試驗(yàn)。取上述樣品���,每瓶轉(zhuǎn)移至含pH 10.0 緩沖液25 ml 的玻璃瓶中����,于45 ℃�、120 r/min 密封無菌狀態(tài)下孵育4 ~ 6 h,獲得供試液(同時(shí)以pH 4.0�、pH 7.0 緩沖液作為對照,相同條件下微球均無法溶解����,加速釋放行為與相關(guān)研究結(jié)果一致[9])。供試液冷凍干燥后鏡檢���,SEM 視野下未見完整的微球形態(tài)�����,提示輔料能夠在此條件下加速降解����。
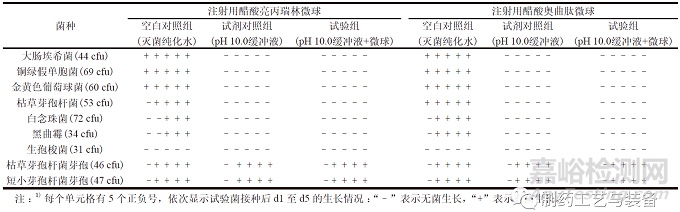
依照ChP 2020 通則1101,在注射用微球與pH10.0 緩沖液混合后����,分別加入不大于100 cfu 的各試驗(yàn)菌懸液,混勻����,在上述條件下孵育至微球完全溶解。將含有大腸埃希菌�、銅綠假單胞菌、金黃色葡萄球菌和生孢梭菌的混合溶液轉(zhuǎn)移至FTM 培養(yǎng)基225 ml 中���,于33 ℃培養(yǎng)不少于5 d ���;將含有枯草芽孢桿菌、白念珠菌�、黑曲霉、枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢的混合溶液轉(zhuǎn)移至TSB 培養(yǎng)基225 ml 中���,于23 ℃培養(yǎng)不少于5 d��,作為試驗(yàn)組;同時(shí),以滅菌純化水作為空白對照組����、以pH 10.0緩沖液作為試劑對照組,同法操作����。
表4 pH 10.0 緩沖液溶解注射用微球代表性品種后無菌檢查方法的適用性試驗(yàn)結(jié)果1)
結(jié)果如表4 所示,上述2個(gè)品種的注射用微球在45 ℃����、pH 10.0 堿性環(huán)境下振蕩孵育,輔料可加速降解以制備供試液進(jìn)行無菌檢查�,由于此條件下藥典規(guī)定的試驗(yàn)菌(營養(yǎng)體) 生長狀態(tài)不穩(wěn)定,且由于生孢梭菌為嚴(yán)格厭氧菌����,在有氧環(huán)境下無法生長(見表4 空白對照組),因此可選擇枯草芽孢桿菌芽孢和短小芽孢桿菌芽孢作為試驗(yàn)菌���,進(jìn)行方法適用性試驗(yàn)����。
3�、討論
本研究在調(diào)研注射用微球生產(chǎn)工藝和產(chǎn)品注冊申報(bào)資料的基礎(chǔ)上,選擇注射用醋酸亮丙瑞林微球等代表性品種,建立了2 種無菌檢查方法:一是采用DMSO 溶解微球���;二是采用pH 10.0 水溶性緩沖液加速輔料降解后溶解微球���。制備的無菌檢查供試液依照ChP 2020 通則1101,以枯草芽孢桿菌芽孢或短小芽孢桿菌芽孢作為試驗(yàn)菌��,采用直接接種法進(jìn)行無菌檢查�。
基于注射用微球的特點(diǎn),該制劑無菌檢查主要關(guān)注以下技術(shù)環(huán)節(jié)����。
①在充分了解產(chǎn)品生產(chǎn)工藝、質(zhì)量標(biāo)準(zhǔn)���、過程控制中微生物污染關(guān)鍵環(huán)節(jié)的基礎(chǔ)上��,經(jīng)方法驗(yàn)證及相關(guān)方法適用性試驗(yàn)確認(rèn)后�,建立無菌檢查方法���;例如����,目前絕大部分注射用微球產(chǎn)品采用無菌生產(chǎn)工藝,微球內(nèi)部不易有微生物營養(yǎng)體存活����,可采用枯草芽孢桿菌芽孢或短小芽孢桿菌芽孢作為試驗(yàn)菌��,或根據(jù)產(chǎn)品生產(chǎn)工藝中潛在污染物的風(fēng)險(xiǎn)評估����,采用其他耐受性芽孢作為試驗(yàn)菌進(jìn)行方法驗(yàn)證。
②對于有必要進(jìn)行內(nèi)部無菌檢查的品種���,應(yīng)選擇適宜的溶劑制備供試液�,模擬潛在微生物污染物存在條件下的微球溶解過程�����,并對溶劑是否影響試驗(yàn)菌生長進(jìn)行考察���;例如�,采用DMSO溶解����,或采用堿性(pH 10.0) 緩沖體系使輔料加速降解制備供試液�,均是對特殊無菌制劑建立無菌檢查方法的有益嘗試����。
③由于PLGA 單體比例不同,形成制劑時(shí)聚合物的降解時(shí)間����、藥物黏度、藥物釋放行為等均不相同[10—11]�,故不同品種在建立無菌檢查方法時(shí),需要分別對具體試驗(yàn)參數(shù)進(jìn)行驗(yàn)證或確認(rèn)��。此外�,微球骨架降解行為的目測判斷并不充分,如某些品種�����,在一定的加速釋放介質(zhì)中發(fā)生“溶蝕”現(xiàn)象���,雖然輔料載體未完全溶解(或降解)�,但微球由“光滑球面”逐漸變?yōu)?ldquo;蜂窩狀多孔縫隙球面”�����,因此,必要時(shí)可借助SEM 進(jìn)行形態(tài)觀察�、含量測定等方法,佐證無菌檢查方法的開發(fā)或驗(yàn)證策略[12—13]�。
注射用微球的生產(chǎn)工藝個(gè)性化,且相對常見注射劑����,仍屬于小眾的特殊劑型����。本研究選擇注射用醋酸亮丙瑞林微球、注射用利培酮微球����、注射用醋酸奧曲肽微球等代表性品種進(jìn)行研究,基本覆蓋了目前研發(fā)和上市的品種����。除本研究研究的品種外,還存在特殊生產(chǎn)工藝下的劑型�����,如注射用全氟丁烷微球�����,該制劑為空心微球,根據(jù)該產(chǎn)品質(zhì)量標(biāo)準(zhǔn)所述��,可采用魯爾接頭通過單向加壓方式破壞微球結(jié)構(gòu)后制備供試液�,進(jìn)行外部和內(nèi)部的整體無菌性檢查。
根據(jù)ChP 2020 通則1101 有關(guān)規(guī)定�����,品種性狀允許�,應(yīng)優(yōu)先選擇薄膜過濾法進(jìn)行無菌檢查。由于DMSO 對混合纖維素��、聚偏氟乙烯等材質(zhì)的無菌檢查用濾膜具有腐蝕性���,pH 10.0 緩沖液對濾膜完整性是否存在影響仍需評估����,故本研究在建立無菌檢查方法時(shí)����,采用直接接種法。其他品種在進(jìn)行無菌檢查時(shí)�,是否能夠采用薄膜過濾法����,仍需進(jìn)行濾膜完整性影響因素考察�����。
參考文獻(xiàn)
[1] YUE S, BOLUN Z, RUOWEI S, et al.PLGA-based biodegradable microspheres in drug delivery: recent advances in research and application [J].Drug Deliv, 2021, 28(1):1397-1418.
[2] 李 勛, 韋 祎, 馬光輝, 等.緩釋微球制劑的研究進(jìn)展[J].北京化工大學(xué)學(xué)報(bào)(自然科學(xué)版), 2017, 44(6):1-11.
[3] 郭寧子, 辛中帥, 楊化新.微球制劑質(zhì)量控制研究進(jìn)展[J].中國新藥雜志, 2015, 24(18): 2115-2121.
[4] 王似錦, 劉文杰, 高 春.注射用利培酮微球無菌檢查法的建立[J].中國新藥雜志, 2013, 22(11): 1341-1344.
[5] SUJI R, SEUNGYEOP P, YEON H L, et al.Biodegradable nanoparticles-loaded PLGA microcapsule for the enhanced encapsulation efficiency and controlled release of hydrophilic drug [J].Int J Mol Sci, 2021, 22(6): 2792.
[6] 張伊潔, 郭寧子, 劉萬卉, 等.緩控釋注射劑中丙交酯乙交酯共聚物(PLGA)分析方法的研究進(jìn)展[J].中國醫(yī)藥工業(yè)雜志, 2019, 50(10): 1180-1187.
[7] 韓寧娟, 牛 睿, 葛維娟.在藥劑學(xué)中微球制劑制備方法研究[J].生物化工, 2019, 5(2): 114-116.
[8] 張雪娟, 付 寒, 趙紫玉, 等.利培酮PLGA長效注射微球的穩(wěn)定性考察[J].中國醫(yī)藥工業(yè)雜志, 2019, 50(10):1193-1200.
[9] 梁苑英竹, 袁 松, 郭寧子, 等.注射用醋酸奧曲肽微球體內(nèi)外釋放度分析[J].藥物分析雜志, 2020, 40(6): 955-963.
[10] GUANGLIANG L, KATHLEEN M.Glass transition temperature of PLGA particles and the influence on drug delivery applications [J].Polymers, 2022, 14(5): 993-1011.
[11] 張伊潔, 郭寧子, 許麗曉, 等.多肽微球緩釋注射劑中載體輔料丙交酯乙交酯共聚物的關(guān)鍵質(zhì)量屬性分析[J].藥物分析雜志, 2020, 40(6): 988-998.
[12] SHAWN Z, DAN W, LIPING Z.Characterization of controlled release microspheres using FIB-SEM and imagebased release prediction [J].AAPS Pharm Sci Tech, 2020,21(5): 194-202.
[13] HONGFEI L, SHUANGSHUANG S, JIN C, et al.Preparation and evaluation of a novel bioactive glass/lysozyme/PLGA composite microsphere [J].Drug Dev Ind Pharm, 2015, 41(3): 458-463.
本文作者馮震��、肖珊珊���、陳輝、李靜敏�、唐黎明、楊美成��,上海市食品藥品檢驗(yàn)研究院�、上海麗珠制藥有限公司,來源于中國醫(yī)藥工業(yè)雜志���,僅供交流學(xué)習(xí)�。