今日頭條
璧辰MEK抑制劑國內(nèi)獲批臨床�。璧辰醫(yī)藥自主研發(fā)的1類化藥MEK1/2抑制劑ABM-168獲國家藥監(jiān)局批準(zhǔn)開展Ⅰ期臨床,適應(yīng)癥針對(duì)晚期實(shí)體瘤的治療����。臨床前結(jié)果顯示,ABM-168具有血腦屏障高參透性����,單獨(dú)使用或與其他藥物聯(lián)合使用均顯示出良好的抗腫瘤活性,可有效殺傷腦轉(zhuǎn)移癌細(xì)胞或惡性腦腫瘤細(xì)胞��。去年10月�,該新藥已獲FDA臨床許可,目前正在美國開展首次人體I期臨床試驗(yàn)����。
國內(nèi)藥訊
1.思路迪PD-L1抑制劑獲批肺癌III期臨床。思路迪皮下注射PD-L1抑制劑恩維達(dá)®獲國家藥監(jiān)局批準(zhǔn)開展III期臨床����,聯(lián)合含鉑雙藥化療對(duì)比安慰劑聯(lián)合含鉑雙藥化療,評(píng)估用于可切除III期非小細(xì)胞肺癌患者新輔助/輔助治療的有效性與安全性�。該項(xiàng)研究將由天津醫(yī)科大學(xué)腫瘤醫(yī)院的王長利院長擔(dān)任主要研究者。2021年11月����,該產(chǎn)品已獲NMPA批準(zhǔn)上市,用于治療MSI-H/dMMR晚期實(shí)體瘤經(jīng)治患者�。
2.本導(dǎo)基因編輯療法獲歐盟孤兒藥資格。本導(dǎo)基因體內(nèi)基因編輯療法BD112獲歐盟委員會(huì)(EC)授予孤兒藥資格����,擬用于治療亨廷頓舞蹈癥。BD112是一款基于原創(chuàng)性VLP遞送技術(shù)的體內(nèi)基因編輯創(chuàng)新療法��,VLP可以實(shí)現(xiàn)高效、瞬時(shí)的CRISPR基因編輯遞送�。亨廷頓舞蹈癥(HD)是一種常染色體顯性遺傳疾病,會(huì)導(dǎo)致腦細(xì)胞死亡�。
3.應(yīng)世引進(jìn)FAP-ADC獲批實(shí)體瘤臨床�。應(yīng)世生物引進(jìn)的靶向纖維細(xì)胞活化蛋白(FAP)的抗體偶聯(lián)(ADC)藥物OMTX705獲國家藥監(jiān)局臨床許可,擬開發(fā)用于治療局部晚期或轉(zhuǎn)移性的實(shí)體瘤��。FAP是一種糖基化膜蛋白��,在包括胰腺癌����、結(jié)直腸癌��、乳腺癌�、肺癌等多種腫瘤組織過度表達(dá)��。應(yīng)世生物已在臨床前研究中驗(yàn)證該產(chǎn)品在多種消化道腫瘤模型中的抗腫瘤活性�,適應(yīng)癥開發(fā)將重點(diǎn)針對(duì)多種消化道腫瘤。
4.科弈BCMA/CD19雙靶點(diǎn)CAR-T獲批臨床��。科弈藥業(yè)旗下科棋藥業(yè)“KQ-2003自體嵌合抗原受體T細(xì)胞注射液”獲國家藥監(jiān)局批準(zhǔn)開展Ⅰ期臨床����,擬用于四線及以上治療復(fù)發(fā)/難治性多發(fā)性骨髓瘤(MM)����。KQ-2003能同時(shí)靶向B細(xì)胞成熟抗原(BCMA)和CD19兩個(gè)治療靶點(diǎn)��,已在治療R/RMM患者的臨床研究(IIT)中�,實(shí)現(xiàn)100%的總體反應(yīng)率(ORR)����,最長的無進(jìn)展生存期(PFS)維持21個(gè)月,且藥物耐受性良好�。
5.北京可瑞TCR-T藥物報(bào)IND。可瑞生物1類生物制品“CRTE7A2-01 TCR-T細(xì)胞注射液”的臨床試驗(yàn)申請(qǐng)獲CDE受理����。該產(chǎn)品可通過靶向抑制HPV16 E7突變的表達(dá),阻止細(xì)胞最終向惡性方向轉(zhuǎn)化�,具有良好的抗腫瘤活性,擬開發(fā)用于治療HPV16陽性晚期宮頸癌����、頭頸部腫瘤及肛門癌。去年7月��,CRTE7A2-01已通過FDA臨床申請(qǐng)(NCT05122221),預(yù)計(jì)將于2024年11月完成Ⅰ期試驗(yàn)�。
6.復(fù)宏漢霖2023H1實(shí)現(xiàn)凈利2.4億。8月25日��,復(fù)宏漢霖發(fā)布2023年度中期業(yè)績報(bào)告����,上半年?duì)I業(yè)收入約人民幣25.005億元(較去年同期增長約93.9%);實(shí)現(xiàn)凈利潤約人民幣2.4億元�;研發(fā)投入約人民幣6.738億元。5款自研產(chǎn)品實(shí)現(xiàn)銷售收入合計(jì)約人民幣21.529億元�,其中漢曲優(yōu)®(曲妥珠單抗,歐洲商品名:Zercepasc®�,澳大利亞商品名:Tuzucip®和Trastucip®)和漢斯?fàn)?reg;分別實(shí)現(xiàn)銷售收入約12.767億元(同比增長57.1%)和5.563億元。
國際藥訊
1.歐盟批準(zhǔn)輝瑞RSV疫苗用于老人和孕婦��。輝瑞雙價(jià)呼吸道合胞病毒(RSV)疫苗Abrysvo(RSVpreF����,PF-06928316)獲歐盟批準(zhǔn)用于60歲以上老年人接種預(yù)防RSV感染,以及用于孕婦接種避免嬰孩出生后RSV感染����。在Ⅲ期試驗(yàn)中,疫苗在預(yù)防至少有兩種癥狀的RSV相關(guān)下呼吸道疾病的有效率達(dá)到66.7%��;避免嬰孩出生后90天內(nèi)感染嚴(yán)重性下呼吸道疾病的保護(hù)力達(dá)81.8%。
2.首個(gè)那他珠單抗生物類似藥獲批上市。山德士那他珠單抗生物類似藥Tyruko獲FDA批準(zhǔn)上市�,成為該品種首個(gè)生物類似藥�,用于治療多發(fā)性硬化癥(MS)和克羅恩?���。–D)��。那他珠單抗(Tysabri)是渤健原研的一款生物類疾病修正治療(DMT)藥物����,曾因存在進(jìn)行性多灶性腦白質(zhì)病 (PML) 風(fēng)險(xiǎn),在2005年被撤市;在渤健采取一系列安全性措施后��,F(xiàn)DA于2006年同意Tysabri重新上市。
3.羅氏CD79b-ADC見刊NEJM����。羅氏CD79b-ADC藥物Polivy(polatuzumab vedotin)與利妥昔單抗加環(huán)磷酰胺、多柔比星和潑尼松(R-CHP)聯(lián)用����,一線治療彌漫性大B細(xì)胞淋巴瘤(DLBCL)的Ⅲ期臨床POLARIX最新分析結(jié)果發(fā)布于NEJM上��。與標(biāo)準(zhǔn)治療相比��,Polivy+R-CHP組的疾病進(jìn)展、復(fù)發(fā)或死亡風(fēng)險(xiǎn)降低27%��。最新分析顯示,在ABC亞型(淋巴瘤起源于激活B細(xì)胞)患者中�,Polivy組合治療與標(biāo)準(zhǔn)治療相比,疾病進(jìn)展和死亡風(fēng)險(xiǎn)降低66%(HR=0.34�,95% CI�,0.13-0.85)�,死亡風(fēng)險(xiǎn)降低72%(HR=0.27����,95% CI,0.06-1.26)�。
4.創(chuàng)新降血脂RNAi療法見刊自然子刊��。Arrowhead公司靶向血管生成素樣蛋白3(ANGPTL3)mRNA的RNAi療法ARO-ANG3����,在針對(duì)動(dòng)脈粥樣硬化性心血管病(ASCVD)治療的Ⅰ期臨床獲積極結(jié)果。數(shù)據(jù)顯示����,ARO-ANG3可顯著降低受試者的甘油三酯(TG)和非高密度脂蛋白膽固醇(non-HDL-C)水平��,以及低密度脂蛋白膽固醇(LDL-C)水平����;而且療效持續(xù)3個(gè)月以上��。詳細(xì)結(jié)果發(fā)表于《自然》子刊Nature Medicine上�。
5.Coeptis公司480萬美元收購?fù)ㄓ肗K細(xì)胞療法�。Coeptis公司宣布以數(shù)額總計(jì)約480萬美元獲得Deverra公司專利同種異體干細(xì)胞擴(kuò)增和定向分化平臺(tái)的獨(dú)家許可�,以及臨床早期NK細(xì)胞療法DVX201��。DVX201是一種未經(jīng)修飾的來自供體CD34+細(xì)胞的自然殺傷(NK)細(xì)胞療法�,目前正在兩項(xiàng)Ⅰ期臨床試驗(yàn)中進(jìn)行評(píng)估��,分別針對(duì)COVID-19 (NCT04900454)和復(fù)發(fā)/難治性急性髓性白血病(AML)或高風(fēng)險(xiǎn)骨髓增生異常綜合癥的患者(NCT04901416)。
6.強(qiáng)生削減傳染病和疫苗部門研發(fā)費(fèi)用��。據(jù)外媒報(bào)道,在強(qiáng)生對(duì)傳染病和疫苗部門進(jìn)行重組六個(gè)多月后����,將完全削減該部門的研發(fā)費(fèi)用�。周三,強(qiáng)生的一位發(fā)言人表示�,除了研發(fā)大腸桿菌疫苗并繼續(xù)提供已經(jīng)上市的艾滋病產(chǎn)品外,強(qiáng)生正在計(jì)劃退出傳染病及疫苗(ID&V)其它研發(fā)項(xiàng)目��。目前��,強(qiáng)生位于萊登(Leiden)的疫苗部門已經(jīng)關(guān)閉�。
醫(yī)藥熱點(diǎn)
1.沈陽醫(yī)學(xué)院擬更名大學(xué)。近日�,沈陽市教育局在人民網(wǎng)領(lǐng)導(dǎo)留言板回復(fù)網(wǎng)友關(guān)于“沈陽醫(yī)學(xué)院升格醫(yī)科大學(xué)進(jìn)展”時(shí)稱,沈陽醫(yī)學(xué)院更名醫(yī)科大學(xué)工作已正式納入遼寧省“十四五”期間高等學(xué)校設(shè)置規(guī)劃��,已完成工作前置準(zhǔn)備程序?���,F(xiàn)階段��,學(xué)校主要圍繞教育部關(guān)于更名大學(xué)辦學(xué)指標(biāo)體系任務(wù)�,在師資隊(duì)伍建設(shè)、新增碩士授權(quán)點(diǎn)建設(shè)�、專業(yè)結(jié)構(gòu)優(yōu)化調(diào)整�、科研經(jīng)費(fèi)及科研獎(jiǎng)勵(lì)數(shù)量提升等方面加強(qiáng)建設(shè)��。
2.北京神經(jīng)科學(xué)學(xué)會(huì)癲癇專委會(huì)成立����。8月26日,北京神經(jīng)科學(xué)學(xué)會(huì)2023年學(xué)術(shù)年會(huì)在北京召開�,大會(huì)同時(shí)舉辦了新成立的“北京神經(jīng)科學(xué)學(xué)會(huì)癲癇專業(yè)委員會(huì)”的發(fā)布儀式,首都醫(yī)科大學(xué)三博腦科醫(yī)院副院長周健當(dāng)選為北京神經(jīng)科學(xué)學(xué)會(huì)癲癇專業(yè)委員會(huì)主任委員�。北京神經(jīng)科學(xué)學(xué)會(huì)下設(shè)癲癇專業(yè)委員會(huì),委員會(huì)設(shè)置顧問3名����,分別由首都醫(yī)科大學(xué)三博腦科醫(yī)院欒國明教授、北京大學(xué)第一醫(yī)院兒科及兒童癲癇中心主任姜玉武教授����、首都醫(yī)科大學(xué)附屬北京天壇醫(yī)院神經(jīng)病學(xué)中心癲癇科主任王群教授擔(dān)任。
評(píng)審動(dòng)態(tài)
1. CDE新藥受理情況(08月28日)
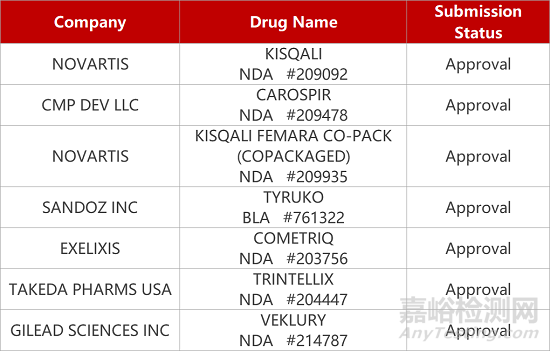
2. FDA新藥獲批情況(北美08月24日)