今日頭條
和鉑MSLN-ADC獲批實體瘤臨床�����。和鉑醫(yī)藥靶向人間皮素(MSLN)的ADC新藥HBM9033獲FDA批準(zhǔn)開展I期臨床�����,評估用于治療晚期實體瘤的安全性�、耐受性、藥代動力學(xué)和抗腫瘤活性�����。這是該公司首款進入臨床開發(fā)的ADC新藥�����,采用獨特的抗體和連接符載荷設(shè)計���。MSLN是一種細胞表面糖蛋白�����,在惡性間皮瘤�、胰腺癌���、卵巢癌和肺癌等多種腫瘤中過表達。
國內(nèi)藥訊
1.云頂新耀引進腎病新藥澳門報產(chǎn)�。澳門藥監(jiān)部門受理云頂新耀從Calliditas公司引進的布地奈德遲釋膠囊(Nefecon,耐賦康)的新藥上市許可申請(NDA)���,用于治療IgA腎病成人患者。Nefecon是全球獲批治療IgA腎病的首個靶向藥���,在臨床(NefIgArd)試驗中較安慰劑降低患者27% (P=0.0003) 的尿蛋白肌酐比。云頂新耀擁有Nefecon在大中華地區(qū)和新加坡開發(fā)以及商業(yè)化權(quán)利�。
2.永泰腫瘤細胞療法擬納入突破性療法���。永泰生物基于活化的自體淋巴細胞(AAL)技術(shù)開發(fā)的多靶點腫瘤細胞免疫治療產(chǎn)品“擴增活化的淋巴細胞(EAL®)”獲CDE擬納入突破性治療品種,用于預(yù)防原發(fā)性肝細胞癌根治性切除術(shù)后復(fù)發(fā)�。預(yù)期該產(chǎn)品將于2024年獲批上市。據(jù)悉���,永泰生物還計劃將EAL®的臨床適應(yīng)癥擴展至肺癌�、胃癌和急性髓系白血病等實體瘤的治療���。
3.基石PD-L1單抗胃癌Ⅲ期臨床成功���。基石藥業(yè)PD-L1單抗擇捷美(舒格利單抗注射液)聯(lián)合化療一線治療PD-L1表達≥5%���、局部晚期或轉(zhuǎn)移性胃/胃食管結(jié)合部腺癌的Ⅲ期研究(GEMSTONE-303)達到預(yù)設(shè)的主要終點�。與安慰劑聯(lián)合化療相比�,舒格利單抗組合顯著延長患者的無進展生存期(PFS)和總生存期(OS)���。詳細數(shù)據(jù)將在學(xué)術(shù)會議上公布。今年2月�,該新藥上述適應(yīng)癥上市申請已獲得NMPA受理。
4.廣州知易活體生物藥獲批III期臨床�����。知易生物首個活體1類生物藥SK08活菌散獲國家藥監(jiān)局批準(zhǔn)開展Ⅲ期臨床�,評估用于治療腹瀉型腸易激綜合征(IBS-D)的有效性與安全性。SK08已在Ⅱ期臨床中達到預(yù)設(shè)的有效性終點指標(biāo)�����,整體改善患者的腹痛和腹瀉癥狀���,并具有良好的安全性���。除IBS外,SK08已獲批多個適應(yīng)癥的臨床許可(包括潰瘍性結(jié)腸炎和腫瘤)�����,有望成為國內(nèi)首個獲批上市的活體生物藥�����。
5.杭州浩博乙肝ASO療法獲批臨床�。浩博醫(yī)藥反義寡核苷酸藥物AHB-137獲FDA批準(zhǔn)開展用于慢性乙肝病人的臨床試驗。這是一項國際Ⅰ期臨床�����,目前浩博醫(yī)藥正在新西蘭���、中國評估該藥用于慢性乙肝患者中的安全性�����、耐受性�、藥代動力學(xué)和初步藥效(NCT05717686)�����。AHB-137可靶向所有HBV RNA將其降解�,在臨床前研究中已顯示出對乙肝表面抗原的降低能力。
6.布瑞迅OX2R拮抗劑獲批失眠臨床���。布瑞迅藥業(yè)1類化藥BrP-01096片獲國家藥監(jiān)局臨床許可�����,擬用于失眠癥的治療�����。BrP-01096是一款小分子選擇性食欲素受體(OX2R)拮抗劑���,通過選擇性地抑制OX2R以改善睡眠�,包括加快入睡速度和延長睡眠時間�����,具有起效快���、耐受性好�、長期服用耐藥風(fēng)險低等特點���。全球范圍內(nèi)尚無同類藥物獲批上市�����。
國際藥訊
1.艾伯維IL-23抗體報結(jié)腸炎NDA���。艾伯維已向FDA和EMA遞交了IL-23抑制劑利生奇珠單抗(Skyrizi)注射液及其皮下注射劑型的新適應(yīng)癥上市申請,用于治療中重度活動性潰瘍性結(jié)腸炎(UC)�����。在III期誘導(dǎo)研究INSPIRE中�����,risankizumab治療較安慰劑顯著提高12周時的臨床緩解率(20.3%vs6.2%)�����;在維持研究COMMAND中�,risankizumab與對照組相比,患者在52周時達到臨床緩解的患者比例更高(40%和38%���,vs25%�����,p<0.01)�����。
2.諾華降脂療法Ⅲ期長期療效積極�����。諾華靶向PCSK9的小干擾核酸(siRNA)療法Leqvio(inclisiran)聯(lián)合他汀類藥物���,用于輔助治療動脈粥樣硬化性心血管疾病(ASCVD)���、ASCVD或雜合體家族性高膽固醇血癥(HeFH)風(fēng)險增加患者的Ⅲ期臨床(ORION-8)擴展研究結(jié)果積極。最新數(shù)據(jù)顯示�,每年兩次Leqvio輔助治療可持續(xù)6年降低患者的低密度脂蛋白膽固醇(LDL-C);藥物安全性與既往結(jié)果一致�。詳細結(jié)果將公布于ESC2023年會上。
3.創(chuàng)新口服TTR穩(wěn)定劑達Ⅲ期臨床主要終點���。BridgeBio公司新一代轉(zhuǎn)甲狀腺素蛋白(TTR)小分子穩(wěn)定劑acoramidis將在ESC2023大會上公布其用于治療伴有心肌病的轉(zhuǎn)甲狀腺素蛋白介導(dǎo)的(ATTR)淀粉樣變性(ATTR-CM)患者的Ⅲ期臨床(ATTRibute-CM)積極數(shù)據(jù)�����。按全因死亡率�����、心血管相關(guān)住院頻率�����、NT-proBNP較基線變化和6分鐘步行距離較基線變化的優(yōu)先順序?qū)蛹壏治?��,Win比率(Win ratio)達到1.8(p<0.0001),acoramidis組與安慰劑組生存率分別為81%和74%�。該公司預(yù)計年底前向FDA遞交新藥申請。
4.拜耳干細胞療法PD早期臨床積極�。拜耳及其旗下BlueRock公司計劃在國際帕金森病和運動障礙大會上公布干細胞衍生療法bemdaneprocel(BRT-DA01)治療帕金森病的Ⅰ期臨床積極結(jié)果。該研究達到主要終點�����,bemdaneprocel在所有12例受試者中耐受性良好�����;高劑量bemdaneprocel組受試者在一年后處于“開通”狀態(tài)的時間較基線多2.16小時�����,且沒有出現(xiàn)運動障礙���;處于“關(guān)閉”狀態(tài)的時間相應(yīng)減少1.91小時�。
5.腫瘤電場治療卵巢癌III期研究失敗。Novocure公司腫瘤電場治療(TTFields)與紫杉醇聯(lián)合用于鉑類耐藥性卵巢癌患者的III期ENGOT-ov50/GOG-3029/INNOVATE-3臨床未達到總體生存期(OS)主要終點�����。與紫杉醇相比�,TTFields聯(lián)合紫杉醇治療未能顯著改善患者的 OS (中位OS:12.2個月vs11.9個月,HR:1.008)�;TTFields治療耐受性良好,未增加全身毒性���。Novocure計劃全面評估ENGOT-ov50試驗數(shù)據(jù)�,包括亞組分析�����。再鼎醫(yī)藥擁有該產(chǎn)品的中國權(quán)益�����。
6.丹納赫57億美元收購Abcam�����。8月28日,丹納赫宣布將以每股24美元的價格收購英國生命科學(xué)用品制造商Abcam�����,總交易金額為57億美元左右�。Abcam公司成立于1998年,專注于為科學(xué)家提供各種實驗室產(chǎn)品���,如用于藥物發(fā)現(xiàn)和診斷的蛋白質(zhì)和抗體���。此次收購將有助于丹納赫為客戶提供全方位服務(wù)�����。2023年上半年�,Abcam營業(yè)收入為2.03億歐元,預(yù)計全年營收4.3億歐元�。
醫(yī)藥熱點
1.上海市六院安徽醫(yī)院開診。8月28日���,坐落于中國科學(xué)技術(shù)大學(xué)附屬第一醫(yī)院(安徽省立醫(yī)院)北區(qū)南地塊的上海市第六人民醫(yī)院安徽醫(yī)院(國家創(chuàng)傷區(qū)域醫(yī)療中心)揭牌開診���,這也是安徽省首個�����,全面開診的國家區(qū)域醫(yī)療中心���。上海市六院安徽醫(yī)院用地面積142畝,總建筑面積21萬平方米���,設(shè)置床位1000張�����,旨在建成集醫(yī)療���、教學(xué)、科研�、預(yù)防和保健為一體,特色突出的現(xiàn)代化���、高水平國家創(chuàng)傷區(qū)域醫(yī)療中心�����,提升安徽省創(chuàng)傷診療技術(shù)能力和服務(wù)水平�����。
2.廈門檢出今年首例登革熱病例���。8月28日���,廈門海關(guān)所屬機場海關(guān)在入境航班中檢出廈門口岸今年首例登革熱病例。該旅客體溫高達38.4°C�����,近期有蚊蟲叮咬史�,有畏寒�����、面色潮紅���、眼部干痛等癥狀�����,結(jié)合臨床癥狀和流行病學(xué)調(diào)查�,該旅客被綜合診斷為登革熱感染。目前���,海關(guān)已告知該旅客檢測結(jié)果并給予健康建議���,同時將病例情況通報地方衛(wèi)健部門���,做好后續(xù)處置工作�。
3.山西省肝臟移植中心獲批成立�。近日,山西省衛(wèi)健委下發(fā)《關(guān)于同意山西醫(yī)科大學(xué)第一醫(yī)院成立山西省肝臟移植中心的批復(fù)》���,山西醫(yī)科大學(xué)第一醫(yī)院正式獲批成立“山西省肝臟移植中心”���。未來,山西醫(yī)科大學(xué)第一醫(yī)院將充分利用其優(yōu)質(zhì)醫(yī)療資源�����,在目前開展的4種術(shù)式基礎(chǔ)上,逐步開展兒童活體肝移植���、劈離式肝移植、輔助肝移植及多米諾肝移植�,讓有肝移植適應(yīng)證的終末期肝病患者得到更加規(guī)范���、高效的治療�����,加速提升山西省器官移植技術(shù)水平和術(shù)后管理水平。
評審動態(tài)
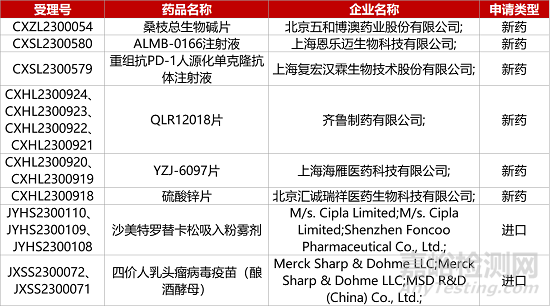
1. CDE新藥受理情況(08月29日)
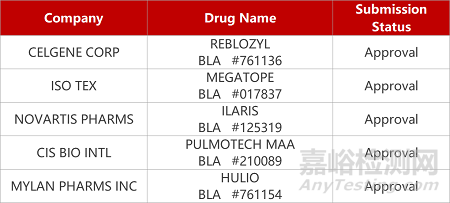
2. FDA新藥獲批情況(北美08月28日)