摘要
目的:為完善我國創(chuàng)新藥臨床試驗管理提供參考�����。
方法:從項目全生命周期視角出發(fā)��,分析創(chuàng)新藥臨床試驗所屬的復(fù)雜項目體系��,探討美國促進創(chuàng)新藥臨床試驗開展的政策措施及監(jiān)管經(jīng)驗,并提出對我國相關(guān)工作的建議��。
結(jié)果與結(jié)論:創(chuàng)新藥臨床試驗項目流程復(fù)雜且各主體利益訴求不盡相同�����,存在一定的監(jiān)管難點��。美國通過適時地頒布各類現(xiàn)代化監(jiān)管計劃及臨床試驗指導(dǎo)文件�����,促進了創(chuàng)新藥臨床試驗在方案設(shè)計�����、審評審批��、研究啟動���、倫理審查及數(shù)據(jù)共享等全生命周期流程的嚴謹性和高效性,為我國優(yōu)化創(chuàng)新藥臨床試驗的管理路徑提出建議���,探索“主方案”試驗設(shè)計模式為新療法臨床試驗提供進一步保障�����,通過優(yōu)化的試驗啟動運作程序��、獨立審查與?��?苹瘋惱韺彶椴⑿械臋C制及多樣化數(shù)據(jù)共享模式���,確保臨床試驗高效性,不斷完善審評信息公開和利益相關(guān)者溝通機制���,加強創(chuàng)新藥臨床試驗立項引導(dǎo)���。
藥物臨床試驗是評價藥物安全性和有效性最重要的依據(jù),也是新藥研發(fā)的關(guān)鍵環(huán)節(jié)��。隨著大量未被滿足的臨床需求的涌現(xiàn)以及我國對創(chuàng)新藥研發(fā)政策支持力度的不斷加大���,大批自主創(chuàng)新藥物步入臨床研究階段��。從國家藥品監(jiān)督管理局藥品審評中心(Center for Drug Evaluation��,CDE)發(fā)布的年度藥品審評報告來看���,2019���,2020及2021年完成的新藥臨床試驗(investigational new drug,IND)審評申請分別為1021�����,1548及2412件[1]���,年均增長率高于50%,遞增趨勢顯著���。在全球同步研發(fā)方面���,我國制藥企業(yè)開展的國際多中心臨床試驗(multi?regional clinical trial,MRCT)數(shù)量上從2016年的66項增加至2020年的147項�����,覆蓋地區(qū)從2016年的25個國家增加至2020年的51個國家[2]���?��?梢?����,我國藥物創(chuàng)新生態(tài)系統(tǒng)升級促進了新藥研發(fā)成果在臨床階段的跨越式產(chǎn)出��。
然而藥物臨床試驗是一個成功率偏低且開展周期長的復(fù)雜項目活動��。相關(guān)研究統(tǒng)計�����,進入臨床試驗的藥物最終獲得批準的可能性僅達到11.83%[3]��。在試驗周期上�����,單個臨床試驗從前期準備到完成所需時間一般為5~6年�����,且可能因為各類因素(如申報周期長���、合同和預(yù)算問題���、倫理審查差異等)而延期[4]。因此��,積極探索臨床試驗的高效管理經(jīng)驗���,構(gòu)建滿足中國與全球研發(fā)同步進行的創(chuàng)新藥臨床試驗運行體系則是當(dāng)前我國生物醫(yī)藥行業(yè)國際化發(fā)展的關(guān)鍵路徑�����。美國擁有發(fā)展迅速�����、創(chuàng)新效應(yīng)高的生物醫(yī)藥產(chǎn)業(yè),在創(chuàng)新藥臨床試驗的管理上也積累了豐富的經(jīng)驗�����。本文主要基于創(chuàng)新藥臨床試驗項目不同生命周期階段的管理內(nèi)容及監(jiān)管要點�����,探索美國在創(chuàng)新藥臨床試驗管理過程中具有代表性和創(chuàng)新性的做法�����,以期為我國的創(chuàng)新藥臨床試驗管理工作提供參考。
一��、創(chuàng)新藥臨床試驗項目全生命周期管理的理論分析
1.1 創(chuàng)新藥臨床試驗項目全生命周期管理的主要內(nèi)容
根據(jù)美國項目管理協(xié)會(Project Management Institute���,PMI)發(fā)布的《項目管理知識體系指南》���,項目是指在一定時間、資源和費用預(yù)算條件下���,為特定目標分階段完成的一次性任務(wù)��、產(chǎn)品或服務(wù)[5]���。項目的全生命周期管理可以將研究對象按照生命過程劃分為不同階段,針對各階段的主要任務(wù)及風(fēng)險特征�����,采取科學(xué)精準的管理措施�����,將項目總體成果的不可控性轉(zhuǎn)換為分階段的重點可控,減少過程中的反復(fù)和失誤�����,使項目順利進行的同時提高項目管理效率���。
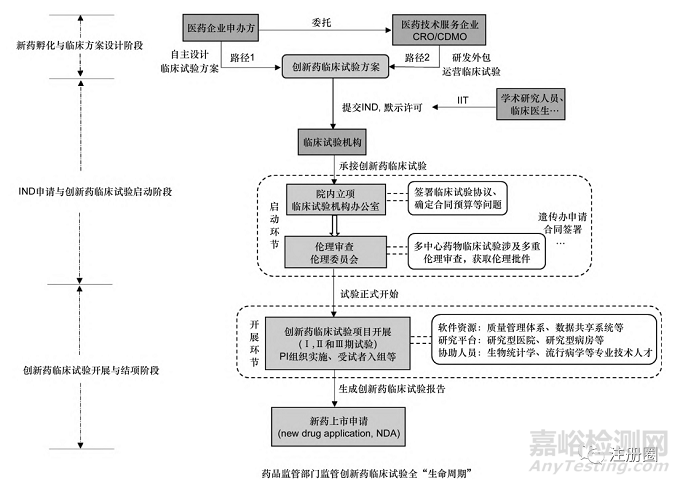
創(chuàng)新藥臨床試驗項目的全生命周期管理是一項復(fù)雜的系統(tǒng)工程��。項目大多由醫(yī)藥企業(yè)發(fā)起��,以新藥的注冊上市為目的��,少部分由學(xué)術(shù)機構(gòu)或臨床醫(yī)生發(fā)起���,即研究者發(fā)起的臨床試驗(investigator?initiated clinical trial,IIT)���,其主要任務(wù)流程及管理階段見圖1,其中任何一個環(huán)節(jié)出現(xiàn)問題都可能導(dǎo)致項目的延誤甚至失敗���。而且項目主體之間的利益關(guān)系錯綜復(fù)雜��,藥品監(jiān)管部門�����、倫理委員會(in?stitutional review board���,IRB)屬于監(jiān)管方��,醫(yī)藥企業(yè)申辦方��、合同研究組織(contract research organization���,CRO)、合同研發(fā)生產(chǎn)組織(contract development manufacture organization���,CDMO)以及研究者(principal investigator�����,PI)等屬于被監(jiān)管方��。被監(jiān)管方希望能在盡早通過審查的基礎(chǔ)上�����,減少試驗時間和成本消耗�����,保證創(chuàng)新藥上市后利潤最大化[6]��。而監(jiān)管方則要平衡不同主體間的利益訴求���,確保藥物臨床試驗具有科學(xué)價值��、臨床資源能夠高效利用��、受試者權(quán)益免受侵害等��,通過頂層政策制度的規(guī)制與協(xié)調(diào)形成促進試驗開展的良好支持體系��。
▲圖1-創(chuàng)新藥臨床試驗項目的“全生命周期”
1.2 創(chuàng)新藥臨床試驗項目全生命周期管理的監(jiān)管要點
市場在發(fā)揮積極作用的同時還會自發(fā)地產(chǎn)生一些消極的作用���,例如:投機行為、重復(fù)性試驗�����、試驗開展效率低下及信息不對稱等��,從而使臨床資源無法實現(xiàn)最優(yōu)化配置���,出現(xiàn)市場自發(fā)調(diào)節(jié)的失靈���,則需要政府部門對創(chuàng)新藥臨床試驗進行監(jiān)管。而且創(chuàng)新藥臨床試驗項目[特別是首次人體試驗(first?in?human clinical trial��,F(xiàn)IH)���,F(xiàn)IH也稱作0期臨床試驗�����,研究者使用微劑量在少量健康受試者(通常6~15人)進行的單劑量或不超過7d的多劑量給藥研究�����,用于確定藥物是否達到預(yù)期目標的首次人體早期試驗]的風(fēng)險偏高��,不確定性大�����,政府干預(yù)需要貫穿試驗設(shè)計�����、執(zhí)行到新藥上市的全過程���。
由于市場存在趨利屬性���,醫(yī)藥企業(yè)臨床研究的規(guī)劃與設(shè)計傾向于以注冊上市為目的,那么為了縮短新藥上市商業(yè)化進程�����,很可能聚焦重復(fù)靶點或簡化臨床試驗過程等���,導(dǎo)致新藥研發(fā)進入無序競爭狀態(tài)�����,甚至給社會公共安全帶來不利的影響�����,所以政府部門首先需要引導(dǎo)試驗項目優(yōu)先考慮未滿足需求的有價值的臨床研究問題��,并且對臨床試驗的質(zhì)量進行嚴格監(jiān)管��。在臨床試驗執(zhí)行方面���,機構(gòu)立項、倫理審批���、合同簽訂及預(yù)算談判等方面均是影響創(chuàng)新藥臨床試驗運行體系效率的關(guān)鍵節(jié)點���,比如:申辦方與CRO同臨床試驗機構(gòu)對接不暢、機構(gòu)間倫理審查未充分平行等情況會阻礙研究啟動效率的優(yōu)化��。最后��,創(chuàng)新藥臨床試驗數(shù)據(jù)透明化也是一項非常重要的工作�����,然而試驗數(shù)據(jù)的公開存在侵犯商業(yè)秘密與受試者隱私��、違背藥品試驗數(shù)據(jù)保護及數(shù)據(jù)濫用等爭議���,如何平衡醫(yī)藥企業(yè)�����、學(xué)術(shù)機構(gòu)及公共部門等各方主體在商業(yè)層面與社會層面的不同利益則是監(jiān)管難點���。
二�����、美國創(chuàng)新藥臨床試驗的監(jiān)管歷程
美國臨床試驗相關(guān)立法和監(jiān)管制度始于1938年���,美國國會頒布的《美國食品、藥品和化妝品法案》(The federal Food Drug and Cosmetic Act���,F(xiàn)D&C)首次對新藥上市前的安全性評估提出了要求��。受“反應(yīng)停”事件的影響�����,美國于1962年通過了《科夫?沃哈里斯修正案》��,對FD&C進行了修改���,規(guī)定制藥公司在新藥上市前必須向美國FDA提供證明藥品安全性和有效性的臨床試驗資料,并明確藥物臨床試驗申請和新藥上市申請的相關(guān)程序[7]��。
美國也是最早建立倫理委員會的國家,1974年美國國會設(shè)立了“保護生物醫(yī)學(xué)與行為學(xué)研究中的受試者委員會”�����。1981年衛(wèi)生與公眾服務(wù)部(Department of Health and Human Services�����,DHHS)和美國FDA修訂和擴大了關(guān)于保護人類受試者的規(guī)定�����,并納入了《聯(lián)邦法規(guī)》(第45章第46節(jié))�����,即后來的“共同規(guī)則”部分[8]���。
在臨床試驗指導(dǎo)方針方面,美國FDA主要采用人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(International Council for Harmonization of Technical Reguirements for Registration of Pharmaceuticals for Human Use�����,ICH)制定的臨床試驗管理規(guī)范(Good Clinical Practice guidelines�����,GCPs)指導(dǎo)臨床試驗。該指南由ICH專家工作組編寫��,涵蓋了臨床試驗設(shè)計��、實施和分析方法等詳細內(nèi)容��,并于1996年獲得ICH指導(dǎo)委員會批準[9]��。
目前�����,美國FDA是美國藥物臨床試驗的主要監(jiān)管主體��。自1962年美國FDA獲得監(jiān)管藥物臨床試驗的廣泛權(quán)力以來��,其對臨床試驗監(jiān)管的主題主要圍繞4個方面:①評估臨床研究的科學(xué)價值���。②通過充分的臨床前安全性研究及倫理審查保障受試者權(quán)益�����。③保證臨床試驗質(zhì)量���,強化申辦方及PI管理���。④確保臨床試驗數(shù)據(jù)的完整性。另外��,美國國立衛(wèi)生研究院(The National Institutes of Health���,NIH)是美國最大的臨床試驗聯(lián)邦資助者,每年投資超過30億美元���,負責(zé)支持與管理醫(yī)學(xué)院��、大學(xué)和研究機構(gòu)等開展轉(zhuǎn)化研究��、臨床研究等��,也在促進高優(yōu)先級研究問題的臨床試驗開展��。
三���、美國創(chuàng)新藥臨床試驗管理的改革內(nèi)容
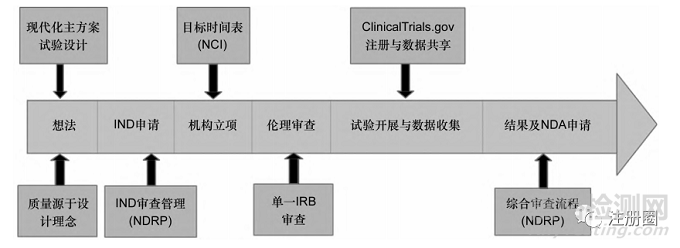
美國已經(jīng)建立了相對完善的臨床研究網(wǎng)絡(luò),但是由于高昂的研究成本�����、日益復(fù)雜的研究方法,加之臨床試驗與社會臨床需求存在分歧�����、臨床試驗信息系統(tǒng)不完善和監(jiān)管倫理審批存在延遲等�����,美國的創(chuàng)新藥臨床試驗領(lǐng)域面臨著各種新的困難與挑戰(zhàn)��。因此�����,從2007年開始���,美國FDA與NIH啟動了多項改革舉措來促進創(chuàng)新藥臨床試驗高質(zhì)量發(fā)展��,包括新藥監(jiān)管計劃(new drugs regulatory program��,NDRP)[10]���、臨床試驗轉(zhuǎn)型計劃(clinical trials transformation initiative��,CTTI)[11]及臨床試驗啟動改革計劃等��,其全生命周期改革舉措見圖2���。這些政策旨在解決創(chuàng)新藥臨床試驗在設(shè)計、質(zhì)量�����、效率���、監(jiān)管流程和數(shù)據(jù)共享等方面的挑戰(zhàn)和不足,以最大化地促進研究成果轉(zhuǎn)化為能夠改善人類健康的醫(yī)療實踐�����。
▲圖2-美國創(chuàng)新藥臨床試驗項目“全生命周期”的改革措施
3.1 新藥孵化與臨床方案設(shè)計階段
3.1.1 創(chuàng)建“主方案”試驗設(shè)計模式��,優(yōu)化臨床試驗的彈性與效率
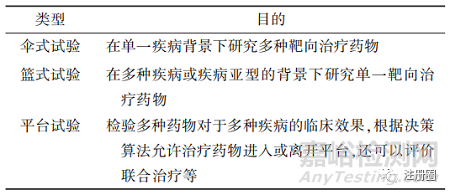
傳統(tǒng)的創(chuàng)新藥臨床試驗一般需要從零開始建立一個獨立的申報和執(zhí)行體系�����,且僅能夠評估面向同一種疾病的一種或幾種固定藥物,導(dǎo)致資源重復(fù)��、利用率低下��。美國FDA所提倡的現(xiàn)代化主方案試驗設(shè)計允許在總試驗框架下同時評估一種以上的研究藥物或生物制劑���、一種以上的疾病類型或一種以上的患者群體(見表1)��,以此提高腫瘤藥的研發(fā)效率���。美國FDA于2018年9月發(fā)布了2個與主方案相關(guān)的行業(yè)指南草案[12],以規(guī)范和引導(dǎo)腫瘤及其他領(lǐng)域中主方案的設(shè)計和執(zhí)行��。
▲表1-主方案試驗設(shè)計的類型
主方案在多個方面�����、針對不同利益相關(guān)方有著明顯的優(yōu)勢��。從促進創(chuàng)新角度來看���,多種子方案設(shè)計的同步進行可以便利更多的創(chuàng)新主體��,使創(chuàng)新藥盡快投入臨床��。從監(jiān)管試驗角度看���,覆蓋面更廣且更精密的數(shù)據(jù)為監(jiān)管機構(gòu)審評審批提供了更全面的證據(jù)���,幫助其在市場競爭者的新藥物之間進行最佳的判斷[13],而且多種子方案也為患者提供了更多且3更有針對性選擇��,保障受試者的安全�����。
3.1.2 基于“質(zhì)量源于設(shè)計”(quality by design�����,QbD)方法�����,提升創(chuàng)新藥臨床試驗設(shè)計質(zhì)量
CTTI計劃的QbD建議的核心是將質(zhì)量納入臨床試驗的科學(xué)設(shè)計和實施中[14]�����,提高受試者的安全性及結(jié)果的可信度�����。
QbD理念如下:①讓研究者���、研究協(xié)調(diào)員�����、監(jiān)管方及患者等利益相關(guān)主體參與臨床方案的設(shè)計開發(fā)�����,并圍繞研究質(zhì)量進行討論��,以提供基于多重角度有價值的見解�����。②集中精力關(guān)注對生成可靠試驗數(shù)據(jù)及受試者保護至關(guān)重要的活動���,對于不必要的事項和數(shù)據(jù)收集,可以簡化試驗設(shè)計�����。③借助QbD原則文檔和工具包前瞻性地確定并定期審查影響試驗質(zhì)量的關(guān)鍵因素等。對此���,CTTI已經(jīng)建立了一套應(yīng)用QbD原則的資源���,包括文檔工具、度量框架��、成熟度模型�����、實施指南等�����,以此來幫助試驗團隊設(shè)計開發(fā)和進行更好的臨床試驗�����。
2019年��,美國麥迪遜醫(yī)藥公司(The Medicines Company��,于2020年1月被諾華公司收購)與牛津大學(xué)臨床試驗服務(wù)部[Clinical Trial Service Unit(CTSU)��,Oxford University]合作借助QbD建議開發(fā)了靈活的研究方案以擴展一項全球心血管藥物臨床試驗�����。根據(jù)CTTI的建議���,識別影響該試驗的關(guān)鍵質(zhì)量因素��,包括受試者招募與維持干預(yù)(見表2)��,確保對試驗?zāi)繕说尼槍π躁P(guān)注�����。另外���,促進整個研究團隊在內(nèi)的多方利益相關(guān)者的合作交流,包括負責(zé)試驗設(shè)計(醫(yī)學(xué)��、藥學(xué)及監(jiān)管)以及數(shù)據(jù)管理���、安全管理�����、藥物供應(yīng)等主體均需要理解特定監(jiān)管背景下影響試驗質(zhì)量的關(guān)鍵因素��,使試驗盡可能精簡與集中���。隨著試驗的執(zhí)行�����,研究團隊在受試者招募方面相較于預(yù)期實現(xiàn)了顯著的提速���,QbD原則也成為麥迪遜醫(yī)藥公司和牛津大學(xué)CTSU試驗設(shè)計和執(zhí)行的實踐準則[15]。
▲表2-影響試驗的關(guān)鍵質(zhì)量因素
3.2 IND申請與創(chuàng)新藥臨床試驗啟動階段
3.2.1 探索IND審查管理新工作流程���,促進跨職能部門的協(xié)作審查
NDRP計劃的其中一項工作是簡化審查機構(gòu)內(nèi)部對于IND的科學(xué)審查和流程�����,以解決不一致的審查文件以及冗長的審查時間表等問題��。IND審查新流程和模板體現(xiàn)在兩方面:①信息傳入�����,開發(fā)一種基于風(fēng)險的方法對來自申辦者的信息進行科學(xué)分類�����,促進更高效率的知識管理以實現(xiàn)快速審查�����。②信息傳出���,建立跨職能部門審查模板,將多個學(xué)科的關(guān)鍵數(shù)據(jù)和評估進行匯總���,將審查重點放在關(guān)鍵問題上�����,并向申辦者傳達初始IND的總體決策���,實現(xiàn)高質(zhì)量反饋[16]。新的標準化IND審查模板記錄了對申辦者提交信息的內(nèi)部討論和外部評論��,以促進將審查數(shù)據(jù)與信息用于未來活動�����。
3.2.2 實施試驗啟動的目標時間表,縮短創(chuàng)新藥臨床試驗激活周期
美國NIH的國家癌癥研究所(National Cancer Institute���,NCI)長期以來一直贊助腫瘤藥物開發(fā)工作��,為應(yīng)對創(chuàng)新藥臨床試驗啟動延遲的難題�����,NCI的運營效率工作組于2010年出臺了一項關(guān)于臨床試驗啟動改革的計劃��,以壓縮癌癥臨床試驗激活的時間線��。該項計劃包括人員增加���、流程改進和信息技術(shù)創(chuàng)新[17],詳細內(nèi)容見表3��。
▲表3-促進試驗啟動的全面變革措施
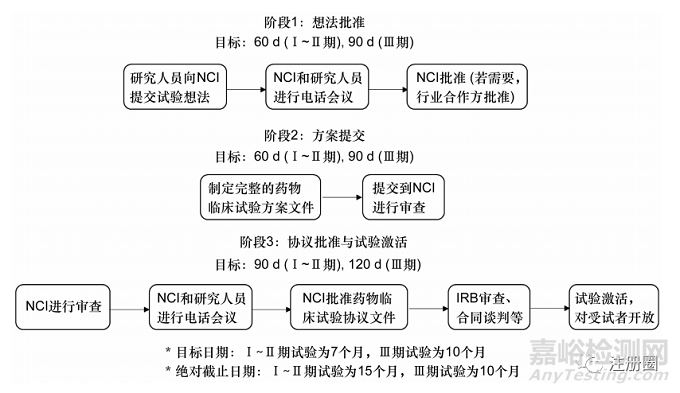
目標時間表�����、協(xié)議跟蹤網(wǎng)站��、聯(lián)合電話會議等舉措提高了臨床試驗從構(gòu)思階段到對患者登記開放階段的速度。其中�����,目標時間表通過任務(wù)階段的劃分并提供中間目標���、規(guī)定期限等來監(jiān)控整個過程的順利進行(見圖3)。第一階段是試驗想法的初步審查及共識審查文件的生成階段���。在獲得初步批準后���,研究人員在第二階段制定并提交完整的試驗方案。在第三階段���,NCI審查完整方案���,并處理倫理與合同問題,所有事項完畢則激活創(chuàng)新藥臨床試驗���。值得注意的是��,在絕對截止日期之前未激活的創(chuàng)新藥臨床試驗將自動被拒絕��。
▲圖3-NCI創(chuàng)新藥臨床試驗審查的目標時間表
3.2.3 使用單一機構(gòu)進行集中倫理審查�����,提高倫理審查效率
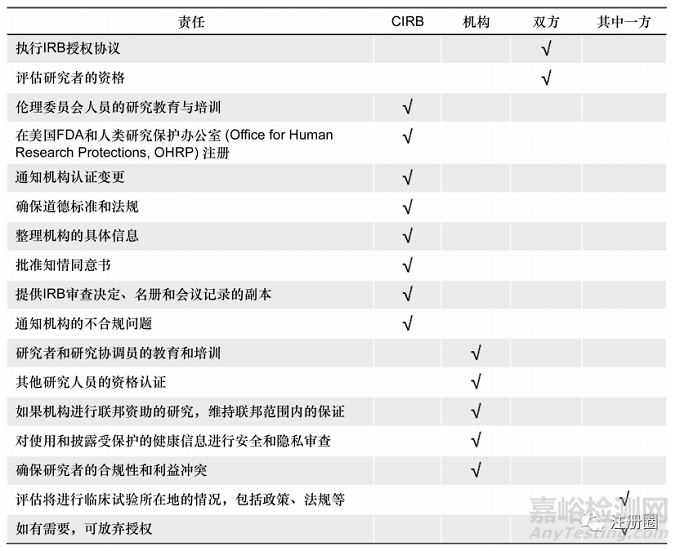
為提高多中心臨床試驗的倫理審查效率及跨站點的一致性�����,美國衛(wèi)生與公共服務(wù)部(Health and Human Services���,HHS)在其2017年新修訂的“共同規(guī)則”中提出:“要求使用單一機構(gòu)的倫理審查委員會審查基于美國的���、多地點、非豁免�����、聯(lián)邦進行或支持的人類受試者臨床研究”[18]���。在美國��,中心倫理委員會(central institutional review board�����,CIRB)代表著多中心試驗中所有臨床試驗中心的單一IRB記錄�����,一系列的實體機構(gòu)(一個機構(gòu)的IRB��、一個聯(lián)邦的IRB���、一個獨立的IRB等)可以作為一個CIRB[19]�����。在實踐中,美國國家癌癥研究所IRB和美國家庭醫(yī)生學(xué)會國家研究網(wǎng)絡(luò)IRB等均可以作為多中心臨床試驗的唯一IRB���。為規(guī)范機構(gòu)責(zé)任與CIRB的倫理審查責(zé)任��,CTTI制定了一份關(guān)于職責(zé)矩陣的指南(見圖4)��,以協(xié)助集中倫理審查過程�����。
▲圖4-機構(gòu)和中心倫理委員會在多中心臨床試驗中的責(zé)任劃分
美國國家癌癥研究所的CIRB則是具有代表性的中心倫理委員會��,共設(shè)有成人癌癥早期試驗���、成人癌癥晚期試驗��、兒童癌癥試驗及癌癥防控4種類型的CIRB���。NCI精心開發(fā)的流程和審查模式保證了創(chuàng)新藥臨床試驗審查的高質(zhì)量和透明度[20]。①NCI CIRB通過機構(gòu)和研究人員提交的標準化工作表評估當(dāng)?shù)厍闆r���,包括州和地方法律���、利益沖突政策、管理計劃等�����,提高審查管理效率�����。②創(chuàng)建在線系統(tǒng)網(wǎng)站IRB Manager���,為機構(gòu)提供與CIRB相關(guān)信息的無縫訪問��,并與其他NCI臨床試驗系統(tǒng)集成�����,為機構(gòu)�����、研究者提供一個高效的在線溝通平臺��。③建立內(nèi)部與外部質(zhì)量控制流程���,包括成員的持續(xù)培訓(xùn)��、維持美國人體研究保護項目認證協(xié)會(AAHRPP)認證等[2]3.3創(chuàng)新。
3.3 創(chuàng)新藥臨床試驗開展與結(jié)項階段
3.3.1 鼓勵臨床試驗注冊與數(shù)據(jù)共享���,充分發(fā)揮試驗數(shù)據(jù)的內(nèi)在價值
在美國��,主要通過2種有效方式來傳播創(chuàng)新藥臨床試驗結(jié)果:①發(fā)布在臨床試驗注冊網(wǎng)站上��。②通過數(shù)據(jù)共享訪問臨床試驗結(jié)果��。
根據(jù)《食品藥品監(jiān)督管理局修正案》(FDAAA801)第801條和《臨床試驗注冊和結(jié)果信息提交最終規(guī)則》(42CFR第11部分)[21]���,美國FDA要求臨床試驗的“責(zé)任方”在招募第1個受試者后不遲于21d在臨床試驗網(wǎng)站(ClinicalTrials. gov��,CTG)注冊有關(guān)試驗的具體信息���,隨后每年更新正在進行的試驗狀態(tài),在試驗完成后12個月內(nèi)向CTG提交試驗結(jié)果信息��,包括研究計劃���、結(jié)果數(shù)據(jù)和統(tǒng)計分析���、不良事件信息等。美國FDA的注冊要求是一項法定義務(wù)[30]��,可以幫助研究人員避免重復(fù)試驗�����,關(guān)注需要研究的領(lǐng)域���,同時為患者識別相關(guān)臨床試驗提供參考���。
除了注冊要求之外��,該法規(guī)還建立了試驗結(jié)果信息上報的約束系統(tǒng)��。美國FDA通過生物研究監(jiān)測計劃(bioresearch monitoring��,BIMO)項目的調(diào)查以及第三方投訴來監(jiān)督違反FDAAA的行為���,若發(fā)現(xiàn)責(zé)任方未能及時提交試驗注冊或結(jié)果信息,或者向數(shù)據(jù)庫提交虛假或誤導(dǎo)性信息��,美國FDA有權(quán)對責(zé)任方尋求民事罰款��、扣留HHS機構(gòu)的資助撥款甚至刑事訴訟等��。
美國也有廣泛的數(shù)據(jù)共享平臺��。耶魯大學(xué)在2011年開發(fā)了數(shù)據(jù)訪問項目���,并與強生聯(lián)合制定了關(guān)于外部研究人員的臨床試驗數(shù)據(jù)申請審查流程及數(shù)據(jù)使用協(xié)議等[22]��。另外,葛蘭素史克公司在2013年也啟動了一項臨床試驗數(shù)據(jù)共享計劃���,旨在為研究者共享高質(zhì)量的患者級數(shù)據(jù)���。近年來���,此項計劃開始與技術(shù)合作伙伴(包括SAS軟件公司)合作,使研究者可以使用便捷的分析工具在單個分析平臺上分析臨床試驗數(shù)據(jù)集��,打破臨床試驗數(shù)據(jù)訪問�����、聚合和分析的障礙��,加速創(chuàng)新藥臨床研究[22]���。
3.3.2 開發(fā)新藥上市申請的綜合審評流程�����,提高監(jiān)管決策透明度
NDRP計劃的另一項關(guān)鍵工作是開發(fā)綜合審評流程和文件模板�����,這是評估新藥上市申請(new drug applications�����,NDA)和生物制品許可申請(biologics license applications��,BLA)的更新流程�����。新流程中��,美國FDA的科學(xué)審查人員組成一個跨學(xué)科團隊���,共同討論擬上市藥品的安全性��、有效性等一系列關(guān)鍵問題�����,同時圍繞關(guān)鍵問題和潛在的收益?風(fēng)險撰寫一篇評論�����,在新藥或生物制劑批準后�����,公開發(fā)布包含概要���、跨學(xué)科評估和附錄的綜合審評文件[23](見表4)。
▲表4-綜合審評文件的組成部分及其內(nèi)容
更新后的模板是一份協(xié)作文件��,包含來自臨床藥理學(xué)��、生物統(tǒng)計學(xué)���、毒理學(xué)等相關(guān)學(xué)科審查員的決策意見��。新的審查模板旨在促進更加綜合和跨學(xué)科的評估��,提高美國FDA對于新藥收益和風(fēng)險評估的證據(jù)清晰度���,同時行業(yè)人員可以獲取其認為最有價值的審評問題。
四��、對我國創(chuàng)新藥臨床試驗管理的啟示
4.1 我國創(chuàng)新藥臨床試驗管理現(xiàn)狀
為適應(yīng)醫(yī)藥行業(yè)創(chuàng)新發(fā)展的需要�����,我國也出臺了一系列促進創(chuàng)新藥臨床試驗發(fā)展的法規(guī)文件及相關(guān)指南���,涵蓋臨床試驗設(shè)計�����、倫理審查��、審評審批及信息公開等方面�����。2015年國家發(fā)布的《國際多中心藥物臨床試驗指南(試行)》[24]對倫理協(xié)作審查模式進行了初步引導(dǎo)�����。2019年8月國家發(fā)布的《藥品管理法》[25]將臨床試驗?zāi)驹S可制度在法律層面固化下來�����,提高了藥品審評審批效率��。2020年3月國家發(fā)布的《藥品注冊管理辦法》[26]進一步改革藥品注冊程序��、優(yōu)化藥品上市許可路徑�����,幫助創(chuàng)新藥企業(yè)更早上市創(chuàng)新藥。2021年發(fā)布的《藥審中心技術(shù)審評報告公開工作規(guī)范(試行)》[27]對臨床試驗注冊登記及技術(shù)審評信息公開等工作作出了明確要求��。在新藥研發(fā)價值引導(dǎo)上�����,CDE在2021年11月15日正式發(fā)布了《以臨床價值為導(dǎo)向的抗腫瘤藥物臨床研發(fā)指導(dǎo)原則》[28],促進抗腫瘤藥科學(xué)有序地開發(fā)��。
可以看出�����,我國在創(chuàng)新藥臨床試驗的監(jiān)管理念和監(jiān)管能力上實現(xiàn)了較大程度的突破�����,各監(jiān)管部門通力配合��,優(yōu)化了監(jiān)管環(huán)節(jié)的引導(dǎo)性��、科學(xué)性與透明度�����。但在創(chuàng)新藥全球同步研發(fā)��、注冊與審評的發(fā)展背景下��,與世界領(lǐng)先國家相比�����,我國尚未充分加入全球同步研發(fā)��。分析顯示���,在2018年開展的國際多中心臨床試驗中���,我國占比9.4%���,同年在美國、日本的占比分別是77.5%和19.7%[2]��?�?梢?�,我國參與國際多中心臨床試驗的經(jīng)驗還略有不足��,在未來與國際創(chuàng)新體系充分接軌的過程中�����,我國在臨床試驗水平與臨床試驗效能方面還有一定的提升空間���。美國在創(chuàng)新藥臨床試驗的管理理念、方案執(zhí)行流程�����、倫理審查制度等方面進行了率先探索,對科學(xué)開展我國創(chuàng)新藥臨床試驗管理工作有一定的啟示意義�����。
4.2 完善我國創(chuàng)新藥臨床試驗運行體系的建議
4.2.1 探索創(chuàng)新藥臨床試驗“主方案設(shè)計”模式�����,提高新藥研發(fā)效率
對于臨床需求未被滿足領(lǐng)域的突破性創(chuàng)新來說�����,主方案這一創(chuàng)新性藥物研發(fā)模式在我國有較大的發(fā)展空間���。CDE在2021年1月29日頒布的《藥物臨床試驗適應(yīng)性設(shè)計指導(dǎo)原則(征求意見稿)》中也首次提到了主方案的試驗思路���。英國探索了主方案在加速2019新型冠狀病毒炎(Corona Virus Disease2019,COVID?19)藥物研發(fā)的實踐應(yīng)用[29]���,由政府牽頭���,醫(yī)院、醫(yī)藥企業(yè)��、臨床研究組織等共同合作開展臨床試驗。通過建立適應(yīng)性和開放性的主方案��,主方案下的試驗網(wǎng)絡(luò)為子試驗提供適當(dāng)?shù)幕A(chǔ)平臺�����、數(shù)據(jù)管理等資源���,子方案間實現(xiàn)資源共享與風(fēng)險共擔(dān)��,減輕研究者用于體系建立��、維護和監(jiān)管的負擔(dān),為新療法臨床試驗部署提供最大范圍的保障���。該方式為英國國家醫(yī)療服務(wù)體系減輕了一定的負擔(dān)�����,效果顯著���。基于COVID?19疫情背景下���,未來還需大量臨床試驗支持疫苗及新藥研發(fā)��,加上我國對創(chuàng)新藥臨床試驗的支持��,主方案在未來藥物研發(fā)中擁有較多的實施機會�����。
4.2.2 優(yōu)化機構(gòu)內(nèi)試驗啟動的運作程序�����,促進創(chuàng)新藥臨床試驗項目啟動加速
臨床研究的啟動是創(chuàng)新藥臨床試驗成功的關(guān)鍵因素[30]���,試驗的準備和啟動階段若占很長時間的話���,會阻礙項目入組進度以及項目整體進度,也會影響創(chuàng)新藥臨床試驗的成本��。美國NCI就曾面臨創(chuàng)新藥臨床試驗啟動延遲的難題��,并作出了一系列流程改進以提高試驗啟動效率�����。為確保臨床試驗高效性,我國臨床試驗機構(gòu)也需要不斷優(yōu)化試驗啟動的運作程序���,包括配備專職人員協(xié)助方案審查��、合同擬定的全過程�����;高效管理臨床試驗協(xié)議�����,建立協(xié)議跟蹤網(wǎng)站��,使申辦方��、CRO及研究者等明確協(xié)議開發(fā)進度及當(dāng)前任務(wù);定期舉行聯(lián)合電話會議討論試驗方案審查的關(guān)鍵問題等���。
4.2.3 逐步確立獨立倫理審查模式�����,設(shè)置基于?����?撇》N的CIRB
我國出臺的相關(guān)法規(guī)均提倡采用協(xié)作審查模式審查多中心臨床試驗項目[31]���,并且近幾年浙江省�����、山東省��、北京市��、上海市等地區(qū)陸續(xù)成立了臨床試驗倫理審查互認聯(lián)盟��,不斷推進多中心臨床試驗倫理審查的一致性[32]��。在這種客觀條件下��,我國應(yīng)該一方面發(fā)揮現(xiàn)有各地區(qū)倫理審查互認聯(lián)盟的示范引領(lǐng)作用��,逐步推動更大范圍跨區(qū)域倫理審查的單一化���、規(guī)范化發(fā)展���;另一方面梳理我國的臨床重點專科(如心血管外科��、內(nèi)分泌代謝��、血液等)�����,探索建立基于不同病種的?��?苹瘋惱韺彶閰f(xié)作聯(lián)盟�����,突破地域的限制實現(xiàn)審查的協(xié)調(diào)聯(lián)動���。這種獨立審查與專科化倫理審查并行的倫理審查模式更加切合我國實際���,可以充分發(fā)揮現(xiàn)有資源的優(yōu)勢。另外���,應(yīng)通過多種機制提升倫理委員會能力[33]���,比如建立倫理評審專家的職業(yè)認證機制及培訓(xùn)機制等���。
4.2.4 完善創(chuàng)新藥臨床試驗數(shù)據(jù)頂層設(shè)計,探索建立多樣化數(shù)據(jù)共享模式
新的藥品安全形勢下公眾對創(chuàng)新藥臨床試驗數(shù)據(jù)公開的訴求越來越強烈���,考慮到研究人員與公眾需要的數(shù)據(jù)粒度級別存在差異性�����,在完善立法保障的基礎(chǔ)上�����,我國可以探索建立多樣化創(chuàng)新藥臨床試驗數(shù)據(jù)共享模式:①依托我國現(xiàn)有的數(shù)據(jù)公開平臺��,逐步建立起高效智能的“信息化臨床試驗科研平臺”��,擴大臨床試驗數(shù)據(jù)的公開范圍��,包括研究計劃��、結(jié)果摘要及統(tǒng)計信息等�����。②促進學(xué)術(shù)界與醫(yī)藥行業(yè)的合作���,依托嚴格的數(shù)據(jù)共享協(xié)議與監(jiān)督機制確保程序符合倫理要求���,嘗試通過開發(fā)新的工具為研究人員對共享數(shù)據(jù)集的二次分析提供便利。③對于國家資助的學(xué)術(shù)性臨床研究課題��,可以采取一定的激勵措施或?qū)⒆耘R床試驗作為學(xué)術(shù)期刊的論文發(fā)表條件��,鼓勵數(shù)據(jù)公開�����。
4.2.5 加強監(jiān)管主體同利益相關(guān)者的互動溝通�����,提高監(jiān)管效率
從美國FDA審評程序的改革過程中可以看到��,藥物上市審評程序和審評報告公開是一個反復(fù)迭代的過程��,以不斷地解決現(xiàn)行審評存在的問題���。處于新的創(chuàng)新浪潮下��,當(dāng)前我國大幅遞增的創(chuàng)新藥臨床試驗申請數(shù)量增加了監(jiān)管工作量��,同時國家鼓勵罕見病用藥��、兒童用藥等臨床急需藥品的研制創(chuàng)新��,則對監(jiān)管方的審查能力提出了更高的要求[34]�����。根據(jù)治理理論的系統(tǒng)性思想��,創(chuàng)新體系的治理應(yīng)該將分散的���、多元的力量進行整合,那么在藥品審評流程和創(chuàng)新研發(fā)引導(dǎo)上需要注重與醫(yī)藥領(lǐng)域各方利益相關(guān)者的交互式溝通交流���,不斷完善信息公開機制���,幫助研發(fā)企業(yè)和公眾了解監(jiān)管機構(gòu)的觀點和決策依據(jù),引導(dǎo)新藥研發(fā)主體在立項時理性分析創(chuàng)新藥的臨床價值和市場需求���,并且及時更新監(jiān)管工具和監(jiān)管方法��,使監(jiān)管主體逐步掌握多領(lǐng)域的專業(yè)知識以及新的分析方法和技術(shù)���,實現(xiàn)對新藥基于價值的綜合評估��。