摘要
模擬技術(shù)是提高臨床試驗成功率的重要工具���,且在臨床研究各階段中均有重要作用。本文闡述了模擬計劃方案����、執(zhí)行、總結(jié)和評價3部分中的內(nèi)容�、要求和需關(guān)注的問題。在以生存分析的應(yīng)用實踐中�,本文假設(shè)的情景為不符合等比例風險假設(shè)的時間事件數(shù)據(jù),使用的模型為包含延滯效應(yīng)的指數(shù)治愈率函數(shù)模型����,模擬目的是對平均風險比、樣本量���、事件數(shù)等試驗設(shè)計因素進行研究�。模擬結(jié)果顯示,非等比例風險假設(shè)對于試驗假設(shè)�、隨訪時間和分析時間均有重要影響。使用等比例風險假設(shè)下的試驗設(shè)計方法會造成試驗檢驗把握度降低���、不可靠的期中分析結(jié)果等問題����,而模擬技術(shù)可以更好地支持臨床試驗的設(shè)計和實施�。最后討論了模擬實施中情景假設(shè)的重要程度和對模擬執(zhí)行的影響,并指出應(yīng)考慮模擬的復(fù)雜度以提高模擬執(zhí)行的可行性�。
一、概述
模擬技術(shù)是藥物臨床研究中非常重要的工具����,尤其在新穎����、復(fù)雜的臨床適應(yīng)性設(shè)計研究中,模擬技術(shù)是提高試驗成功率的關(guān)鍵手段����。在應(yīng)用類型方面,模擬技術(shù)可用于確定藥物劑量�、評估藥物毒性�、研究劑量-療效關(guān)系����、確定期中分析時間節(jié)點、樣本量重新估計等�。通過對試驗過程的模擬,研究者可以預(yù)估試驗中受試者的入組速率和隨訪時間�,統(tǒng)計師可以設(shè)定臨床試驗的期中分析策略,申辦方可以規(guī)劃相應(yīng)的藥物臨床開發(fā)戰(zhàn)略[1]����。
模擬技術(shù)作為新穎臨床研究的重要組成部分,其設(shè)計和執(zhí)行非常重要����。近些年,各國監(jiān)管機構(gòu)制定的指導(dǎo)原則中均包含了相關(guān)要求����。國家藥品監(jiān)督管理局藥品審評中心(Center for Drug Evaluation,CDE)于2020年12月發(fā)布的《模型引導(dǎo)的藥物研發(fā)技術(shù)指導(dǎo)原則》[2]中對于建模與模擬實施的過程和報告結(jié)構(gòu)進行了規(guī)范�。美國FDA在2019年發(fā)布的《適應(yīng)性設(shè)計指導(dǎo)原則(Adaptive Design Clinical Trials for Drugs and Biologics Guidance for Industry)》[3]中規(guī)定了模擬報告的格式和內(nèi)容。次年���,美國針對復(fù)雜新穎試驗設(shè)計(complex innovative trial design���,CID)項目制定了《與FDA溝通交流藥物和生物制品復(fù)雜創(chuàng)新試驗設(shè)計指導(dǎo)原則(Interacting with the FDA on Complex Innovative Trial Designs for Drugs and Biological Products)》[4]�,其中對溝通交流時模擬技術(shù)內(nèi)容和要求進行了細化����。歐洲EMA和歐洲制藥工業(yè)和協(xié)會聯(lián)合會(European Federation of Pharmaceutical Industries and Associations,EFPIA)成立的模型和模擬工作組于2016年發(fā)布了《模型引導(dǎo)的藥物發(fā)現(xiàn)和與研發(fā)(Model-informed Drug Discovery and Development�,MID3)良好做法》白皮書[5],其中制定了模擬計劃書和報告內(nèi)容�。
在學術(shù)層面,已有學者對模擬技術(shù)的良好操作流程(good practices)進行了總結(jié)[6]����,之后伴隨臨床研究的發(fā)展和進步,又對模擬技術(shù)進行了深入研究[7-9]�,進一步細化了模擬技術(shù)的實施過程,并探索了模擬技術(shù)的影響因素����。
本文將從具體實施過程角度闡述模擬技術(shù)中設(shè)計和執(zhí)行的重要性。之后介紹一項在非等比例假設(shè)下生存分析試驗設(shè)計中模擬技術(shù)的應(yīng)用實踐����。
二����、模擬技術(shù)的實施
在臨床研究中�,模擬技術(shù)的復(fù)雜程度會隨著其重要程度的增加而增加[10]�。如果模擬技術(shù)的重要程度較低,則其設(shè)計和實施相對而言會較為簡略; 若模擬技術(shù)的結(jié)果對于臨床研究的設(shè)計和決策有較大意義���,則其設(shè)計和實施需要較為規(guī)范和具體的形式����。盡管模擬技術(shù)形式多樣�,但其核心理念基本相同。本節(jié)將按照以下3部分闡述: 模擬的計劃�、模擬的執(zhí)行、模擬的總結(jié)和評價����。
2.1 模擬計劃方案
模擬計劃方案是模擬實施的關(guān)鍵前提,完善的計劃可保證模擬實施過程的合規(guī)性和模擬結(jié)果的可靠性�。模擬分析計劃不僅由統(tǒng)計師制定,其中的細節(jié)內(nèi)容應(yīng)由臨床專家和實施人員共同審閱和完善���。完備的模擬實施計劃主要包含3個部分[10]: 首先明確模擬在臨床研究中的地位和價值���、模擬結(jié)果如何指導(dǎo)臨床研究的設(shè)計和實施; 其次闡述模擬過程中的模型假設(shè)�、建模方法���、模擬情景����、軟件使用等基本內(nèi)容; 最后說明模擬結(jié)果的評價和解讀�。
監(jiān)管機構(gòu)在指導(dǎo)原則中對模擬分析計劃進行了說明。CDE發(fā)布的《模型引導(dǎo)的藥物研發(fā)技術(shù)指導(dǎo)原則》中明確模型分析計劃應(yīng)包含背景���、目的�、研究概述����、分析用數(shù)據(jù)、分析方法5部分����。美國FDA發(fā)布的《適應(yīng)性設(shè)計指導(dǎo)原則》中說明,若模擬對于試驗實施參數(shù)具有非常重要的作用����,則其設(shè)計需要被詳細描述����,包括模擬情景參數(shù)的設(shè)置�、模擬次數(shù)或迭代次數(shù)����、所使用的軟件包、隨機數(shù)產(chǎn)生的過程等���。歐洲EMA發(fā)布的白皮書中著重闡述了模型方法的內(nèi)容����,包括對于干擾項等重要內(nèi)容的敏感性分析等����,同時強調(diào)了情景假設(shè)對于模擬的重要程度。
模擬的本質(zhì)是使用數(shù)學模型替代實際臨床試驗�,觀察臨床試驗在不同情景下的運行情況,因此模擬的關(guān)鍵內(nèi)容之一就是情景假設(shè)(scenario assumptions)����。情景假設(shè)包含模型假設(shè)和參數(shù)假設(shè)。模型假設(shè)是指針對臨床研究中各因素間關(guān)系而近似表述出的數(shù)學結(jié)構(gòu)���,如代表藥動學的一房室模型����、二房室模型; 生存分析中的比例風險模型(Cox)等。參數(shù)假設(shè)是指模型中參數(shù)的假設(shè)�,其可以假設(shè)為具體值或某類分布,例如: 房室模型中消除速率設(shè)定為某常數(shù)���,生存分析中事件發(fā)生率服從指數(shù)分布等�。參數(shù)假設(shè)的來源包括臨床研究�、非臨床研究以及文獻資料等,其證據(jù)質(zhì)量需得到充分保證���。模擬的情景假設(shè)應(yīng)建立在臨床研究基本特征的基礎(chǔ)上����,且需要考慮到模型和參數(shù)假設(shè)背后的統(tǒng)計學因素���。
模擬結(jié)果的統(tǒng)計分析和評價是另一重要內(nèi)容�。模擬與實際臨床研究的統(tǒng)計分析原則基本是一致的�,差異主要體現(xiàn)在模擬產(chǎn)生偏倚的來源可能與實際臨床研究不同,而這會在一定程度上影響統(tǒng)計分析結(jié)果的穩(wěn)定性�。因此在模擬的統(tǒng)計分析中需對模擬造成的偏倚進行額外考慮或進行更多的敏感性分析����。模擬通常會在不同的情境下進行多次模擬���,并根據(jù)模擬結(jié)果選擇更適合的臨床情景。例如: 模擬不同入組時間和隨訪時間以找到最為合適的期中分析時間點���。不同情景下模擬結(jié)果的評價工具是操作特征(operating character)����,常用的操作特征包括Ⅰ類錯誤���、檢驗效能�、成功概率(probability of success�,POS)等。
當不能保證參數(shù)假設(shè)的數(shù)據(jù)質(zhì)量時����,可嘗試使用貝葉斯方法迭代更新參數(shù)分布以收斂至穩(wěn)健結(jié)果。此時需要對模擬誤差進行估計����,并闡述迭代次數(shù)的合理性����,如參數(shù)估計隨著迭代如何收斂�。
隨著模型復(fù)雜性及模擬次數(shù)的增加,常規(guī)統(tǒng)計分析軟件可能無法滿足模擬的需要���。因此�,需要在模擬計劃時闡述所使用軟件及相應(yīng)軟件包的名稱����、版本以及在此基礎(chǔ)上的程序代碼內(nèi)容。涉及隨機數(shù)的產(chǎn)生還需說明隨機數(shù)種子數(shù)�,以便后期審查時重現(xiàn)隨機過程。
2.2 模擬的執(zhí)行
藥物臨床試驗應(yīng)當遵守藥物臨床試驗質(zhì)量管理規(guī)范�,同樣,模擬的執(zhí)行過程也應(yīng)處于嚴格的質(zhì)量控制以保證模擬結(jié)果準確可靠���,尤其應(yīng)重點關(guān)注模擬的流程控制����。模擬的整個執(zhí)行過程應(yīng)是可追溯的���,并保留稽查軌跡和操作軌跡����。此外,與實際臨床研究數(shù)據(jù)搜集相同���,模擬的執(zhí)行中也應(yīng)對產(chǎn)生的數(shù)據(jù)進行良好的保存和處理���,以確保情景假設(shè)被準確實現(xiàn)。尤其在使用貝葉斯統(tǒng)計進行參數(shù)估計時����,迭代過程中的數(shù)據(jù)質(zhì)量對于參數(shù)是否可以收斂是非常重要的�。
模擬計劃經(jīng)確定后,在實施過程中一般不得更改���。對于任何的修改應(yīng)在修訂方案中寫明�,且一般應(yīng)經(jīng)再次審核����。為進一步確保模擬執(zhí)行的質(zhì)量,建議由未參與模擬執(zhí)行的專業(yè)人員對過程進行獨立審核���,包括從最初情景假設(shè)呈現(xiàn)到最終結(jié)果生成的全流程以及程序代碼的準確性���。
2.3 模擬結(jié)果的總結(jié)與評價
國家藥品監(jiān)督管理局(NMPA)和歐洲EMA的指導(dǎo)原則均對模擬總結(jié)報告的內(nèi)容和格式有詳細要求���,且兩者結(jié)構(gòu)較相似??偨Y(jié)報告應(yīng)提供模擬過程和結(jié)果的詳細內(nèi)容并可被重現(xiàn),以確保監(jiān)管機構(gòu)可基于此報告作出科學準確的判斷�。在結(jié)果部分中,應(yīng)先展示最終選擇的情景假設(shè)內(nèi)容�,包括模型假設(shè)和參數(shù)假設(shè),以及在當前情景下的直接模擬結(jié)果和進一步的統(tǒng)計分析結(jié)果���。若存在其他敏感性分析內(nèi)容���,也應(yīng)在結(jié)果中展示。
在討論和結(jié)論中����,應(yīng)分別從臨床和統(tǒng)計方面對模擬結(jié)果進行解釋說明,同時還需說明不同模型假設(shè)和參數(shù)假設(shè)對模擬結(jié)果的影響���。模擬研究通常作為臨床研究決策的支持性證據(jù)�,其結(jié)果存在不確定性,因此應(yīng)充分討論模擬結(jié)果對決策的支持性作用����,并綜合評估相應(yīng)風險。例如: 討論最初使用原始數(shù)據(jù)的充分性和代表性���、情景假設(shè)的合理性���、統(tǒng)計分析的科學性、模擬結(jié)果的可解釋性和對決策的適用性等����。
三、應(yīng)用實例: 非等比例假設(shè)下的生存分析設(shè)計
3.1 相關(guān)背景
生存分析被廣泛應(yīng)用于抗腫瘤藥物臨床試驗評價���,是作為時間-事件(time-to-event)數(shù)據(jù)的主要分析方法,如總生存期(overall survival���,OS)����、無進展生存期(progression free survival�,PFS)、無疾病生存期(disease free survival�,DFS)�。
在生存分析中����,通常假設(shè)時間-事件數(shù)據(jù)符合等比例假設(shè),即試驗組和對照組的風險比隨時間變化是恒定的���。而在免疫治療中����,由于延滯效應(yīng)等因素���,其時間事件數(shù)據(jù)通常不滿足等比例風險假設(shè)���,例如: 一項在轉(zhuǎn)移性黑色素瘤中比較納武利尤單抗與伊匹木單抗的研究表明[11],納武利尤單抗存在3個月的延滯效應(yīng)���。而使用基于比例風險假設(shè)的統(tǒng)計學方法應(yīng)用于非比例風險假設(shè)的時間事件數(shù)據(jù)時會產(chǎn)生不適用問題�,包括統(tǒng)計把握度的降低���、不可靠的期中分析結(jié)果�、最終結(jié)果的解釋困難等。
3.2 情景假設(shè)
假設(shè)一項在某癌癥中比較免疫抑制劑A與安慰劑輔助治療的隨機對照研究�,使用DFS作為主要療效指標,并在α為2.5%(單側(cè))的情況下進行優(yōu)效性檢驗����。而由于免疫抑制劑輔助治療中DFS數(shù)據(jù)通常不滿足非等比例假設(shè)的情景,常規(guī)試驗設(shè)計存在把握度較低的情景����,因此使用模擬技術(shù)的目的在于尋找最優(yōu)的事件數(shù)和相應(yīng)樣本量組合�。
假設(shè)DFS數(shù)據(jù)不符合等比例假設(shè)的原因主要在于: ①延滯效應(yīng)。②存在一定數(shù)量的無事件者導(dǎo)致兩組的DFS曲線在末端變平�。這導(dǎo)致試驗組和對照組的風險比在各個時間點不同,例如: 在試驗初期風險比均為1���,而在試驗中期風險比隨時間變化呈非線性變化并固定于某值����。
針對非等比例假設(shè)情況���,假設(shè)以下情景: 延滯效應(yīng)發(fā)生的時間為前3個月; 使用指數(shù)治愈率函數(shù)描述尾端DFS曲線變平情況,即:
其中p表示治愈率�,α表示未治愈人群指數(shù)分布。假設(shè)免疫抑制劑率的治愈率為45%,安慰劑組的治愈率為30%; 假設(shè)免疫抑制劑組和安慰劑組的未治愈人群分布相同����,其參數(shù)α均為0.1。其他情景假設(shè)如下: 受試者按照1∶1的比例分配至試驗組和對照組; 總體Ⅰ類錯誤率為2.5%(單側(cè)); 受試者入組率為每月20例����。
由于假設(shè)DFS曲線為存在延滯效應(yīng)的指數(shù)治愈率函數(shù),則試驗組和對照組的平均風險比(hazard ratio�,HR)在理論上處于0.67(0.3/0.45)至1之間。需要注意的是���,試驗持續(xù)時間不可過短也不可過長: 若試驗完成時間過短���,則平均HR受延滯效應(yīng)影響過大���,無法充分體現(xiàn)試驗組的有效性; 若試驗完成時間過長���,雖然其平均HR無限接近于0.67����,但是其可行性較低���。因此需首先探索可行的平均HR值�,之后再針對不同樣本量下的事件數(shù)進行模擬,以選擇最優(yōu)的樣本量和事件數(shù)組合����。模擬使用檢驗效能和隨訪時間作為操作特征對模擬結(jié)果進行評價。
模擬的實施采用R軟件�,并調(diào)用其中的Hmisc包隨機生成生存分析時間數(shù)據(jù)[12]。每個情景下模擬次數(shù)為1000次�,種子數(shù)設(shè)置為20220701���。
3.3 模擬結(jié)果與結(jié)論
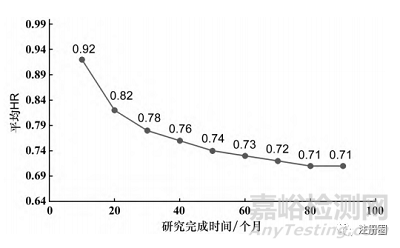
首先在充足樣本量的情況下(1000例),探索研究完成時間10~90個月情況下的平均HR����,模擬結(jié)果見圖1。
▲圖1-不同研究完成時間下的平均 HR
從圖中可以看到���,在研究時間僅為10個月的時候,試驗組和對照組的平均HR為0.92���,即嚴重受到3個月延滯效應(yīng)的影響; 當研究時間>60個月時����,試驗組和對照組的平均HR下降趨勢逐漸平緩至0.71。因此基于實際操作考慮����,可以認為平均HR≤0.73為合理的試驗假設(shè)情景。
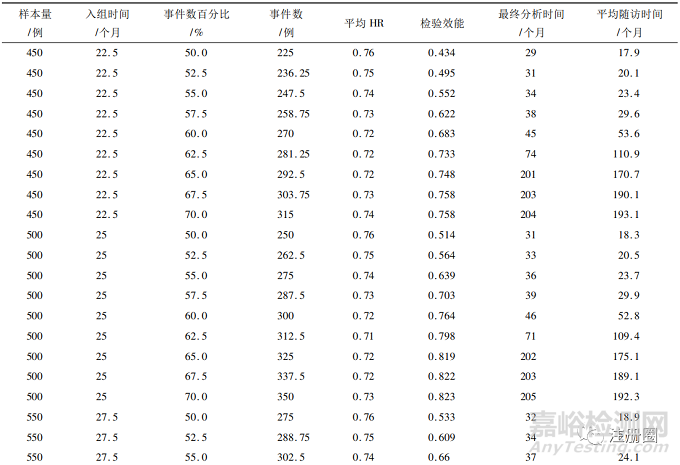
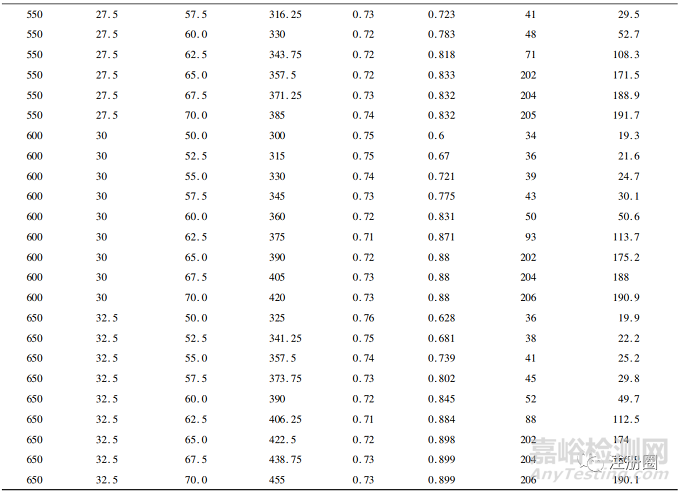
在此基礎(chǔ)上����,分別模擬450~650個樣本量下50%~70%事件數(shù)的情況,結(jié)果見表1�。
▲表1-不同樣本量及事件數(shù)下模擬結(jié)果
清晰版本圖片,詳見《中國新藥雜志》 2023年第32卷第14期
從表中可以看到���,當事件數(shù)>60%時�,最終分析時間和平均隨訪時間顯著增加�,這是因為模擬計劃中假設(shè)試驗組和對照組分別有45%和30%的治愈率����,因此當設(shè)置的事件數(shù)>60%時,需花費更多時間隨訪才會發(fā)生一例事件����。在樣本量為550例及以下的60%事件數(shù)時�,雖然其平均HR已達到0.72�,但其檢驗效能不足80%。在600例樣本量的60%事件數(shù)(情景1)時����,其檢驗平均HR為0.72的效能達到83.1%,在650例樣本量的57.5%事件數(shù)(情景2)時����,其檢驗平均HR為0.73的效能達到80.2%。
綜上所述�,情景1和情景2均能滿足平均HR和檢驗效能的要求。在決策選擇最優(yōu)組合時����,可結(jié)合最終分析時間和平均隨訪時間進行綜合分析。例如: 情景1比情景2少50例受試者�,若受試者入組成本較高的情況下可選擇情景1; 情景2雖然增加了受試者數(shù)量,但其最終分析時間和平均隨訪時間均要短于情景1�,因此若在試驗的時間成本較高情況下,可以選擇情景2����。
四�、討論
在當今臨床研究各方面要求提高的情況下[13-16]����,模擬技術(shù)可以在臨床研究設(shè)計時更精確判斷實施過程中各方面因素的影響����,為具體的試驗設(shè)計和實施提供準確指導(dǎo)[17-18]。模擬技術(shù)可以帶來顯著優(yōu)勢�。首先,基于模擬技術(shù)可以盡早結(jié)束無價值研究�,或者優(yōu)化研究設(shè)計以期在更短時間和更低成本中達到預(yù)設(shè)試驗?zāi)康亩鴾p少臨床研究成本[19]; 其次,模擬技術(shù)可以在臨床試驗開展前探索不同因素對試驗的影響[20]�,在一定限度上規(guī)避臨床失敗原因[21],提高臨床試驗成功率; 最后����,在非常規(guī)臨床試驗條件情況下,模擬技術(shù)具有解決復(fù)雜問題能力[1]����,如上述非等比例假設(shè)下的生存分析試驗設(shè)計。
模擬技術(shù)的實施不是盲目探索所有因素的影響情況����,而應(yīng)基于對情景假設(shè)的充分理解并預(yù)估出可能的結(jié)果和影響因素����。在上述的應(yīng)用實踐中�,對于非等比例情況下假設(shè)了延滯效應(yīng)和指數(shù)治愈率函數(shù),在模擬實施的研究中則要考慮到這2項假設(shè)所帶來的影響�。首先是試驗的持續(xù)時間不可過短,以避免延滯效應(yīng)影響而導(dǎo)致的假陰性; 同時也要考慮到試驗組和對照組有相應(yīng)的治愈率����,因此設(shè)定的事件數(shù)存在上限,以避免過長的隨訪時間���。
模擬計劃方案時應(yīng)考慮模擬的復(fù)雜度�,尤其是模擬內(nèi)容包含較多因素時����。雖然充足的模擬次數(shù)可以得到可靠的結(jié)果,但是復(fù)雜因素下的一次模擬可能需要幾小時甚至幾天���。因此模擬計劃需充分考慮模擬的可行性���,并可通過預(yù)試驗或預(yù)模擬盡可能地縮小情景假設(shè)中的不定因素,將模擬內(nèi)容聚焦于最需了解的內(nèi)容。在本文的應(yīng)用實踐中���,僅針對樣本量和事件數(shù)進行了模擬����,其他情景假設(shè)為固定值或較為簡單的情景���,例如假設(shè)受試者入組時間為每月20例,但在實際臨床研究中受試者的入組速度并不完全符合均勻分布�,再例如模擬中并未假設(shè)脫落等刪失情況。因此在使用模擬技術(shù)的結(jié)果進行決策時���,應(yīng)充分考慮到實際問題����。
藥物臨床試驗的根本目的在于評價和確定藥物的臨床療效���,從而綜合判斷藥物的風險獲益����。模擬技術(shù)雖然在一定限度上可以提升臨床試驗的成功率�,但僅依靠模擬技術(shù)得到的臨床結(jié)果或使用模擬技術(shù)反轉(zhuǎn)臨床研究的無效結(jié)論是不可接受的。因此在使用模擬技術(shù)時,應(yīng)根據(jù)整體藥物研發(fā)路徑和當前所處階段���,確定模擬技術(shù)的具體作用和產(chǎn)生結(jié)果的證據(jù)強度����。
參考文獻
[1] ABBAS I. Modeling and simulation in clinical trials[R]. SpringSim ( MSM) . 2016: 1.
[2] 國家藥品監(jiān)督管理局藥品審評中心. 模型引導(dǎo)的藥物研發(fā)技術(shù)指導(dǎo)原則[EB/OL]. ( 2020 - 12 - 31) [2021 - 12 - 23]. https: / /www. cde. org. cn /zdyz/domesticinfopage? zdyzIdCODE =e0651af6eba8cc2 f5f31efb7add1f0a0.
[3] Food and Drug Administration ( FDA) . Adaptive Design ClinicalTrials for Drugs and Biologics Guidance for Industry[EB/OL].( 2019 - 11 - 29) [2021 - 12 - 23]. https: / /www. fda. gov /regulatory-information /search-fda-guidance-documents/adaptive-design-clinical-trials-drugs-and-biologics-guidance-industry.
[4] Food and Drug Administration ( FDA) . Interacting with the FDA on Complex Innovative Trial Designs for Drugs and Biological Products[EB /OL]. ( 2021 - 01 - 22) [2021 - 12 - 23]. https: / /www. fda. gov /regulatory-information /search-fda-guidancedocuments/interacting-fda-complex-innovative-trial-designs-drugs and-biological-products.
[5] EFPIA MID WORKGROUP����,MARSHALL SF,BURGHAUS R���,et al. Good practices in model-informed drug discovery and development: practice���,application,and documentation[J]. CPT Pharmacometrics Syst Pharmacol����,2016,5( 3) : 93 - 122.
[6] GAL J���,MILANO G����,F(xiàn)ERRERO JM,et al. Optimizing drug development in oncology by clinical trial simulation: why and how?[J]. Brief Bioinform����,2018,19( 6) : 1203 - 1217.
[7] SMITH MK���,MARSHALL A. Importance of protocols for simulation studies in clinical drug development[J]. Stat Methods Med Res����,2011�,20( 6) : 613 - 622.
[8] GIOVAGNOLI A����,ZAGORAIOU M. Simulation of Clinical Trials: a review with emphasis on the design issues[J]. Statistica,2012�,72( 1) : 63 - 80.
[9] O’KELLY M,ANISIMOV V����,CAMPBELL C,et al. Proposed best practice for projects that involve modelling and simulation[J]. Pharm Stat���,2017�,16( 2) : 107 - 113.
[10] O’KELLY M,ANISIMOV V�,CAMPBELL C,et al. Proposed best practice for projects that involve modelling and simulation[J]. Pharm Stat�,2017,16( 2) : 107 - 113.
[11] WEBER J���,MANDALA M����,VECCHIO M���,et al. Adjuvant thera py with nivolumab ( NIVO) versus ipilimumab ( IPI) after complete resection of stage III/IV melanoma: updated results from aphase III trial ( CheckMate 238) [J]. J Clin Oncol����,2018�,36( Suppl 15) : S9502.
[12] HARRELL JR FE,HARRELL JR MFE. Package‘hmisc’[J].CRAN����,2019: 235 - 236.
[13] HOWIE LJ,PEPPERCORN JM. The ethics of clinical trials for cancer therapy[J]. N C Med J�,2014,75( 4) : 270 - 273.
[14] SHAMY MCF���,STAHNISCH FW����,HILL MD. Fallibility: a new perspective on the ethics of clinical trial enrollment[J]. Int J Stroke,2015���,10( 1) : 2 - 6.
[15] ROSENBLATT M. The large pharmaceutical company perspective[J]. N Engl J Med����,2017���,376( 1) : 52 - 60.
[16] TANG C���,SHERMAN SI���,PRICE M���,et al. Clinical trial charac teristics and barriers to participant accrual: the MD Anderson cancer center experience over 30 years,a historical foundation fortrial improvement[J]. Clin Cancer Res���,2017����,23( 6) : 1414 -1421.
[17] 李若冰,言方榮�,王駿. 貝葉斯統(tǒng)計在兒童用藥有效性外推中的應(yīng)用[J]. 中國醫(yī)藥工業(yè)雜志,2022�,53 ( 11) : 1606 -1611.
[18] 李若冰,李健���,王駿. 模擬技術(shù)應(yīng)用于臨床研究的監(jiān)管現(xiàn)狀及阿達木單抗案例分析[J]. 中國新藥雜志�,2023����,32( 2) :198 - 204.
[19] GIRARD P,CUCHERAT M���,GUEZ D����,et al. Clinical trial simulation in drug development[J]. Therapie,2004�,59 ( 3) : 287 -295,297 - 304.
[20] VEYRAT-FOLLET C����,BRUNO R����,OLIVARES R���,et al. Clinical trial simulation of docetaxel in patients with cancer as a tool for dosage optimization[J]. Clin Pharmacol Ther���,2000,68( 6) : 677 - 687.
[21] GIRARD P. Clinical trial simulation: a tool for understanding study failures and preventing them[J]. Basic Clin Pharmacol Toxicol���,2005����,96( 3) : 228 - 234.