摘要 目的:促進藥品上市許可持有人(MAH)制度在我國持續(xù)發(fā)展,為醫(yī)藥行業(yè)高質(zhì)量發(fā)展提供借鑒�。方法:系統(tǒng)梳理藥品MAH制度實施以來,2020-2022年全國藥品申請及抽樣的相關(guān)數(shù)據(jù)����,并隨機抽取150家藥品生產(chǎn)企業(yè)現(xiàn)場檢查相關(guān)數(shù)據(jù),匯總藥品MAH質(zhì)量管理現(xiàn)狀及存在問題���,分析總結(jié)藥品MAH制度對我國藥品創(chuàng)新����、審評審批及質(zhì)量監(jiān)管等重點環(huán)節(jié)帶來的影響���,提出參考性建議���。結(jié)果與結(jié)論:藥品MAH制度在激發(fā)藥品創(chuàng)新積極性����、優(yōu)化行業(yè)資源配置方面已初見成效����,建議持續(xù)強化藥品MAH主體責(zé)任,全面提高藥品監(jiān)管能力���,提升檢查員整體素質(zhì),持續(xù)深化藥品審評審批制度改革���,構(gòu)筑符合中國國情的藥品MAH制度���。
藥品上市許可持有人(Marketing AuthorizationHolder,MAH)制度是指取得藥品注冊證書的企業(yè)或者藥品研制機構(gòu)等主體對藥品質(zhì)量承擔(dān)全生命周期主要責(zé)任的制度[1]����。藥品MAH制度對于促進藥品創(chuàng)新、提高藥品質(zhì)量�、整合資源配置以及推動行業(yè)發(fā)展等方面具有重要意義,能夠促進落實藥品全生命周期主體責(zé)任�,推進對藥品的科學(xué)監(jiān)管[2]���。自20世紀(jì)60年代起,歐盟���、美國�、日本等發(fā)達國家和地區(qū)開始實行藥品MAH制度并對其進行優(yōu)化完善[3]�。自2015年起,我國正式將藥品MAH制度作為藥品法律法規(guī)改革的核心內(nèi)容之一���,隨著新修訂《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》)[4-5]和《中華人民共和國疫苗管理法》(以下簡稱《疫苗管理法》)于2019年12月1日的實施���,藥品MAH制度在我國正式落地生根。2020年����,國家藥品監(jiān)督管理局(以下簡稱國家藥監(jiān)局)發(fā)布新修訂《藥品注冊管理辦法》《藥品生產(chǎn)監(jiān)督管理辦法》等文件[6],對藥品MAH制度具體細(xì)化����,構(gòu)建起了符合我國國情的藥品MAH制度。
本文系統(tǒng)梳理了藥品MAH制度實施以來���,2020-2022年全國藥品申請及抽樣的相關(guān)數(shù)據(jù)���,并隨機抽取150家藥品生產(chǎn)企業(yè)現(xiàn)場檢查相關(guān)數(shù)據(jù)���,匯總藥品MAH質(zhì)量管理現(xiàn)狀及存在問題,分析總結(jié)藥品MAH制度對我國藥品創(chuàng)新����、審評審批以及質(zhì)量監(jiān)管等重點環(huán)節(jié)帶來的影響,提出參考性建議�,以期促進藥品MAH制度在我國持續(xù)發(fā)展,同時為醫(yī)藥行業(yè)高質(zhì)量發(fā)展提供借鑒����。
1�、 藥品MAH制度概述
藥品MAH制度是國際上普遍實行的藥品管理制度,即藥品上市許可與生產(chǎn)許可分離�,上市藥品的所有權(quán)和生產(chǎn)權(quán)可分離[7]。在該制度下�,藥品生產(chǎn)企業(yè)和MAH可以是相同主體,也可以是單獨的主體���。歐盟等發(fā)達國家在醫(yī)藥領(lǐng)域普遍采取MAH制度[8]����,例如,歐盟藥品上市許可有3種審批程序����,即互認(rèn)審批、單獨分散審批與集中審批[9]����;美國MAH制度未對藥品類別進行限制,但對于生物制品許可采用特殊的MAH制度設(shè)計���;日本MAH制度采用資格準(zhǔn)入型���,給MAH頒發(fā)行政許可,并采取生產(chǎn)/銷售3人管理的模式[10]�。
十一屆三中全會以來,隨著我國制藥行業(yè)風(fēng)發(fā)泉涌���,在原藥品與醫(yī)療器械審評審批制度下���,審評審批周期長、藥物研發(fā)動力不足等問題日益凸顯�,藥品監(jiān)管不斷改革���。為解決問題、促進發(fā)展���,我國逐步開始建立藥品MAH制度�。2015年11月4日����,隨著《全國人民代表大會常務(wù)委員會關(guān)于授權(quán)國務(wù)院在部分地方開展藥品上市許可持有人制度試點和有關(guān)問題的決定》的通過, MAH 試點工作授權(quán)在全國10個?。ㄊ校╅_展,期限為3年[11-12]���,關(guān)于藥品MAH制度改革試點的大幕在我國正式拉開����。在試點工作的基礎(chǔ)上���,2019年新修訂《藥品管理法》《疫苗管理法》的正式實施,標(biāo)志著我國藥品MAH制度的正式實行����。其中設(shè)立專章確定了MAH制度,使MAH制度在全國范圍內(nèi)正式“上市”,該項法律的實施�,將有利于提升創(chuàng)新創(chuàng)優(yōu)、整合資源配置�,促進行業(yè)升級[13]。后續(xù)國家藥監(jiān)局陸續(xù)發(fā)布《藥品注冊管理辦法》《藥品生產(chǎn)監(jiān)督管理辦法》等文件�,并于2020年2月再次發(fā)布《藥品MAH檢查程序》(征求意見稿)及《藥品MAH檢查要點》(征求意見稿),就藥品MAH的檢查基本程序及要點進行了說明并征求意見�。2021年5月,國家藥監(jiān)局正式發(fā)布《藥品檢查管理辦法》(試行)�,2022年3月再次發(fā)布了《藥品上市許可持有人檢查要點》(征求意見稿),部分省級藥品監(jiān)督管理部門按照現(xiàn)有法律法規(guī)����,進一步細(xì)化編制了各自轄區(qū)內(nèi)的檢查文件,符合我國國情的藥品MAH制度已基本構(gòu)建���。
2����、 MAH制度實施以來我國藥品申請情況分析
2.1 總體情況
根據(jù)國家藥品監(jiān)督管理局藥品審評中心的官方網(wǎng)站數(shù)據(jù)����,2023年2月,我國國產(chǎn)藥品批準(zhǔn)文號數(shù)量已達154933件�,較2021年年底增長3912家���,增長率為2.59%。持有《藥品生產(chǎn)許可證》企業(yè)已達8116家���,較2021年年底增長639家�,增長率為8.55%���。自行生產(chǎn)和委托生產(chǎn)持有人已達7116家����。藥品MAH制度在激發(fā)藥品創(chuàng)新積極性����、優(yōu)化行業(yè)資源配置方面已初見成效。
2.2 申請情況分析
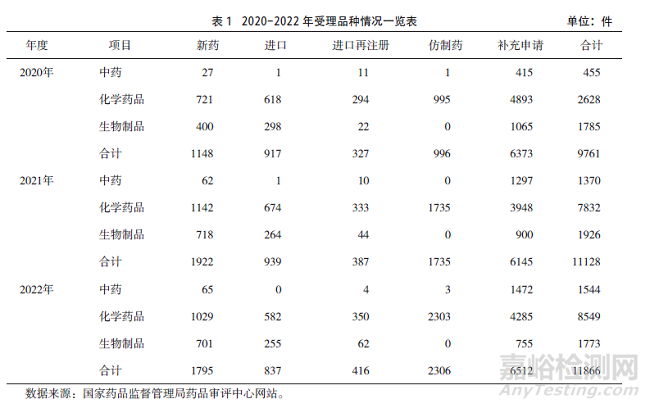
MAH制度的實施�,充分激發(fā)了醫(yī)藥產(chǎn)業(yè)創(chuàng)新活力,大幅調(diào)動了藥品生產(chǎn)企業(yè)內(nèi)生動力����。2020-2022年品種受理件數(shù)同比均有增長,2021����、2022年分別同比增長14.00%、6.63%�。尤其是在新藥品種申請方面,2021年和2022年分別較2020年同比增長67.42%�、56.36%�,其中,中藥品種分別增長129.63%����、140.74%;化學(xué)藥品品種分別增長58.39%���、42.72%���;生物制品品種分別增長79.50%、75.25%����。仿制藥品種申請主要集中在化學(xué)藥品���,2021年和2022年分別較2020年同比增長74.20%����、131.53%。具體情況詳見表1�。
3、 MAH制度實施以來我國藥品監(jiān)管現(xiàn)狀分析
近年來�,藥品監(jiān)管機構(gòu)全面貫徹落實習(xí)近平總書記“四個最嚴(yán)”要求����,統(tǒng)籌發(fā)展和安全、監(jiān)管與服務(wù)���,尤其是在新修訂的《藥品管理法》實施以來�,不斷完善法律法規(guī)���,提升藥品監(jiān)管能力�,建立職業(yè)化專業(yè)化藥品檢查員隊伍���,持之以恒強體系、促創(chuàng)新���,切實提高了藥品質(zhì)量和藥品生產(chǎn)管理水平���。
3.1 抽檢情況分析
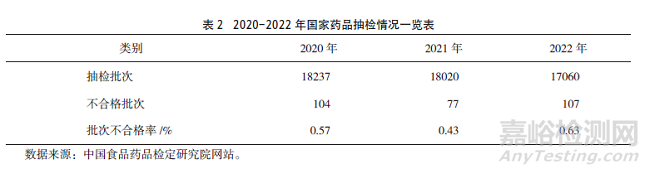
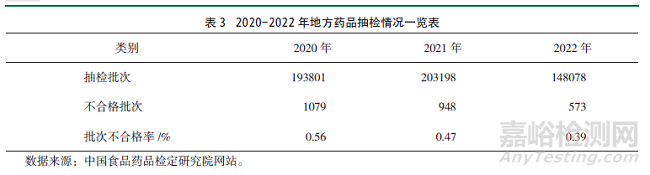
2020-2022年國家和地方藥品抽檢批次不合格率總體有所降低�,例如�,國家藥品抽檢批次不合格率在2021年同比下降24.56%�,2022年同比上升46.51%�,地方藥品抽檢批次不合格率在2021年、2022年分別同比下降16.07%���、17.02%���,具體詳見表2、表3���。
3.2 現(xiàn)場檢查情況分析
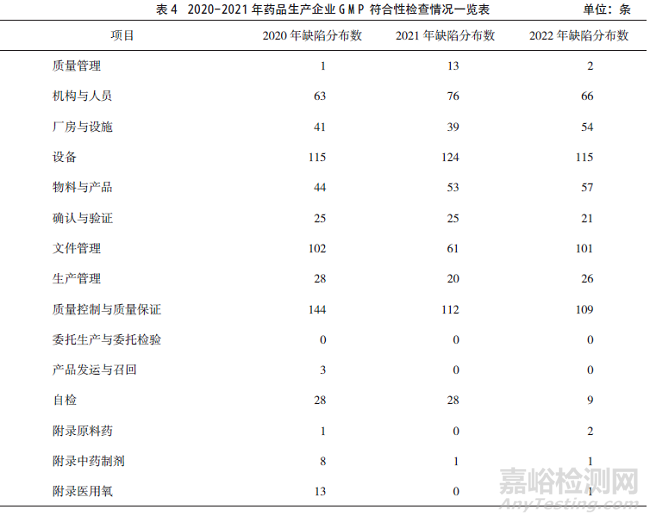
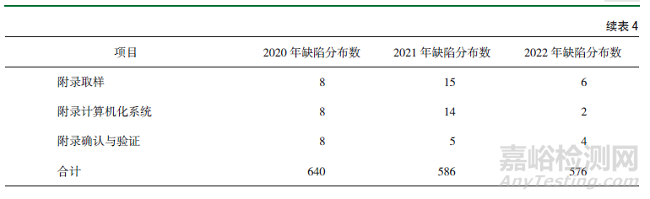
隨機抽取某省2020-2022年150家次(50家次/年)藥品生產(chǎn)企業(yè)現(xiàn)場檢查數(shù)據(jù)����,對照2010年版《藥品生產(chǎn)質(zhì)量管理規(guī)范》進行統(tǒng)計分析����,2020年現(xiàn)場檢查發(fā)現(xiàn)嚴(yán)重缺陷1條�,主要缺陷9條,一般缺陷630條�;2021年發(fā)現(xiàn)嚴(yán)重缺陷9條�,主要缺陷1條���,一般缺陷576條���;2022年發(fā)現(xiàn)嚴(yán)重缺陷2條����,主要缺陷20條,一般缺陷554條���;缺陷項目主要集中在質(zhì)量控制與質(zhì)量保證����、設(shè)備���、文件管理���、機構(gòu)與人員。由此可見���,一方面隨著職業(yè)化專業(yè)化藥品檢查員整體素質(zhì)的不斷提高���,現(xiàn)場檢查發(fā)現(xiàn)嚴(yán)重缺陷項目和主要缺陷項目的能力在逐年提升;另一方面企業(yè)主體責(zé)任還有待進一步落實���,企業(yè)自查自律還有待進一步強化?���,F(xiàn)場檢查發(fā)現(xiàn)缺陷項目具體分布情況詳見表4�。
4�、 MAH制度實施過程中存在的問題
4.1 非生產(chǎn)企業(yè)型MAH方面
4.1.1 承擔(dān)藥品安全的管理能力不足
此類主體大多為藥品研制機構(gòu)���,面對新《藥品管理法》中MAH“依法對藥品研制�、生產(chǎn)���、經(jīng)營�、使用全過程中藥品的安全性�、有效性和質(zhì)量可控性負(fù)責(zé)”等要求����,其優(yōu)勢體現(xiàn)在研發(fā)階段�,但在生產(chǎn)管理���、銷售管理���、藥品不良反應(yīng)監(jiān)測及報告與處理等其他環(huán)節(jié)則相對薄弱,在相應(yīng)的質(zhì)量管理能力����、風(fēng)險識別、風(fēng)險預(yù)警����、風(fēng)險消除及偏差處理能力等方面明顯存在短板和不足����。
4.1.2 缺乏自行承擔(dān)責(zé)任賠償能力
MAH作為藥品質(zhì)量安全第一責(zé)任人,責(zé)任賠償能力是新《藥品管理法》明確要求其具備的能力之一�,這就要求MAH需具備一定的資產(chǎn)規(guī)模。非生產(chǎn)企業(yè)型MAH一般不具備成熟的生產(chǎn)規(guī)模�,資金基礎(chǔ)不足,風(fēng)險管理能力也較為欠缺����,一旦發(fā)生藥品安全問題����,面臨巨額賠償時�,大多只能通過購買保險或其他擔(dān)保形式保證藥品對人體造成損害時有相應(yīng)的賠償能力����。
4.2 委托生產(chǎn)方面
一方面,MAH委托生產(chǎn)時需與受托方就生產(chǎn)責(zé)任�、質(zhì)量責(zé)任及經(jīng)濟責(zé)任等反復(fù)溝通,尤其是在出現(xiàn)偏差以及藥品質(zhì)量問題時����,因涉及環(huán)節(jié)多����、過程復(fù)雜、牽扯人員廣����,溝通交流難度進一步增大����。同時���,因自身能力原因或地域限制,對受托生產(chǎn)全程指導(dǎo)和監(jiān)督不到位�。而非生產(chǎn)企業(yè)類型的MAH還要面臨在外包服務(wù)價格越來越敏感、藥品質(zhì)量競爭越來越激烈的形勢下����,如何選擇研究機構(gòu)(Contract Research Organization,CRO)或生產(chǎn)機構(gòu)(Contract Manufacturing Organization�,CMO)并實現(xiàn)有效管理的挑戰(zhàn)�。另一方面,異地監(jiān)管尺度不盡一致����。MAH委托生產(chǎn)時,按其自身需求����,既可以委托本省轄區(qū)內(nèi)藥品生產(chǎn)企業(yè),也可以委托省外藥品生產(chǎn)企業(yè)����,甚至可以委托國外制藥企業(yè)生產(chǎn)[14]����。僅就國內(nèi)來講����,目前國家尚未出臺統(tǒng)一的跨省監(jiān)管標(biāo)準(zhǔn)和規(guī)范性文件���,檢查信息共享存在滯后性���,從而影響了藥品異地監(jiān)管的有效性,存在一定的風(fēng)險����。
4.3 監(jiān)管政策制度影響方面
為全面落實MAH質(zhì)量安全主體責(zé)任,加強委托生產(chǎn)持有人監(jiān)督管理���,2023年5月24日,國家藥監(jiān)局就加強委托生產(chǎn)MAH監(jiān)管工作面向社會公開征求意見���,要求“生物制品(疫苗、血液制品除外)�、中藥注射劑����、多組分生化藥委托生產(chǎn)的�,持有人要根據(jù)生產(chǎn)規(guī)模,選派具有相關(guān)領(lǐng)域生產(chǎn)質(zhì)量管理工作經(jīng)歷���、熟悉產(chǎn)品生產(chǎn)工藝和質(zhì)量控制的人員入駐受托生產(chǎn)企業(yè)�,對產(chǎn)品生產(chǎn)管理����、質(zhì)量管理進行現(xiàn)場指導(dǎo)和監(jiān)督,確保生產(chǎn)工藝���、質(zhì)量標(biāo)準(zhǔn)等要求落實到位。”該政策一旦落地���,委托生產(chǎn)的MAH直接面臨的問題便是人員擴招需求以及加重的人力成本����,而市場能否及時滿足大量企業(yè)的人員需求����,也會成為影響企業(yè)推動產(chǎn)品商業(yè)化進程的重要因素����。除此之外�,原料藥目前不得委托他人生產(chǎn),MAH對于研發(fā)原料藥尤其是創(chuàng)新度較高的藥物的積極性有待提高�。
5���、 討論與建議
藥品MAH制度是新修訂《藥品管理法》的核心制度之一���,其全面推廣實施充分釋放了藥品監(jiān)管改革的紅利,可將藥品上市許可與生產(chǎn)許可分離管理[15]����。該制度在促進藥品研發(fā)和創(chuàng)新、優(yōu)化行業(yè)資源配置方面成效顯著[16]����。隨著藥品MAH制度實施的深入實踐,相關(guān)法律�、法規(guī)�、辦法����、標(biāo)準(zhǔn)的不斷完善�,為使藥品MAH制度更加充分地發(fā)揮其制度設(shè)計的優(yōu)勢����,本文基于上述分析,提出相關(guān)建議���,以期為我國醫(yī)藥行業(yè)高質(zhì)量發(fā)展提供參考�。
5.1 持續(xù)強化藥品MAH主體責(zé)任
藥品MAH承擔(dān)藥品全生命周期的主體責(zé)任�,必須持續(xù)具備質(zhì)量保證和質(zhì)量控制能力。作為最關(guān)鍵的責(zé)任主體�,要全面加強自身責(zé)任感和管理能力����,建立現(xiàn)代化數(shù)據(jù)管理體系,保證藥品從研發(fā)�、生產(chǎn)、銷售及使用全過程數(shù)據(jù)的可靠性和真實性���,進一步完善藥物追溯制度和召回機制�,以確保風(fēng)險品種可以第一時間實現(xiàn)可控管理。同時�,持續(xù)完善藥物警戒管理體系,主動制定風(fēng)險管理計劃���,積極開展風(fēng)險監(jiān)測,并將其貫穿藥品管理的整個過程����。同時���,應(yīng)壯大科研團隊,強化人才儲備���,注重員工培訓(xùn),激發(fā)內(nèi)在活力���,優(yōu)化資源配置����,探索研發(fā)與生產(chǎn)創(chuàng)新藥����,拓寬委托生產(chǎn)范圍和條件����,促進產(chǎn)業(yè)升級����,提升企業(yè)的核心競爭力���。
5.2 立足長遠(yuǎn)���,全面提高藥品監(jiān)管能力
為提升監(jiān)管效能�,保障藥品安全���,促進行業(yè)發(fā)展,一要夯實監(jiān)管能力���。推進藥品監(jiān)管能力標(biāo)準(zhǔn)化建設(shè)���,主動改進監(jiān)管方法,注重工作實效���,堅持規(guī)范、嚴(yán)謹(jǐn)�、科學(xué)監(jiān)管���,全面提高監(jiān)管的時效性。二要守牢安全底線���。創(chuàng)新藥品安全監(jiān)管手段����,充分發(fā)揮視頻監(jiān)控���、網(wǎng)絡(luò)監(jiān)測等非接觸式監(jiān)管優(yōu)勢,對風(fēng)險隱患實時監(jiān)測預(yù)警���,從而實現(xiàn)精準(zhǔn)防控���。三要健全法規(guī)體系���、標(biāo)準(zhǔn)體系和科技支撐體系����。大力發(fā)展科學(xué)監(jiān)管和智慧監(jiān)管���,促進藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)的國際合作及檢查標(biāo)準(zhǔn)一致化,推動藥品獲得行政許可的一致性���,推動檢查的統(tǒng)一性���,消除醫(yī)藥產(chǎn)品貿(mào)易壁壘。四要加強區(qū)域協(xié)作����。構(gòu)建跨區(qū)域藥品監(jiān)管、稽查協(xié)作機制���,協(xié)調(diào)解決相關(guān)重大問題����,推進藥品科學(xué)監(jiān)管與創(chuàng)新發(fā)展一體化建設(shè)。五要改革創(chuàng)新����。持續(xù)深化藥品審評審批制度改革,激發(fā)醫(yī)藥產(chǎn)業(yè)創(chuàng)新活力�,助推醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展����。
5.3 轉(zhuǎn)變觀念����,提升檢查員整體素質(zhì)
隨著藥品MAH制度的實施�,品種監(jiān)管的時代已經(jīng)來臨�,審評審批工作任務(wù)的難度加劇����。隨著GMP認(rèn)證取消����,以檢查為中心的監(jiān)管模式將成為主流�。2021年9月24日,國家藥監(jiān)局正式致函藥品檢查合作計劃(Pharmaceutical Inspection Co-operationScheme���,PIC/S),申請啟動預(yù)加入程序����。中國藥品的監(jiān)督檢查體系將在制度設(shè)計�、技術(shù)標(biāo)準(zhǔn)及能力建設(shè)等方面全面與世界接軌����。作為藥品的監(jiān)督管理部門,首先���,必須從監(jiān)管觀念的轉(zhuǎn)變開始,推動藥品檢查員隊伍建設(shè)����,完善藥品檢查體系,加強國際檢查交流合作����,推進藥品檢查資源開放共享����,促進我國藥品監(jiān)管事業(yè)高質(zhì)量發(fā)展����。其次,藥品監(jiān)管需要依靠專業(yè)人員���,打造具有職業(yè)精神和專業(yè)素養(yǎng)的藥品檢查員隊伍是做好藥品科學(xué)監(jiān)管的基石。職業(yè)化專業(yè)化檢查員隊伍的建立�,不僅要注重專業(yè)的覆蓋性�,還要注重合理組合和與實戰(zhàn)經(jīng)驗的相結(jié)合���。最后���,多措并舉����,提升檢查員的職業(yè)歸屬感�。職業(yè)歸屬感的提升,不僅需要強化全國省級藥品檢查機構(gòu)的質(zhì)量管理體系建設(shè)�,更需要積極拓展檢查員職業(yè)發(fā)展空間����,完善檢查員職稱薪酬體系建設(shè)����,努力打造“政治過硬�、素質(zhì)優(yōu)良���、業(yè)務(wù)精湛�、廉潔高效”的職業(yè)化專業(yè)化檢查員隊伍���,接受公眾監(jiān)督����,贏得社會認(rèn)同,保障公眾用藥安全�。