1.DMS和QMS的實(shí)施背景
眾所周知2019年12月1日史上最嚴(yán)的《藥品管理法》開始實(shí)施��,面對(duì)新形勢(shì)新要求新標(biāo)準(zhǔn),藥品企業(yè)應(yīng)以民眾的健康為己任��,以高科技����、高品質(zhì)的產(chǎn)品����、熱情周到的服務(wù)和無私的奉獻(xiàn)精神��,全心全意做好藥��。本文重點(diǎn)介紹如何在藥企質(zhì)量管理工作中注重誠(chéng)信�、關(guān)注品質(zhì),圍繞質(zhì)量管理的數(shù)字化轉(zhuǎn)型開展工作,建立數(shù)字化文件管理系統(tǒng)和質(zhì)量管理系統(tǒng)��,著力打造藥品制造全生命周期的數(shù)字化質(zhì)量管控體系��,確保藥品質(zhì)量安全有效����。
2、DMS(文件管理系統(tǒng))
2.1推進(jìn)和應(yīng)用
文件是質(zhì)量管理系統(tǒng)的基本組成部分����,必須使企業(yè)各項(xiàng)質(zhì)量活動(dòng)有法可依、有章可依�,使行之有效的質(zhì)量管理手段和方法制度化、法規(guī)化����。企業(yè)通常文件數(shù)量龐大�。在文件的約束和正確引導(dǎo)下�,通過電子化質(zhì)量系統(tǒng)文件的實(shí)施來保證質(zhì)量體系的有效運(yùn)行,從內(nèi)至外可見完善文件管理的重要性和必要性��。
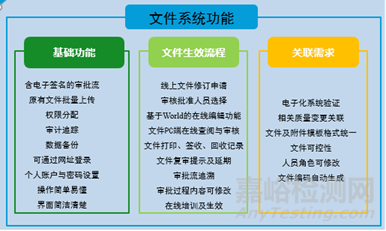
圖1DMS文件系統(tǒng)功能建立親和圖
文件管理系統(tǒng)(DMS)依據(jù)GMP文件的整個(gè)生命周期進(jìn)行合規(guī)管理�。從文件創(chuàng)建/修訂申請(qǐng)即開始介入,提供文件的模板管理��、文件的在線編輯和在線審批��、文件生效和撤銷等流程化控制��。充分參考了以下國(guó)內(nèi)外法規(guī)文件�,使得DMS能夠100%符合質(zhì)量法規(guī)要求:
l 良好自動(dòng)化生產(chǎn)實(shí)踐指南:遵從GxP計(jì)算機(jī)化系統(tǒng)監(jiān)管的風(fēng)險(xiǎn)管理方法(ISPE GAMP 5)
l 現(xiàn)行藥品生產(chǎn)管理規(guī)范(cGMP)
l 中國(guó)GMP(2010版)及附錄《計(jì)算機(jī)化系統(tǒng)》��、《確認(rèn)與驗(yàn)證》
l CFR 21 Part 11 美國(guó)聯(lián)邦法規(guī)21章第11款��,電子記錄與電子簽名
l 歐盟GMP 附錄11《計(jì)算機(jī)化系統(tǒng)》 (Computerized System)
l 歐盟2015年版《數(shù)據(jù)完整性指南》(MHRA GxP Data Integrity Definitions and Guidance for Industry)
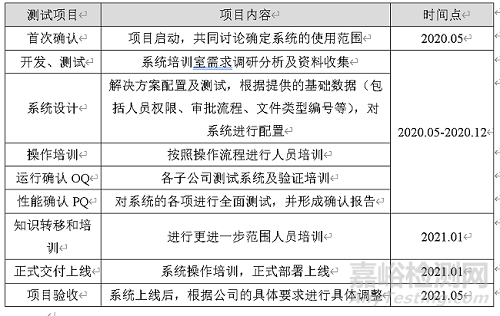
表1 測(cè)試流程與時(shí)間節(jié)點(diǎn)
文件管理根據(jù)文件管理規(guī)程中的文件生效流程而100%配對(duì)的電子化流程����,并要求固定文件正文與附件模板,提高了文件的整體性��,降低了文件因格式問題而退回的修改率和修改時(shí)間����。在授權(quán)管理中加強(qiáng)了對(duì)文件培訓(xùn)的管控,避免了未培訓(xùn)的文件即生效的現(xiàn)象�,由授權(quán)的文件管理人員負(fù)責(zé)對(duì)相關(guān)人員進(jìn)行培訓(xùn)工作,并在文件系統(tǒng)上生成電子培訓(xùn)記錄����,代替以往紙質(zhì)培訓(xùn)文件����,使培訓(xùn)記錄完整有效,培訓(xùn)完成后最終由授權(quán)人員進(jìn)行確認(rèn)。
2023年通過進(jìn)一步優(yōu)化了文件管理系統(tǒng)的文件保密權(quán)限�,將已生效文件升版,增加了文件保密屬性設(shè)置��,確保電子文件符合GMP管理要求��,實(shí)現(xiàn)100%嚴(yán)格受控�。
2.2實(shí)施效果
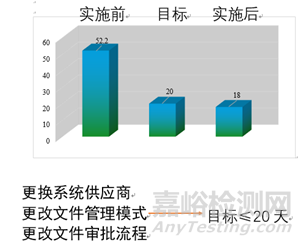
DMS文件系統(tǒng)的電子化上線��,使企業(yè)各項(xiàng)質(zhì)量活動(dòng)有法可依��、有章可依�,使行之有效的質(zhì)量管理手段和方法制度化����、法規(guī)化。在文件的約束和正確引導(dǎo)下����,通過質(zhì)量系統(tǒng)文件的實(shí)施來保證質(zhì)量體系的有效運(yùn)行。DMS上線之后文件生效時(shí)長(zhǎng)由原來的52天縮短為現(xiàn)在的18天����。我公司的文件格式出錯(cuò)率解決97%;審核時(shí)長(zhǎng)降低為之前的47.4%����;生效時(shí)長(zhǎng)降低為之前的39.5%����;符合GMP文件管理要求;文件管理更安全穩(wěn)定�。
圖2 文件管理系統(tǒng)實(shí)施效果
3�、QMS(質(zhì)量管理系統(tǒng))
3.1推進(jìn)和應(yīng)用
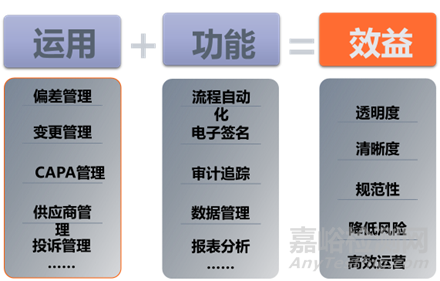
質(zhì)量管理系統(tǒng)QMS涵蓋質(zhì)量策劃��、生產(chǎn)現(xiàn)場(chǎng)質(zhì)量控制��、質(zhì)量保障以及輔助實(shí)驗(yàn)室的質(zhì)量控制流程��,提升質(zhì)量管控效率��,同時(shí)引入SPC����、FEMA等質(zhì)量管理工具,輔助精準(zhǔn)��、高效質(zhì)量控制����。目前我司QMS上線偏差、變更�、CAPA三個(gè)質(zhì)量體系管理模塊����,將質(zhì)量管理各環(huán)節(jié)的追溯關(guān)聯(lián)��,拉通各環(huán)節(jié)數(shù)字?jǐn)帱c(diǎn)�,實(shí)現(xiàn)線上質(zhì)量預(yù)測(cè)����、質(zhì)量分析和質(zhì)量追溯,不斷提升數(shù)據(jù)完整性�。三個(gè)流程集成到一個(gè)平臺(tái)����,統(tǒng)一管理,通過整合相關(guān)的事件和步驟��、自動(dòng)化工作流��、趨勢(shì)分析和報(bào)表圖表功能等,幫助企業(yè)提高質(zhì)量管理效率�。
圖3 QMS 運(yùn)行界面
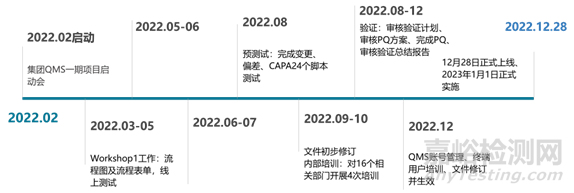
下面重點(diǎn)介紹三個(gè)質(zhì)量流程:變更�、偏差、CAPA��,對(duì)其中的流程進(jìn)行了反復(fù)測(cè)試和優(yōu)化。對(duì)驗(yàn)證計(jì)劃進(jìn)行審核����,與第三方提出需求。在正式驗(yàn)證開始前�,根據(jù)腳本對(duì)流程進(jìn)行預(yù)測(cè)試����,為了使QMS用戶提前了解系統(tǒng)并熟悉其界面和操作�,我們提前對(duì)公司內(nèi)部相關(guān)人員進(jìn)行QMS流程及操作培訓(xùn)�,共進(jìn)行4場(chǎng)培訓(xùn)��,涉及15個(gè)部門培訓(xùn)部門。后續(xù)確認(rèn)我司確定需要的賬號(hào)信息��,組織第三方對(duì)所有相關(guān)人員進(jìn)行了終端用戶培訓(xùn)�,完成對(duì)相關(guān)文件的修訂、審核����、培訓(xùn)工作��。
圖4 QMS測(cè)試流程與時(shí)間節(jié)點(diǎn)
QMS于2023年正式實(shí)施后,系統(tǒng)運(yùn)行平穩(wěn)�,除及時(shí)解答用戶問題并開展針對(duì)性培訓(xùn)外��,也及時(shí)記錄在使用過程中系統(tǒng)需優(yōu)化的模塊����。具體情況如下:
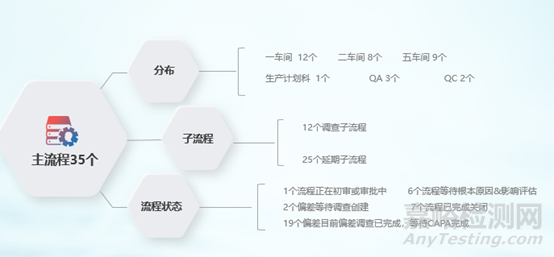
(1)偏差模塊上線情況:
圖5 QMS偏差流程運(yùn)行
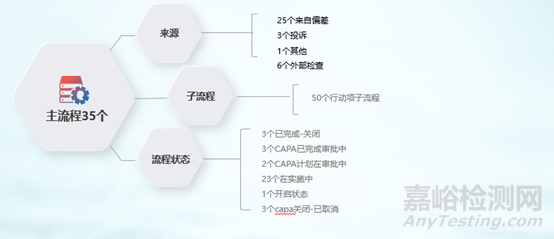
(2)CAPA模塊上線情況:
圖6 QMSCAPA流程運(yùn)行
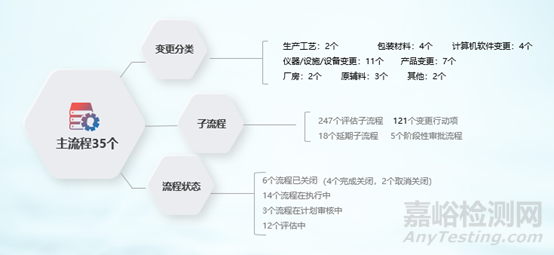
(3)變更模塊上線情況:
圖7 QMS 變更流程運(yùn)行
QMS系統(tǒng)中變更、偏差��、CAPA流程的處理與紙質(zhì)流程對(duì)比�,系統(tǒng)上的職責(zé)分工更加明確�,具有郵件提醒功能,流程間可相互關(guān)聯(lián)�,顯著提高了流程處理效率。
3.2實(shí)施效果
(1)QMS整合并規(guī)范藥品全生命周期質(zhì)量管理活動(dòng)的系統(tǒng)�,實(shí)現(xiàn)全面管理�。將離散的孤立流程,分散的獨(dú)立系統(tǒng)進(jìn)行流程內(nèi)核流程間的整合和連接��。
圖8 QMS實(shí)現(xiàn)流程內(nèi)整合
圖9 QMS實(shí)現(xiàn)流程間整合
(2)QMS實(shí)現(xiàn)全面電子化管理,無紙化效率迅速提升
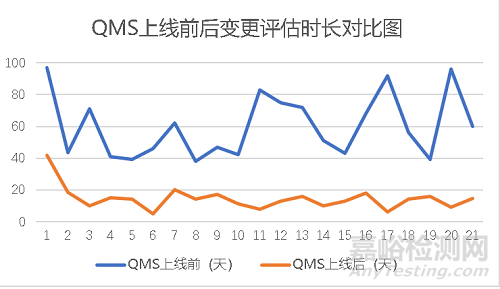
QMS質(zhì)量管理系統(tǒng)通過設(shè)置行動(dòng)項(xiàng)完成時(shí)間與增加提醒措施可以有效地降低變更評(píng)估時(shí)長(zhǎng)與變更實(shí)施時(shí)長(zhǎng),從而起到降低變更流程完成時(shí)間的目的����。變更流程平均完成時(shí)長(zhǎng)降低為之前的47.8%����,大大提高了變更流程效率,節(jié)省人力與時(shí)間成本�。且信息化的手段能更好的對(duì)應(yīng)GMP合規(guī)��,使數(shù)據(jù)可靠性增強(qiáng)�,質(zhì)量體系要求提高。
圖10 QMS變更流程實(shí)施效果
4����、總結(jié)
(1)通過DMS和QMS的上線使用,藥企的藥品質(zhì)量的管理能力進(jìn)一步提升�。
藥品制造數(shù)字化轉(zhuǎn)型的變革,帶來的是整體質(zhì)量管理能力和人員質(zhì)量意識(shí)的提升��。為了保障藥品制造全生命流程的合規(guī)性以及滿足法律法規(guī)的嚴(yán)謹(jǐn)性,硬件設(shè)施的合理選型��、全面規(guī)劃部署和軟件完整性及可追溯性的合規(guī)性驗(yàn)證工作��,兩者缺一不可��。質(zhì)量部門協(xié)同合作�,針對(duì)數(shù)字化轉(zhuǎn)型工作規(guī)范地、嚴(yán)謹(jǐn)?shù)亍⒂行虻赝瓿闪烁黜?xiàng)工作�。不僅軟硬件的質(zhì)量管理更為合理、合規(guī)��,同時(shí)培養(yǎng)了一批擁有質(zhì)量管理以及計(jì)算機(jī)系統(tǒng)應(yīng)用的復(fù)合型人才��,為全面質(zhì)量管理建設(shè)����,提供了強(qiáng)大源動(dòng)力。
(2)通過DMS和QMS的上線使用��,藥品質(zhì)量風(fēng)險(xiǎn)管控的能力進(jìn)一步提升����。
只要有流程的地方����,就存在質(zhì)量風(fēng)險(xiǎn)。DMS和QMS系統(tǒng)��,實(shí)現(xiàn)了全流程文件����、數(shù)據(jù)參數(shù)的及時(shí)、真實(shí)����、連續(xù)和可追溯��,將各項(xiàng)風(fēng)險(xiǎn)降至了最低,這為質(zhì)量體系優(yōu)化提供了強(qiáng)大的支撐��。
(3)通過DMS和QMS的上線使用��,質(zhì)量管理效率的進(jìn)一步提升�。
藥品制造的數(shù)字化轉(zhuǎn)型��,幫助企業(yè)打破傳統(tǒng),重塑高質(zhì)量管理流程��。無紙化操作下數(shù)據(jù)信息的傳遞效率達(dá)到了以往傳統(tǒng)模式下難以企及的高度��,數(shù)字化轉(zhuǎn)型使藥品制造全生命周期流程更為快速、便捷和透明��。