一���、背景
細(xì)胞治療是利用來(lái)自患者或供體的活細(xì)胞來(lái)替代受損或患病的細(xì)胞或刺激身體的免疫反應(yīng)或再生的治療�����。根據(jù)細(xì)胞的種類來(lái)源分為干細(xì)胞治療和免疫細(xì)胞治療���,免疫細(xì)胞主要是T細(xì)胞、NK等免疫細(xì)胞���。干細(xì)胞治療的監(jiān)管與免疫細(xì)胞治療的監(jiān)管有所差異�����。本文將重點(diǎn)討論免疫細(xì)胞的監(jiān)管以及結(jié)合已上市CAR-T治療產(chǎn)品�,分析相關(guān)審評(píng)考量�����。
目前�,我國(guó)對(duì)免疫細(xì)胞治療產(chǎn)品分別按照醫(yī)療技術(shù)和藥品同時(shí)監(jiān)管,關(guān)于按照醫(yī)療技術(shù)目前的監(jiān)管要求�,2018年國(guó)家衛(wèi)健委發(fā)布《醫(yī)療技術(shù)臨床應(yīng)用管理辦法》�,指出可在醫(yī)療機(jī)構(gòu)開展臨床研究�,不可臨床應(yīng)用。
二���、免疫細(xì)胞治療產(chǎn)品的監(jiān)管路徑
2.1 作為醫(yī)療技術(shù)監(jiān)管的發(fā)展沿革
關(guān)于醫(yī)療技術(shù)的臨床應(yīng)用管理���,最先出臺(tái)的是2009年3月由原衛(wèi)生部引發(fā)的《醫(yī)療技術(shù)臨床應(yīng)用管理辦法》,明確對(duì)醫(yī)療技術(shù)臨床應(yīng)用實(shí)行分類���、分級(jí)管理���,明確將醫(yī)療技術(shù)分為三類,對(duì)第二類�、第三類醫(yī)療技術(shù)實(shí)施準(zhǔn)入管理,三類醫(yī)療技術(shù)應(yīng)用于臨床由衛(wèi)生部審核監(jiān)管�����,二類省級(jí)衛(wèi)生部門即可���。
同年5月衛(wèi)生部發(fā)布《首批允許臨床應(yīng)用的第三類醫(yī)療技術(shù)目錄》���,T細(xì)胞、NK細(xì)胞等細(xì)胞免疫治療技術(shù)被列為第三類醫(yī)療技術(shù)目錄���。
由于免疫細(xì)胞臨床應(yīng)用的亂象�����,國(guó)家對(duì)免疫細(xì)胞治療的臨床應(yīng)用進(jìn)行收緊�,2018年國(guó)家衛(wèi)健委發(fā)布《醫(yī)療技術(shù)臨床應(yīng)用管理辦法》�����,明確細(xì)胞治療技術(shù)不作為臨床應(yīng)用管理�。
2019年國(guó)家衛(wèi)健委發(fā)布《體細(xì)胞治療臨床研究和轉(zhuǎn)化應(yīng)用管理辦法(試行)》(征求意見稿),在衛(wèi)健委的文件解讀中���,指出在臨床研究取得體細(xì)胞治療安全性���、有效性等證據(jù)的基礎(chǔ)上,總結(jié)形成針對(duì)某種疾?。ㄟm應(yīng)證)的治療方案和技術(shù)標(biāo)準(zhǔn)(包括細(xì)胞治療的種類/途徑、治療劑量/次數(shù)和療程等)���。通過倫理審查�,經(jīng)備案后,可以在開展臨床研究的醫(yī)療機(jī)構(gòu)進(jìn)入轉(zhuǎn)化應(yīng)用�����。
最終�,由于業(yè)界擔(dān)心醫(yī)療機(jī)構(gòu)主導(dǎo)的臨床應(yīng)用缺乏藥品監(jiān)管路徑的質(zhì)量可控、標(biāo)準(zhǔn)統(tǒng)一等問題�����,因而最終并沒有出臺(tái)正式文件���。
2.2 免疫細(xì)胞治療產(chǎn)品依藥品監(jiān)管路徑
藥品監(jiān)管路徑需經(jīng)IND���、NDA申請(qǐng)批準(zhǔn)上市,關(guān)于審評(píng)的技術(shù)指導(dǎo)原則�����,主要有4部�����。
2017年 <<細(xì)胞治療產(chǎn)品研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)>>
2021年 <<免疫細(xì)胞治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(試行)>>
2021年 <<基因修飾細(xì)胞治療產(chǎn)品非臨床研究技術(shù)指導(dǎo)原則(試行)>>
2022年 << 免疫細(xì)胞治療產(chǎn)品藥學(xué)研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)>>
由于免疫細(xì)胞治療產(chǎn)品的特殊性,其研究評(píng)價(jià)區(qū)別于傳統(tǒng)的小分子和大分子藥物���,需要有特殊的考量�����,尤其反應(yīng)在非臨床研究和臨床研究評(píng)價(jià)中。
2.3 ITT路徑
雖然監(jiān)管禁止免疫細(xì)胞產(chǎn)品在醫(yī)療機(jī)構(gòu)進(jìn)行轉(zhuǎn)化應(yīng)用�����,但是卻可以進(jìn)行臨床研究���,即研究者發(fā)起的臨床研究(ITT)�����,目前對(duì)于ITT缺乏系統(tǒng)全面的監(jiān)管細(xì)則�,主要質(zhì)量標(biāo)準(zhǔn)由開展ITT的醫(yī)療機(jī)構(gòu)自行把握�,整體水平參差不齊。另外CAR-T研發(fā)企業(yè)在進(jìn)行IND之前會(huì)選擇進(jìn)行ITT研究�,獲得臨床試驗(yàn)數(shù)據(jù),有利于申報(bào)IND�����,這是CAR-T研發(fā)領(lǐng)域的一個(gè)特點(diǎn)。
因而現(xiàn)階段關(guān)于免疫細(xì)胞治療產(chǎn)品的監(jiān)管已經(jīng)明晰�����,可以總結(jié)如下:關(guān)于臨床研究實(shí)行雙軌制�����,可以走醫(yī)療技術(shù)路徑開展臨床研究���,也可以走藥品監(jiān)管路徑向NMPA申請(qǐng)IND開展臨床試驗(yàn)���,但是最終的臨床應(yīng)用需按照藥品監(jiān)管路徑進(jìn)行審評(píng)審批。
三�����、已上市CAR-T細(xì)胞治療產(chǎn)品
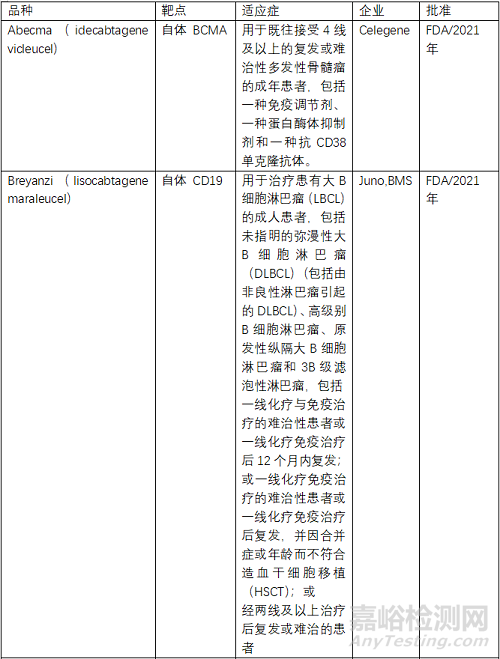
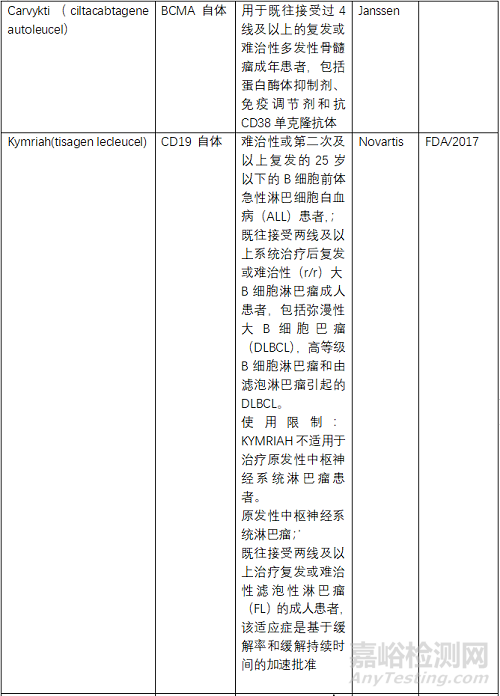
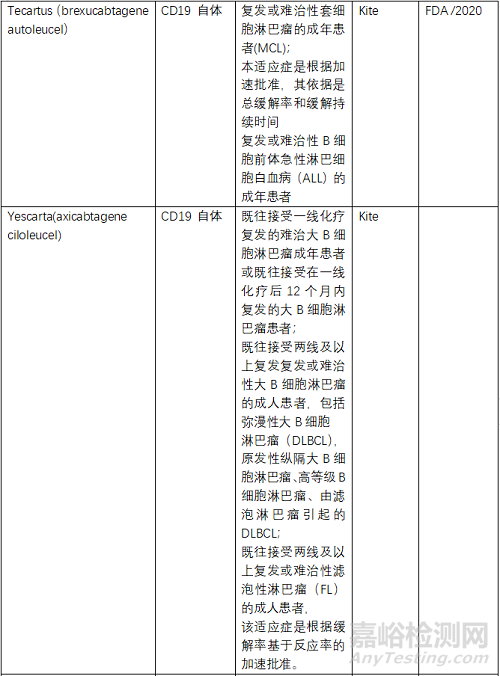
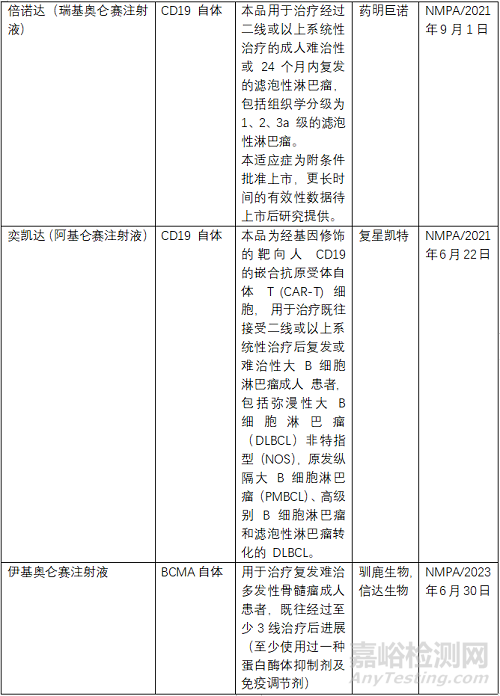
目前FDA共批準(zhǔn)了6款CAR-T產(chǎn)品���,2個(gè)靶點(diǎn)為BCMA、4個(gè)為CD19���,均為自體CAR-T�����。NMPA批準(zhǔn)了3款���,其中復(fù)星凱特的產(chǎn)品來(lái)自美國(guó)Kite�����。馴鹿生物靶點(diǎn)為BCMA,其余2款靶點(diǎn)為CD19�����,均為自體CAR-T�����。
四���、非臨床研究審評(píng)考量
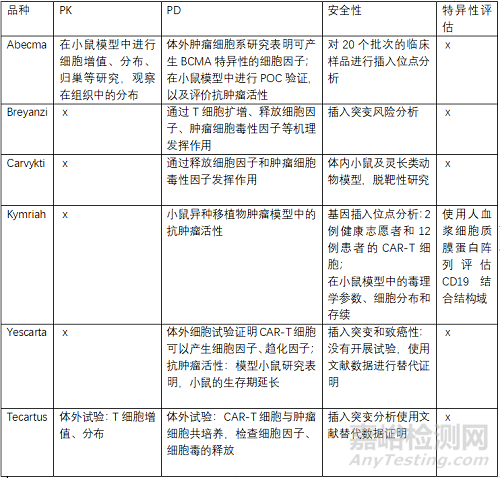
CAR-T細(xì)胞產(chǎn)品臨床前主要評(píng)價(jià)PK���、以細(xì)胞增殖�、分布等指標(biāo)�,PD,以釋放的細(xì)胞因子���、趨化因子�、抗腫瘤活性等指標(biāo)���,安全性重點(diǎn)評(píng)價(jià)插入突變分析等�。
>>案例分析
五���、臨床研究審評(píng)考量
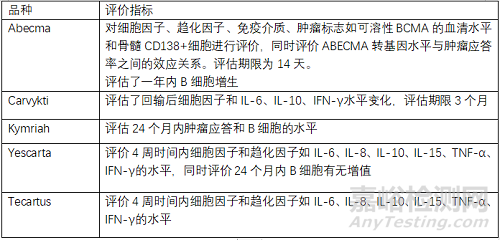
5.1 藥效學(xué)(PD)評(píng)價(jià)
藥效學(xué)評(píng)價(jià):評(píng)價(jià)回輸后細(xì)胞因子�、趨化因子�、免疫介質(zhì)、腫瘤標(biāo)志物(可溶性BCMA的血清水平和骨髓CD138+細(xì)胞)等水平變化�,同時(shí)評(píng)價(jià)抗腫瘤活性,應(yīng)答率等指標(biāo)���。
>>案例分析
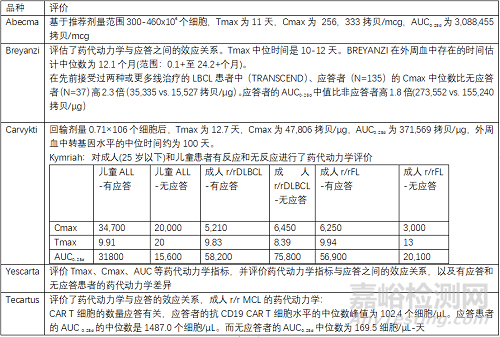
5.2 藥代動(dòng)力學(xué)(PK)評(píng)價(jià)
藥代動(dòng)力學(xué)評(píng)價(jià)考量為回輸后CAR-T細(xì)胞的增殖���、分化等變化,以Tmax Cmax AUC等表示�����。
>>案例分析
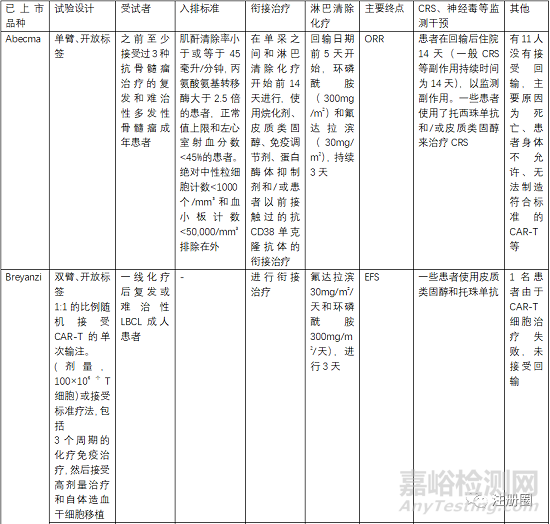
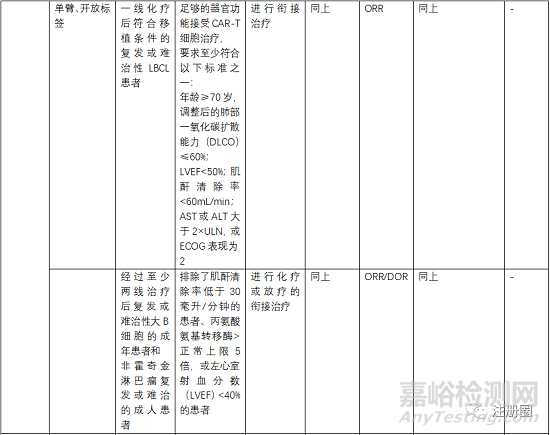
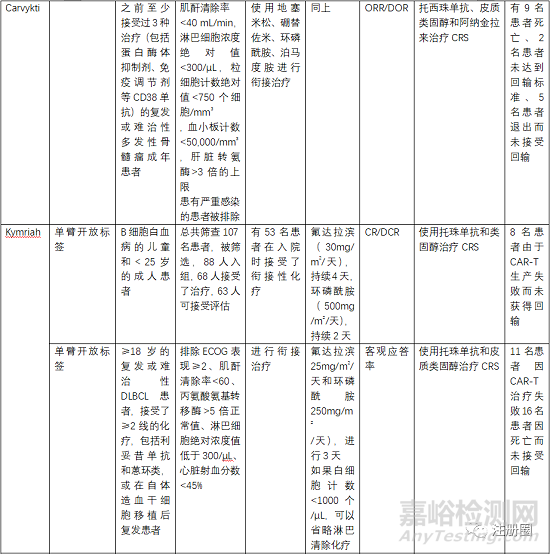
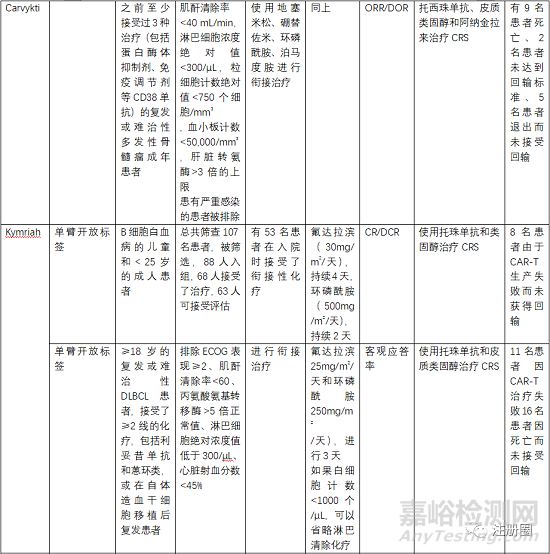
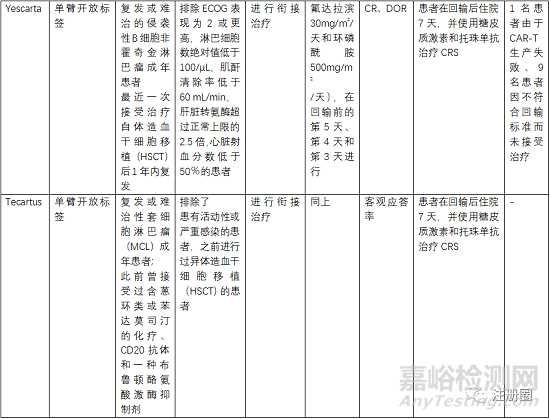
5.3 有效性與安全性評(píng)價(jià)
評(píng)估有效性和安全性的確證性臨床關(guān)注點(diǎn)有受試者篩選、開放標(biāo)簽的單臂試驗(yàn)�、以O(shè)RR(總緩解率)、客觀應(yīng)答率���、EFS(無(wú)事件生存期)�����、CR(完全緩解率)等作為主要終點(diǎn)評(píng)價(jià)指���。
受試者篩選的患者一般為3線或末線�,這就決定了給藥方案為單臂設(shè)計(jì),另外對(duì)患者的入排標(biāo)準(zhǔn)進(jìn)行嚴(yán)格控制�,因?yàn)榻?jīng)過末線治療的患者比較虛弱,很多條件達(dá)不到輸注的標(biāo)準(zhǔn)�。安全性一般重點(diǎn)關(guān)注CRS、神經(jīng)毒性和嚴(yán)重感染�����,需要進(jìn)行住院監(jiān)測(cè)和手段干預(yù)�����。一般CRS等持續(xù)時(shí)間最多14天,所以臨床試驗(yàn)中常安排監(jiān)測(cè)7天或14天另外對(duì)于CRS等治療常使用糖皮質(zhì)激素和托珠單抗���。在回輸前需要銜接治療和淋巴清除化療���。由于單采后CAR-T生產(chǎn)需要一定的時(shí)間,一般為10-20天生產(chǎn)時(shí)間�,然后進(jìn)行回輸,回輸時(shí)間為單采后的15-30天���,所以�,有的患者在此段時(shí)間內(nèi)會(huì)發(fā)生死亡或者變得不符合回輸治療的標(biāo)準(zhǔn)�����。
>>案例分析