寡核苷酸(Oligonucleotide)是一類由堿基組成的短鏈核苷酸化合物的總稱���,它是繼小分子藥物和蛋白質(zhì)藥物之后出現(xiàn)的一類新模式藥物,是近年藥物開發(fā)的熱點(diǎn)之一。絕大多數(shù)寡核苷酸藥物(Oligonucleotidedrugs, OND)通過沃森克里克堿基配對(duì)原理���,識(shí)別并結(jié)合到目的核苷酸序列上���,干擾致病基因的轉(zhuǎn)錄翻譯���,從而矯正致病蛋白質(zhì)的表達(dá)量���,最終達(dá)到治療疾病的效果。根據(jù)藥物結(jié)構(gòu)和作用機(jī)理的不同,OND可以大體分為反義寡核苷酸(Antisenseoligonucleotide, ASO),小干擾RNA (smallinterferingRNA, siRNA)���,微小RNA(micro-RNA, miRNA)和核酸適配體(Aptamer)等。
圖 1. 寡核苷酸藥物示意圖
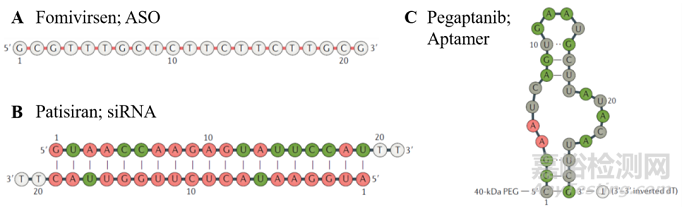
三個(gè)FDA審批上市的OND藥物分別為 (A) Fomivirsen, (B) Patisiran和 (C) Pegaptanib [1].
ASO是一類可識(shí)別RNA的單鏈DNA(圖1A)���,當(dāng)ASO結(jié)合到目的RNA序列之后���,會(huì)導(dǎo)致目的基因被RNAse H降解���,或通過空間位阻來阻斷致病基因的翻譯���。siRNA通常是20-25個(gè)堿基長度的雙鏈RNA(圖1B)���,其中反義鏈RNA會(huì)識(shí)別其序列完全互補(bǔ)的信使RNA (messenger RNA, mRNA)���,進(jìn)而形成RNA沉默復(fù)合物(RNA-inducedsilencingcomplex, RISC),導(dǎo)致mRNA降解���。miRNA是廣泛存在于細(xì)胞內(nèi)的內(nèi)源性單鏈非編碼核苷酸,和siRNA作用機(jī)理相似���,miRNA通過和目的RNA部分互補(bǔ)���,形成RISC復(fù)合物并沉默基因表達(dá)。Aptamer和以上三種OND作用機(jī)理大不相同���,它由單鏈DNA組成���,并折疊產(chǎn)生明確的三維二級(jí)空間結(jié)構(gòu)(圖1C),和目的蛋白結(jié)合后,干擾此蛋白質(zhì)和其他分子間的相互作用。
OND分子量通常介于4~15 kDa之間���,具有強(qiáng)親水性和多負(fù)電性的特性���。當(dāng)OND進(jìn)入人體后���,需要防止核酸酶的水解,躲避血清中蛋白質(zhì)的螯合作用���,穿越毛細(xì)血管到達(dá)靶點(diǎn)細(xì)胞���,橫跨細(xì)胞膜���,抵抗溶酶體的降解���,才能最終到達(dá)細(xì)胞內(nèi)的作用位點(diǎn)���。因此OND所面臨的藥物穩(wěn)定性和藥物遞送的挑戰(zhàn),比小分子藥物和蛋白質(zhì)藥物更加艱巨���。絕大多數(shù)現(xiàn)有的OND分子(包括臨床前���,臨床中和上市的OND)���,都需要對(duì)核苷酸進(jìn)行廣泛的化學(xué)修飾 ,來達(dá)到高穩(wěn)定性和高效遞送性的目標(biāo)。
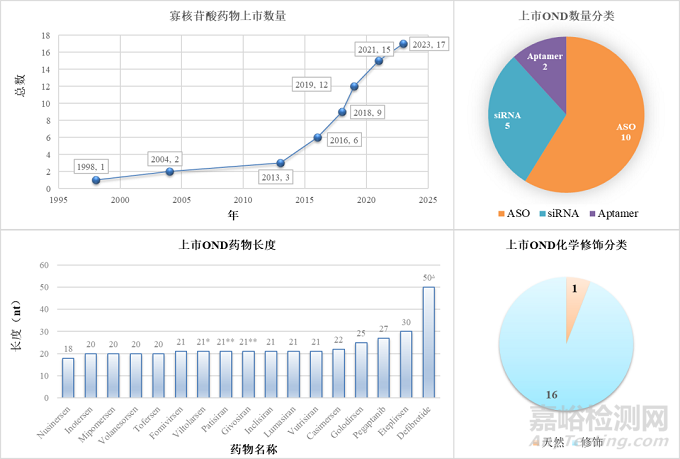
自1998年第一款OND上市以來���,截至2023年7月為止���,共有17款OND通過美國FDA或歐洲EMA審批���,其中14款的上市���,是在過去10年內(nèi)完成的(圖2)���。根據(jù)作用機(jī)理分類���,已上市OND有10款屬于ASO,5款siRNA���,另外兩款為Aptamer���;根據(jù)藥物長度分類,絕大多數(shù)OND的長度均在20-25mer的范圍里���,而最長的一款Defibrotide���,是天然DNA降解后的混合產(chǎn)物,平均核苷酸鏈長度在50 nt 左右���;根據(jù)化學(xué)修飾分類,除了Defibrotide外���,其余16款寡核苷酸藥物���,均包含化學(xué)修飾���。
圖2. 上市OND藥物統(tǒng)計(jì)
(A) 上市OND藥物總數(shù) (B) 上市OND藥物分類 (C) 上市OND藥物分子長度 (D) 上市OND藥物化學(xué)修飾分類數(shù)量. *: 雙鏈siRNA長度為21/21 nt. **: 雙鏈siRNA長度為21/23 nt. ?: 平均長度約為 50 nt [2].
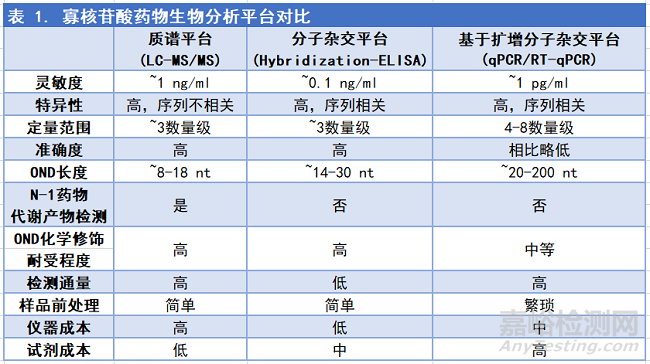
為支持寡核苷酸藥物的研發(fā)和臨床試驗(yàn)���,我們同樣需要對(duì)OND在生物基質(zhì)中進(jìn)行定量分析并研究其相關(guān)藥理特性���。由于上文提到的OND分子特性,例如強(qiáng)親水性���、多負(fù)電性和人工化學(xué)修飾等���,現(xiàn)有的傳統(tǒng)分析技術(shù),已經(jīng)無法完全滿足臨床前和臨床中對(duì)寡核苷酸藥物在人體內(nèi)的安全性���、穩(wěn)定性等監(jiān)測(cè)需求���,而相關(guān)政府藥監(jiān)機(jī)構(gòu),對(duì)工業(yè)界OND的生物分析方法���,也并未制定明確的法規(guī)或是清晰的指導(dǎo)原則���,因此我們要根據(jù)學(xué)術(shù)界已有的科研成果來建立新的技術(shù)平臺(tái)���,并對(duì)已有的分析方法進(jìn)行方法開發(fā)和改進(jìn),同時(shí)摸索建立客戶���、業(yè)界和藥物審批機(jī)構(gòu)均可接受的檢測(cè)標(biāo)準(zhǔn)���,從而應(yīng)對(duì)OND新模式藥物給生物分析帶來的全新挑戰(zhàn)?��,F(xiàn)有的針對(duì)寡核苷酸分子的分析方法大致分為兩類:基于色譜的方法(chromatographic assay)和基于分子雜交的方法(hybridization-based assay) [3]。
基于色譜的方法���,是將分析物經(jīng)過液相層析分離后���,用UV���、熒光或質(zhì)譜儀等方式檢測(cè)藥物分子���,其中LC-MS/MS (Massspectrometry)和LC-HRAM (High-resolutionaccurate-MS)在近年里越來越多的被應(yīng)用于OND的定量分析。LC-MS/MS方法具有超強(qiáng)的特異性���,優(yōu)越的精準(zhǔn)度,寬泛的定量范圍和高度自動(dòng)化的優(yōu)勢(shì)���,LLOQ可以達(dá)到1.0-25 ng/ml(血漿中; [3])���,除此以外���,LC-MS可以檢測(cè)到N-1的藥物代謝產(chǎn)物���,對(duì)核苷酸的化學(xué)修飾也具有良好的耐受性���。但是隨著OND分子長度的增加���,基于色譜的分析方法靈敏度會(huì)隨之下降���,即便是較短的藥物分子(8-13 nt),其LLOQ也無法達(dá)到像ELISA或是qPCR技術(shù)pg/ml級(jí)別 甚至更低的檢測(cè)水平���。
基于分子雜交的方法,是通過探針來識(shí)別���、捕獲和檢測(cè)OND分子,主要技術(shù)平臺(tái)包括雜交-ELISA���,雜交-ECL���,LC-熒光和qPCR等���。分子雜交方法的主要優(yōu)勢(shì)在于較高的靈敏度���,LLOQ通常在0.1 ng/ml以下([4])���;高特異性���、優(yōu)異的精準(zhǔn)度以及不受核苷酸化學(xué)修飾影響���,使雜交的方法成為一個(gè)可靠的生物分析平臺(tái)���。常規(guī)的雜交方法例如雜交-ELISA���,可用于分析14-30個(gè)核苷酸長度的寡核苷酸分子,因此大多數(shù)OND (20-25 nt)是適合用分子雜交的方法來定量分析的���。但此分析方法無法檢測(cè)N-1的藥物代謝產(chǎn)物���,對(duì)每一個(gè)藥物分子也都需要進(jìn)行單獨(dú)的探針設(shè)計(jì)和生產(chǎn)���。
qPCR雖然是一類基于分子雜交的檢測(cè)手段���,但其檢測(cè)原理明顯有別于其它常規(guī)的雜交方法。qPCR通過引物對(duì)目的核苷酸片段的擴(kuò)增���,結(jié)合熒光染料或探針進(jìn)行染色發(fā)光,最后由儀器對(duì)熒光信號(hào)定量檢測(cè)���。即使是極低濃度的核苷酸片段���,通過40個(gè)循環(huán)的PCR擴(kuò)增后���,其濃度可以達(dá)到一個(gè)很高的檢測(cè)水平���,因此qPCR是一個(gè)較為靈敏的檢測(cè)方法,LLOQ可以達(dá)到1 pg/ml(血漿中; [3])至50拷貝(每1 ug 基因組DNA; [5])之間。但qPCR也有其明顯的局限性���,例如無法檢測(cè)藥物N-1代謝產(chǎn)物���。對(duì)于OND生物分析,qPCR技術(shù)面臨兩個(gè)主要挑戰(zhàn)���,一是絕大多數(shù)OND分子長度在20-25 nt之間,不能滿足常規(guī)引物和探針?biāo)璧淖罴验L度���,需要對(duì)引物及探針的設(shè)計(jì)進(jìn)行改進(jìn)���;二是絕大多數(shù)OND分子都存在化學(xué)修飾,即便優(yōu)化引物及探針的設(shè)計(jì)���,也無法完全抵消化學(xué)修飾對(duì)PCR擴(kuò)增效率帶來的影響���。
以上幾類技術(shù)平臺(tái)各有利弊���,對(duì)于OND的生物分析���,我們需要根據(jù)藥物分子的特性來選擇合適的分析方法(表1)���。從檢測(cè)方法的靈敏度和準(zhǔn)確度來看,qPCR擁有較高的靈敏度���,但精準(zhǔn)度則相對(duì)偏低���;而LC-MS則相反,雖然很難在生物基質(zhì)中檢測(cè)到濃度極低的藥物分子���,但可以準(zhǔn)確穩(wěn)定的測(cè)量藥物濃度���。從OND分子長度來看,qPCR適合分析較長的藥物���,而LC-MS的優(yōu)勢(shì)則在于分析小于20 nt 的OND���,并且靈敏度隨著藥物分子長度的縮短而上升。從OND分子的化學(xué)修飾來看���,分子雜交的方法無法檢測(cè)到任何藥物修飾���,其中qPCR的擴(kuò)增循環(huán)更是受化學(xué)修飾影響���;另一方面���,LC-MS/MS不僅可以檢測(cè)到藥物分子的化學(xué)修飾,還可以觀測(cè)到藥物的代謝產(chǎn)物���。
寡核苷酸藥物是繼小分子和蛋白質(zhì)藥物之后的一類新模式藥物,其分子特性和作用機(jī)理在很大程度上可以彌補(bǔ)后兩者的局限性���,但也面臨著穩(wěn)定性和藥物傳遞的挑戰(zhàn)。在已經(jīng)上市的17款OND中���,15款為針對(duì)罕見病藥物(Inclisiran和Pegaptanib除外; [6-7]),足見OND在治療罕見病方面的巨大潛力���;而處于臨床測(cè)試階段的OND,絕大多數(shù)都是針對(duì)癌癥治療的���,也反應(yīng)了OND在常見病方面的廣泛應(yīng)用前景。對(duì)于寡核苷酸藥物的生物分析���,我們面臨著巨大的技術(shù)挑戰(zhàn),原因包括OND相對(duì)復(fù)雜的分子結(jié)構(gòu)���、尚未成熟的技術(shù)平臺(tái)和有待完善的行業(yè)標(biāo)準(zhǔn),需要我們?cè)谝延械膫鹘y(tǒng)藥物分子分析經(jīng)驗(yàn)的基礎(chǔ)上���,不斷學(xué)習(xí)并建立和開發(fā)新的分析方法���,來面對(duì)即將到來的OND藥物涌現(xiàn)的新時(shí)代���。藥明康德測(cè)試事業(yè)部生物分析部���,已建立基于色譜和分子雜交的OND分析平臺(tái),包括LC-MS���、Hybridization-ELISA和qPCR/RT-qPCR等;同時(shí)我們擁有豐富的方法開發(fā)���、方法驗(yàn)證及樣品分析經(jīng)驗(yàn),可以為客戶提供定制化一體化服務(wù)���,覆蓋OND的藥代動(dòng)力學(xué)���、藥效動(dòng)力學(xué)及免疫原性的檢測(cè)需求���。
References:
[1] Thomas Roberts, Robert Langer and Matthew Wood. Advances in oligonucleotide drug delivery. Nature Reviews Drug Discovery (2020), 19: 673-694.
[2] R. Pescador, L. Capuzzi, M. Mantovani, A. Fulgenzi, M.E. Ferrero. Defibrotide: Properties and clinical use of an old/new drug. Vascular Pharmacology (2013). 59: 1-3.
[3] Laixin Wang and Chengjie Ji. Advances in quantitative bioanalysis of oligonucleotide biomarkers and therapeutics. Bioanalysis (2016), 8(2): 143-155.
[4] Daniel Norris, Noah Post, Rosie Yu, Sarah Greenlee and Yanfeng Wang. Bioanalysis considerations on the pharmacokinetic evaluation of antisense therapeutics. Bioanalysis (2019), 11(21): 1909-1912.
[5] FDA Department of Health and Human Services (2020). Long term follow-up after administration of human gene therapy products: guidance for industry. https://www.fda.gov/media/113768/download.
[6] US FDA genetic and rare diseases list.https://rarediseases.info.nih.gov/diseases.
[7] US FDA Orphan drug designations and approval database.https://www.accessdata.fda.gov/scripts/opdlisting/oopd/index.cfm.