隨著AI技術(shù)的不斷發(fā)展���,越來越多的AI產(chǎn)品被應(yīng)用于醫(yī)療領(lǐng)域�,在生物技術(shù)����、醫(yī)學(xué)影像識別、藥物研發(fā)����、輔助診斷等領(lǐng)域發(fā)揮了重要作用���。醫(yī)療AI技術(shù)可在4個(gè)方面有效改善醫(yī)療服務(wù):一是通過減少成本和資源浪費(fèi)以及提高工作效率,來提高生產(chǎn)力���;二是通過提高診斷的準(zhǔn)確性和減少患者就醫(yī)等待時(shí)間等�,來提高服務(wù)質(zhì)量;三是通過AI技術(shù)制定個(gè)性化醫(yī)療方案���,使醫(yī)療方式更加準(zhǔn)確���;四是AI技術(shù)參與新藥的開發(fā),使藥物治療更加有效���。
我國醫(yī)療AI技術(shù)管理現(xiàn)狀
2017年���,國家藥品監(jiān)督管理局成立人工智能工作組,開展了人工智能醫(yī)療器械監(jiān)管研究�,主要包括AI醫(yī)療器械測評數(shù)據(jù)庫建立、算法評估����、數(shù)據(jù)安全等,并重視產(chǎn)學(xué)研醫(yī)檢相結(jié)合和跨學(xué)科合作����。2019年���,國家藥品監(jiān)督管理局聯(lián)合國家相關(guān)部委����、科研機(jī)構(gòu)、醫(yī)療機(jī)構(gòu)等���,共同成立人工智能醫(yī)療器械創(chuàng)新合作平臺(tái)���,設(shè)立了技術(shù)法規(guī)�、數(shù)據(jù)治理、網(wǎng)絡(luò)安全等10個(gè)工作組���,通過合作平臺(tái)推動(dòng)各工作組開展多層面���、多角度科學(xué)研究���。2020年,國家標(biāo)準(zhǔn)化管理委員會(huì)�、中央網(wǎng)信辦�、國家發(fā)展改革委�、科技部�、工信部聯(lián)合發(fā)布《國家新一代人工智能標(biāo)準(zhǔn)體系建設(shè)指南》(國標(biāo)委聯(lián)【2020】35號)����,計(jì)劃在醫(yī)療等領(lǐng)域初步建立智能AI標(biāo)準(zhǔn)體系���,圍繞醫(yī)療數(shù)據(jù)���、醫(yī)療診斷�、醫(yī)療服務(wù)�、醫(yī)療監(jiān)管等���,重點(diǎn)規(guī)范醫(yī)療AI技術(shù)在數(shù)據(jù)獲取�、數(shù)據(jù)隱身管理等方面的應(yīng)用���,制定了包括醫(yī)療數(shù)據(jù)特征表示、AI醫(yī)療質(zhì)量評估等標(biāo)準(zhǔn)����。2021年���,國家醫(yī)保局、國家衛(wèi)生健康委����、國家發(fā)展改革委等八部委聯(lián)合發(fā)布《深化醫(yī)療服務(wù)價(jià)格改革試點(diǎn)方案》(醫(yī)保發(fā)【2021】41號),提出要優(yōu)化新增價(jià)格項(xiàng)目管理���,簡化新增價(jià)格項(xiàng)目申報(bào)流程���,重點(diǎn)關(guān)注新增價(jià)格項(xiàng)目的創(chuàng)新性及經(jīng)濟(jì)性�,加快受理審核進(jìn)度����,促進(jìn)醫(yī)療技術(shù)創(chuàng)新發(fā)展和臨床應(yīng)用。
國外醫(yī)療AI技術(shù)管理概況
英國醫(yī)療AI技術(shù)管理概況
在英國�,直接用于醫(yī)療目的的人工智能系統(tǒng)被納入醫(yī)療器械�、體外診斷設(shè)備或可移動(dòng)植入設(shè)備的管理范疇����,一般不對含有AI技術(shù)的醫(yī)療設(shè)備進(jìn)行單獨(dú)管理。2022年6月���,英國藥品和健康產(chǎn)品管理局針對英國脫歐后醫(yī)療器械和體外診斷醫(yī)療器械未來監(jiān)管法規(guī)的立法協(xié)商發(fā)布政府回復(fù),不建議單獨(dú)為作為醫(yī)療設(shè)備的AI技術(shù)(Artificial Intelligence as a Medical Device�,AIaMD)進(jìn)行定義����,也不會(huì)為AIaMD設(shè)定額外的法規(guī)要求,只將之視為一般的醫(yī)療設(shè)備軟件進(jìn)行管理����。
美國醫(yī)療AI技術(shù)管理概況
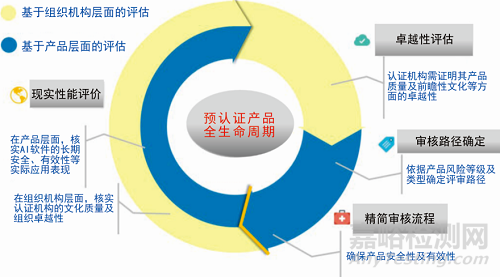
隨著越來越多的智能軟件被開發(fā)成健康產(chǎn)品�,美國食品藥品監(jiān)督管理局認(rèn)為傳統(tǒng)的評審方法已經(jīng)不適用監(jiān)管醫(yī)療軟件。FDA于2017年7月啟動(dòng)醫(yī)療器械獨(dú)立軟件預(yù)認(rèn)證試點(diǎn)項(xiàng)目,并分別于2018年4月�、2018年6月����、2019年1月發(fā)布3個(gè)更新版本�,旨在通過考查此類產(chǎn)品的特征����、臨床前景、獨(dú)特的用戶界面以及行業(yè)內(nèi)引進(jìn)此類產(chǎn)品的商業(yè)周期等,建立專門針對電子健康產(chǎn)品的監(jiān)管方法���。
歐盟醫(yī)療AI技術(shù)管理概況
歐盟白皮書提出將AI技術(shù)分為高風(fēng)險(xiǎn)和非高風(fēng)險(xiǎn)兩類進(jìn)行監(jiān)管�。對于高風(fēng)險(xiǎn)的人工智能,需要先進(jìn)行客觀的合格性評估�,以驗(yàn)證并確保AI技術(shù)能夠達(dá)到高風(fēng)險(xiǎn)應(yīng)用程序的特定要求。2019年4月����,歐盟委員會(huì)發(fā)布《可信賴人工智能道德準(zhǔn)則》的正式生效文本,提出AI系統(tǒng)要達(dá)到可信賴要求必須滿足以下關(guān)鍵要素���,分別是人的能動(dòng)性和監(jiān)督���,技術(shù)的穩(wěn)健性和安全性�,隱私和數(shù)據(jù)管理,透明性�,多樣性�、非歧視性和公平性����,社會(huì)和環(huán)境福祉���,問責(zé)�。
日本醫(yī)療AI技術(shù)管理概況
日本藥品和醫(yī)療器械局下設(shè)的人工智能及其在醫(yī)療領(lǐng)域的應(yīng)用小組委員會(huì)于2016年成立�,針對AI輔助醫(yī)療影像診斷和AI手術(shù)機(jī)器人提出了具體規(guī)范建議。首先���,針對醫(yī)療AI技術(shù)的可塑性����,PMDA提出了相關(guān)要求以確保新的更改不會(huì)損害設(shè)備的安全性和有效性�;其次,針對深度學(xué)習(xí)算法帶來的黑匣子問題����,需要確保數(shù)據(jù)集的有效性與可靠性,詳細(xì)描述網(wǎng)絡(luò)結(jié)構(gòu)���、算法設(shè)計(jì)和功能�,并通過一系列的輸入來評估其輸出性能,同時(shí)也應(yīng)提前制定應(yīng)對意外行為的相關(guān)規(guī)定���;最后����,是數(shù)據(jù)質(zhì)量問題�,包括上市前及上市后測試所需要的數(shù)據(jù)集�。
啟示與思考
保證有效性與安全性是醫(yī)療AI技術(shù)的前提
各國對于醫(yī)療AI技術(shù)的共同點(diǎn)或基本要求就是兩個(gè)關(guān)鍵詞:安全、有效���。安全包括技術(shù)安全���、數(shù)據(jù)安全與網(wǎng)絡(luò)安全等,以保證患者的人體健康安全���、隱私信息安全���,將風(fēng)險(xiǎn)控制在可接受的水平;有效是指要達(dá)到預(yù)期的目的���,即防病���、治病的效果等。雖然AI技術(shù)醫(yī)療設(shè)備具有一定特殊性�,但安全性與有效性依然是開展一切醫(yī)療AI技術(shù)監(jiān)管與評估工作的前提。
建立基于風(fēng)險(xiǎn)等級的分類管理機(jī)制
建立基于風(fēng)險(xiǎn)等級的分類管理與評估機(jī)制是開展醫(yī)療AI技術(shù)監(jiān)管與評估工作的重要手段�。我國可依據(jù)醫(yī)療AI設(shè)備產(chǎn)品功能���、使用形式�、作用人群�、技術(shù)透明度����、數(shù)據(jù)安全性、算法特異性等�,制訂符合我國自身特點(diǎn)的醫(yī)療AI設(shè)備風(fēng)險(xiǎn)分類標(biāo)準(zhǔn),并為不同AI設(shè)備分類設(shè)置特定的監(jiān)管與評估機(jī)制���。
注重上市后的持續(xù)監(jiān)管與風(fēng)險(xiǎn)控制
上市后監(jiān)測是非常重要且必不可少的環(huán)節(jié)。我國可以綜合參考各國醫(yī)療AI設(shè)備上市后評估側(cè)重點(diǎn)���,對設(shè)備上市后在真實(shí)世界的有效性�、不良事件監(jiān)測���、網(wǎng)絡(luò)安全性�、數(shù)據(jù)安全性����、技術(shù)的可持續(xù)發(fā)展性等進(jìn)行全方位的監(jiān)控管理。
加強(qiáng)全生命周期的持續(xù)監(jiān)管
考慮到醫(yī)療AI技術(shù)的特殊性�,可采用深度學(xué)習(xí)等方法不斷更新算法����,從而達(dá)到更佳的使用效果�。在算法的更新過程中,對醫(yī)療AI設(shè)備的初始評估結(jié)論可能不再適用���,因此對醫(yī)療AI技術(shù)的評估應(yīng)貫穿于產(chǎn)品的全生命周期���。