近期���,河北醫(yī)科大學第三醫(yī)院陳偉教授和河北工業(yè)大學楊磊教授在科愛出版社創(chuàng)辦的期刊Bioactive Materials上聯(lián)合發(fā)表綜述文章:納米材料加速骨折愈合的研究進展���。從納米材料的固有特性、納米材料用于骨缺損填充以及納米遞送系統(tǒng)在治療骨折愈合中的應用三方面入手���,詳細總結了納米材料在加速骨折愈合中的最新研究進展��,并指出了納米材料加速骨折愈合的挑戰(zhàn)和未來發(fā)展方向�����。
研究內(nèi)容簡介
骨折病例逐年增多,骨折后出現(xiàn)不愈合或延遲修復的患者數(shù)量也逐年增加��。盡管目前的臨床材料(如金屬和復合材料)有助于骨折愈合��,但由于其降解速度緩慢,成骨活性有限��,骨整合能力不足���,力學性能欠佳等原因無法滿足需求���。自2000年以來,納米材料成功模仿了骨骼的納米尺度特征并提供了獨特的性能��,因此備受關注�����。本文綜述了納米材料在治療骨折方面所取得的成就�����,如納米材料的固有特性��、用于填充骨缺損的納米材料以及治療骨折延遲愈合的納米遞送系統(tǒng)��。此外��,文中還探討了納米材料加速骨折愈合所面臨的挑戰(zhàn)和未來的發(fā)展方向���。
一�����、納米材料的固有特性
作為組織工程學的重要組成部分���,納米技術近年來迅速發(fā)展��,所創(chuàng)造出的納米材料已廣泛應用于生物醫(yī)學領域��,例如藥物遞送��、組織再生�����、傷口愈合���、基因遞送及成像技術等。近年來�����,越來越多研究表明納米材料的固有特性同樣重要��。在加速骨折愈合治療中��,納米材料的固有特性主要體現(xiàn)在抗氧化��、抗菌��、促進成骨細胞分化和抑制破骨細胞分化等方面���。
1.1 納米材料的抗氧化作用
在炎癥反應期間�����,炎癥細胞(包括中性粒細胞�����、白細胞和巨噬細胞)會聚集到受炎區(qū)域并釋放促炎因子�����,如腫瘤壞死因子α(TNF-α)��、干擾素-γ(IFN-γ)以及白細胞介素6(IL-6)��。這些因子導致線粒體電子傳遞鏈(ETC)的代謝出現(xiàn)紊亂���,因為它們會誘導活性氧(ROS)的泄漏�����。因此�����,可以使用抗氧化物質(zhì)來抵消炎癥反應產(chǎn)生的過量ROS��,從而有效地抑制炎癥��。
典型的納米金屬化合物���,如氧化鈰(CeO2)和二氧化錳(MnO2),具有顯著的抗氧化作用�����。這些化合物在促進骨折愈合和抑制炎癥反應方面特別有效���。例如���,Wu等人通過在介孔二氧化硅中負載CeO2��,得到介孔二氧化硅納米顆粒(MSNs)-CeO2復合材料��,表現(xiàn)出優(yōu)異的比表面和高吸附率。該材料在嚴重氧化應激模型創(chuàng)面中可以有效消除局部過量的ROS��,緩解氧化損傷��,縮短創(chuàng)面修復周期(圖1)�����。
圖1:使用MSN-CeO2作為ROS清除組織粘合劑快速修復皮膚傷口和組織再生的示意圖���。
1.2 納米材料的抗菌作用
創(chuàng)傷感染問題是臨床骨缺損修復面臨的挑戰(zhàn)��。一旦出現(xiàn)局部狀況�����,細菌就會侵入并占據(jù)有缺陷的組織表面和植入材料��。它們繁殖消耗營養(yǎng)物質(zhì)和氧氣�����,并釋放酸性代謝物�����,這對周圍的健康細胞或難以附著到缺陷部位和植入材料的遷移細胞產(chǎn)生不利影響��。
周圍免疫細胞因細菌增殖而分泌重要的促炎因子��,加劇炎癥反應和ROS積累���。此外��,骨組織中活化的破骨細胞引起破骨細胞分化和骨吸收�����,從而導致骨修復失敗��。因此��,一些納米材料憑借其抗菌特性���,因此,一些納米材料憑借其抗菌特性成為研究人員關注的焦點。
1.3 納米材料促進成骨分化
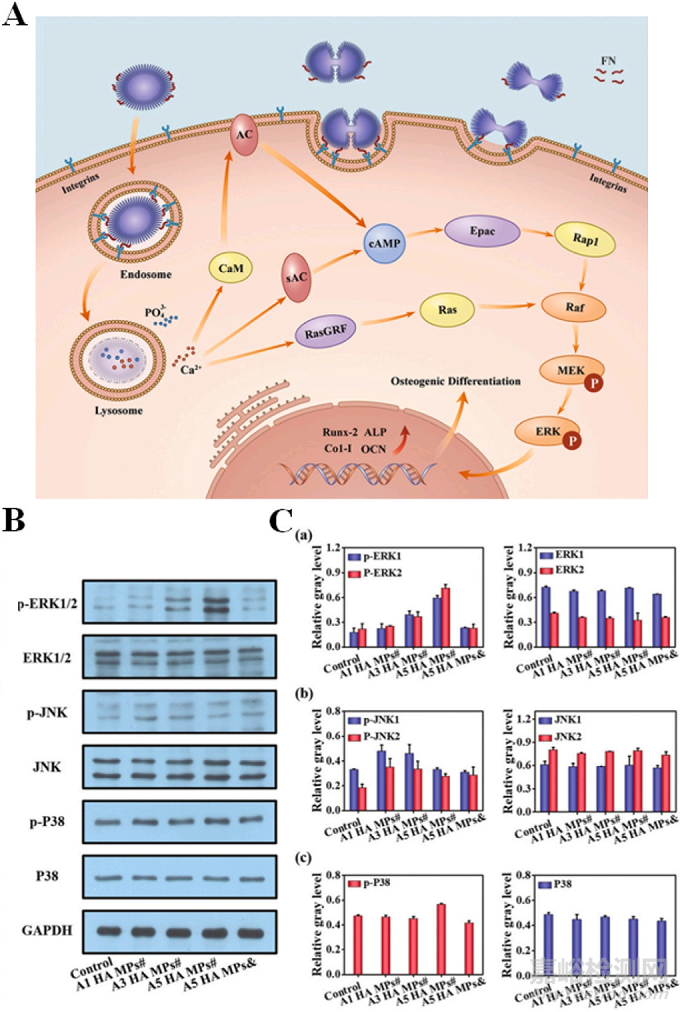
納米材料已廣泛應用于骨再生治療�����。生物活性分子和納米材料的復合可加速新骨的形成��。但是��,研究人員更加關注納米材料自身是否可以促進成骨分化��。在無機非金屬納米粒子的研究中��,Xu等人研究了針狀�����、棒狀和層狀納米羥基磷灰石(nHAp)顆粒對成骨分化的影響(圖2A)�����。結果表明�����,片狀nHAp顆粒獨特的分層結構可以顯著提高細胞內(nèi)吞效率���,調(diào)節(jié)肌動蛋白細胞骨架���,激活絲裂原激活蛋白激酶(MAPK)信號通路(圖2B和C),上調(diào)間充質(zhì)干細胞的成骨分化���。
圖2:(A)不同層次結構的HAp MPs影響干細胞成骨分化調(diào)控的可能機制示意圖���,(B)在三種HAp MPs培養(yǎng)的mBMSCs中,ERK���、JNK和p38信號通路中必需蛋白的表達�����,(C)灰度值水平相對于GAPDH的倍數(shù)變化�����,n = 2�����。
1.4 納米材料抑制破骨細胞分化
破骨細胞又叫做骨吸收細胞���,源自單核-巨噬細胞系統(tǒng)���,在骨的生長、發(fā)育和修復中發(fā)揮著重要的作用���。骨的形態(tài)和吸收是動態(tài)平衡��,受到多種因素的調(diào)節(jié)�����,一旦這種平衡失衡,就會引發(fā)多種疾病��。目前��,抑制骨吸收的新型納米材料的開發(fā)受到廣泛關注�����。
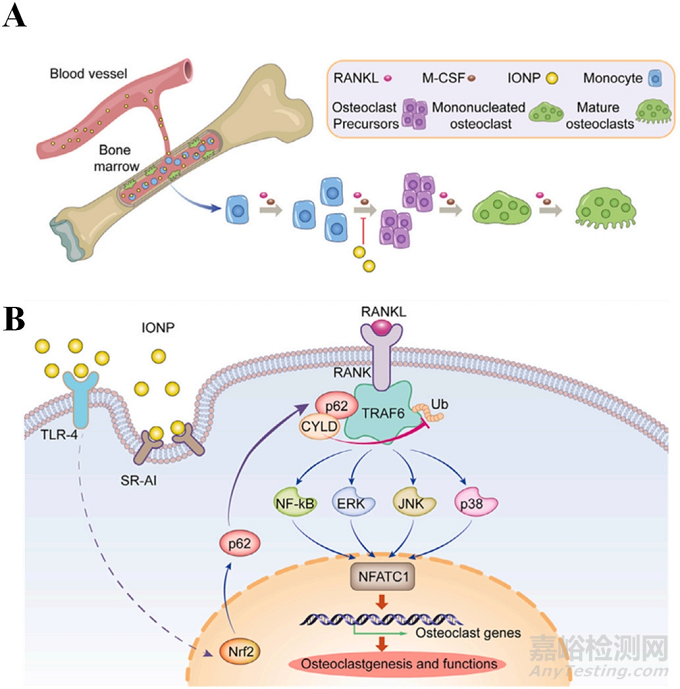
例如��,Ai等人研究表明��,氧化鐵納米顆粒(IONPs)可被骨髓瘤內(nèi)化,同時抑制核轉錄因子NF-κB受體激動劑配體(RANKL)誘導的骨髓瘤在細胞分化早期和成熟后期向大型多核破骨細胞的分化���。相反�����,它們不影響細胞增殖和融合(圖3A)��。IONPs通過激活骨髓來源的巨噬細胞(BMMs)中Toll樣受體-4(TLR-4)-Nrf-2信號上調(diào)p62���,促進去泛素化酶CYLD向腫瘤壞死因子受體相關因子6(TRAF6)募集,促進TRAF6-p62-CYLD復合物結合���,導致TRAF6去泛素化��。從而導致RANKL和核因子-κB受體激活因子(RANK)聯(lián)合誘導的NF-κB和MAPK的一系列信號通路(JNK���、ERK、p38)被阻斷���。最后��,下游破骨細胞相關基因(NFATC1)轉錄可被顯著抑制��,導致骨吸收不足��。圖3B顯示了IONPs抑制RANKL誘導的破骨細胞形成的分子機制�����。
圖3:IONPs對RANKL誘導的破骨細胞生成的抑制作用�����。(A)系統(tǒng)給藥后���,通過BMMs的吞噬作用��,IONPs滯留在骨髓中��,IONPs可以抑制RANK誘導的早期分化和晚期成熟階段的破骨細胞發(fā)生,(B)RANKL誘導破骨細胞發(fā)生抑制作用的分子機制�����。
二���、用于骨缺損填充的納米材料
健康人骨骼的連續(xù)性和完整性都非常高���。然而�����,由于創(chuàng)傷或其他原因造成的骨骼缺陷��,骨骼部分被破壞或缺失等�����,在機體自我修復中�����,新生骨的充足體積是恢復外觀和功能所需的必要條件�����。目前���,臨床往往采用植入骨移植物填補骨缺損,通常使用自體骨或同種異體骨�����。但這些治療方案耗時長,療效不佳��。為了解決這些問題�����,研究人員注重于開發(fā)具有抗菌和骨誘導性能的新型納米生物材料�����,將其作為骨缺損填充材料應用于骨折愈合的治療�����。
2.1 羥基磷灰石(HAp)納米粒子
通過模擬天然骨的組成和結構特征制備的骨替代材料可以為細胞提供與天然骨相似的微環(huán)境���,可作為骨缺損的直接修復材料和組織工程的優(yōu)良載體材料��。HAp(Ca10(PO4)6(OH)2)是人類骨骼的主要無機成分���,具有良好的生物相容性和生物活性���。在體內(nèi)植入HAp后��,由于其吸收緩慢��,可以保持與再生骨的整合�����。因此���,HAp通常用作聚合物的填料���,以改善其機械性能,并涂覆金屬植入物以提供更好的生物活性��。
2.2 碳基納米材料
同素異形體石墨烯是一種由sp2雜化碳原子構成的單層六邊形晶格的碳晶體形式��,它是石墨��、木炭�����、碳納米管和富勒烯等碳同素異形體的基本構成成分���。一些研究探討了將碳基納米材料應用于體內(nèi)骨組織工程中的可能性�����。碳納米材料支架具有易得�����、生物和機械相容性好等優(yōu)點���,這些支架對成骨分化�����、細胞增殖和骨組織再生產(chǎn)生顯著的影響�����。作為骨干細胞發(fā)育��、擴張���、更新、粘附和分化的模板�����,支架在形成骨組織過程中起著至關重要的作用��。納米碳纖維能夠加速成骨細胞的增殖��,促進堿性磷酸酶的合成���,相較于大直徑碳纖維��,它還可積累更多的細胞外基質(zhì)鈣�����,該材料在應用于骨組織時還表現(xiàn)出更好的力學性能�����。
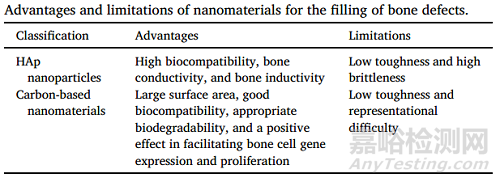
作者全面歸納了羥基磷灰石納米粒子和碳基納米材料在骨缺損修復中的優(yōu)點和局限性(表1)��。
表1 總結了納米材料在骨缺損修復中的優(yōu)勢與局限性��。
三���、納米藥物遞送系統(tǒng)
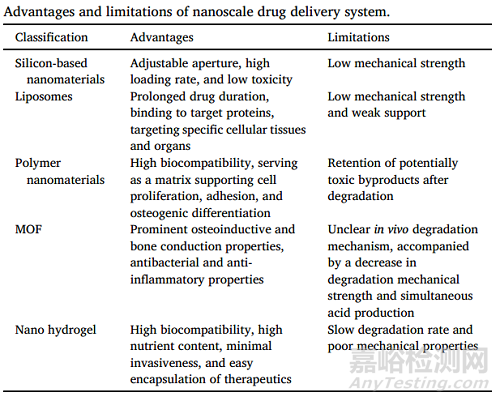
納米級藥物載體的尺寸范圍為10-1000nm,能夠與藥物分子形成藥物緩釋體系,通過化學鍵和物理吸附等方式進行��。納米載體的應用可以改善藥物的緩釋���、靶向性��、穩(wěn)定性���、作用時間和給藥途徑,從而減少全身或局部給藥的副作用���。此外�����,納米載體能夠穿透傳統(tǒng)藥物作用的機體屏障��,如血腦屏障��、血眼屏障和細胞生物膜屏障�����,以提高療效��。作者對幾種納米級藥物遞送系統(tǒng)和納米藥物載體(如硅基�����、聚合物���、水凝膠基納米藥物載體、納米脂質(zhì)體和金屬有機框架(MOF))在促進骨折愈合方面的研究工作進行了歸納總結���。
3.1 硅基納米藥物載體
硅納米顆粒(MSNs)的孔徑為2-50納米���,粒徑為數(shù)百納米至數(shù)十微米,表面積高達1000平方米每克���。每平方米約有5×1018個硅烷醇基團�����,可被功能化以用于多種用途���,因此它們廣泛應用于骨組織工程中開發(fā)控釋系統(tǒng)。此外�����,Si離子是啟動骨基質(zhì)礦化的關鍵因素,它可以從MSNs中持續(xù)釋放�����,積極促進骨生成和血管生成��。
3.2 納米脂質(zhì)體藥物載體
脂質(zhì)體是一種囊泡結構�����,最早由Stanham等人在1965年通過電子顯微鏡觀察分散在水中的磷脂發(fā)現(xiàn)���。它是由脂類�����,如卵磷脂��、鞘磷脂和磷脂酰膽堿組成的中空結構���,具有細胞樣的外觀,外層是親水的頭部和內(nèi)層是親脂的尾部��。藥物在脂質(zhì)體中負載后,其在組織中的擴散速度和在血液中的釋放速度減慢��,從而可以延長藥物的作用時間��。
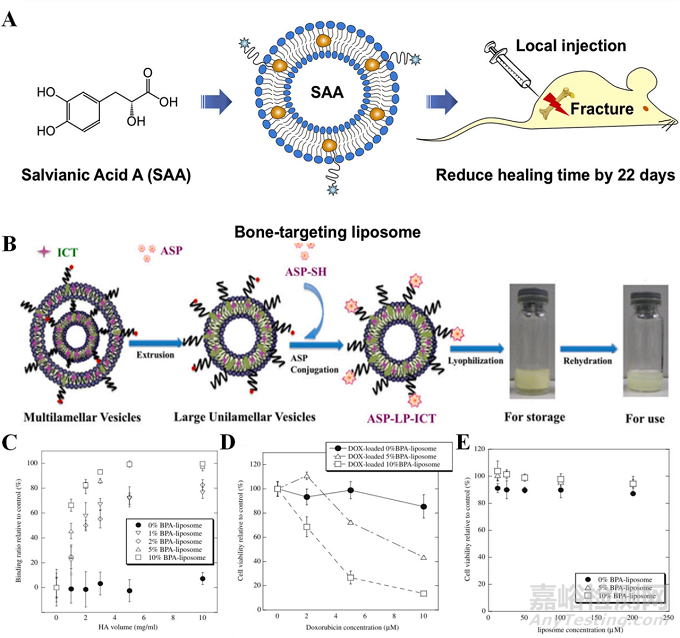
例如��,Liu等人采用焦磷酸膽固醇作為靶向配體��,將丹酚酸A負載到脂質(zhì)體中��,形成直徑約160 nm的體系���。該系統(tǒng)顯著縮短了骨折愈合時間,減少了22天��,加速了治療過程(圖4A)��。Chen等人則基于負載天冬氨酸和淫羊藿苷的脂質(zhì)體�����,建立了一種可靶向骨組織���、有效防止骨吸收和骨壞死的遞送系統(tǒng)(圖4B)��。Anada等人則開發(fā)了一種新的磷酸鈣結合脂質(zhì)體�����,該脂質(zhì)體具有優(yōu)異的HAp親和力(圖4C)�����。在阿霉素加藥后���,該脂質(zhì)體顯著減少了人骨肉瘤MG63細胞的數(shù)量(圖4D和E)���。由此可見,脂質(zhì)體可作為有效的藥物載體���,并實現(xiàn)對骨組織的靶向修復���,進一步為治療其他骨相關疾病(如骨質(zhì)疏松癥和類風濕性骨關節(jié)炎)提供了新的思路���。
圖4:(A)骨靶向丹酚酸A脂質(zhì)體用于延遲骨折愈合��,(B)負載天冬氨酸和淫羊藿苷的脂質(zhì)體作用示意圖�����,(C)磷酸鈣脂質(zhì)體對HAp的親和力�����,(D)負載阿霉素脂質(zhì)體(含和不含BPA)的細胞毒性與初始藥物濃度的函數(shù)關系���,(E)不含阿霉素的脂質(zhì)體的細胞毒性與脂質(zhì)體濃度的關系比較���。結果為平均值±SD (n = 3)。
3.3 高分子納米藥物載體
高分子納米載體分為天然高分子材料和人工合成高分子材料���。高分子材料以其多功能性、來源豐富�����、分子量分布差異大等特點�����,被廣泛應用于眾多工業(yè)領域���。此外�����,一些高分子材料因其優(yōu)異的可降解性和生物相容性而成為納米藥物載體���。
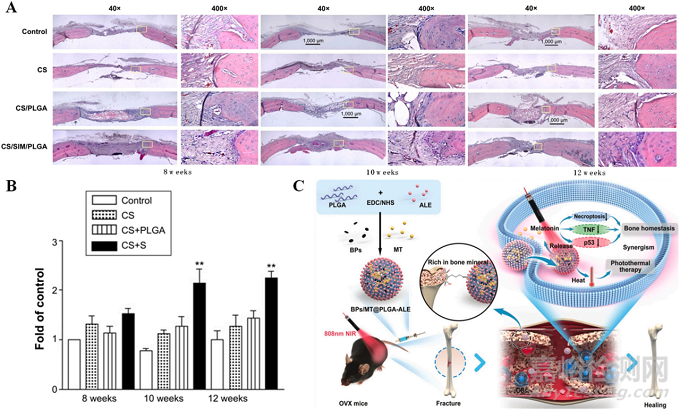
聚乳酸-羥基乙酸共聚物(PLGA)���、聚乳酸(PLA)和聚己內(nèi)酯(PCL)等聚酯在藥物裝載和遞送方面受到廣泛關注。PLGA可攜帶蛋白質(zhì)���、多肽��、疫苗基因��、生長因子��、抗原和其他大分子藥物��。PLGA微球進入人體后���,緩慢降解,逐漸釋放藥物���,實現(xiàn)長期緩釋���。Fu等人在大鼠臨界尺寸顱骨缺損的研究中發(fā)現(xiàn)���,具有藥物載荷能力的快速可吸收殼聚糖(CS)骨置換聯(lián)合成骨誘導SIM/PLGA可顯著提高成骨和血管生成活性,同時促進骨折愈合���,成為臨床使用的骨替代品���。上述特殊的骨替代物組合可能會改善CS骨替代物植入早期骨痂形成的生物力學支持(見圖5A和B),因此可用于修復重大骨缺損���。2023年���,Geng等研究人員將黑磷納米片(BPs)和褪黑激素與阿侖膦酸偶聯(lián)PLGA納米球結合���,開發(fā)出多功能納米平臺治療骨質(zhì)疏松性骨折��。當暴露在近紅外輻射下時���,BPs在光熱治療中發(fā)揮特殊作用��,它們與PLGA結合可以增加穩(wěn)定性��,通過輕度熱療促進成骨��,副作用少��。褪黑素能夠通過抑制破骨細胞生成和促進成骨來控制骨代謝(見圖5C)���。
圖5:(A)移植骨替代物后8、10和12周的顱骨缺損組織學標本�����,蘇木精-伊紅染色�����,(B)移植骨替代物后8�����、10和12周新骨基質(zhì)形成的組織學定量研究��。**與對照組比較p<0.0001,治療組間p<0.0001�����,(C)近紅外照射治療骨質(zhì)疏松性骨折的多功能納米平臺示意圖��。
3.4 金屬有機骨架(MOFs)作為藥物載體
MOFs是指有機和無機成分相結合的雜化材料�����。在上世紀90年代被首次開發(fā)后備受推崇�����,因為它具有高孔隙率���、比表面積和結構可調(diào)性��?����;贛OFs的復合骨材料表現(xiàn)出獨特的性能���,這吸引了許多研究人員的關注。通過將金屬離子固定在MOFs的結構中��,可以控制功能離子的釋放��,這種修飾可以實現(xiàn)抗菌和抗感染的作用���,幫助傷口愈合�����,增強ALP活性并在成骨過程中扮演重要角色��。與其它材料相比���,納米結構的MOFs具有靶向輸送的特性,可減少骨質(zhì)流失并促進骨再生��。
3.5 納米水凝膠藥物載體
水凝膠是一種具有親水性聚合物鏈的三維網(wǎng)絡結構�����,含水量為90%-99%���,有利于氧氣和物質(zhì)的高效交換���。水凝膠以其高生物相容性���、低免疫原性和可調(diào)節(jié)的理化性質(zhì)在生物醫(yī)學領域取得了前所未有的進展。水凝膠聚合物體系為細胞移植和分化���、內(nèi)源性再生���、生物修復、傷口愈合和持續(xù)給藥提供了合適的底物��。相反�����,其三維網(wǎng)絡系統(tǒng)可以模擬原始細胞外基質(zhì)的微觀結構�����,為細胞存活提供活的生態(tài)條件�����。然而�����,一般情況下��,該材料無法對內(nèi)源性環(huán)境刺激或自然信號做出響應�����,嚴重限制了遞送系統(tǒng)的發(fā)展�����,使得體內(nèi)藥物的受控釋放無法實現(xiàn)�����。因此�����,我們可以引入具有獨特物理化學性質(zhì)的納米材料與水凝膠形成雜化材料��,從而為水凝膠體系賦予響應外源性或內(nèi)源性刺激的功能���,更有效地實現(xiàn)藥物控釋行為���。此外��,納米材料還能夠更好地成像或監(jiān)測藥物釋放行為��,實現(xiàn)更精確的靶向治療��。
通過控制載藥方式和釋放動力建立局部緩釋藥物的體系�����,優(yōu)化納米材料的性能���,使其在抗菌和誘導骨生成方面達到最優(yōu)效果,同時盡量減少其對細胞的毒性和在生物體內(nèi)的降解速度�����。這一領域研究可以為骨折治療的臨床應用提供更多的可能性�����。作者在表2中列出了不同納米級給藥系統(tǒng)的優(yōu)缺點���。
表2 總結了納米載藥系統(tǒng)的優(yōu)勢與局限性���。
最后作者指出常用的內(nèi)固定設計不能充分地模擬人體骨關節(jié)的生物學特性和機械支撐傳導特性�����。它無法有效地恢復骨骼的標準結構和功能,也無法分析人體骨骼和關節(jié)的結構及生物力學功能��,因此面臨著開發(fā)可吸收的納米復合人造骨材料等一系列挑戰(zhàn)��。未來的科研人員應更深入地了解納米材料的特性��,精準配方多孔無機納米材料以增強其與天然骨的相似性���,以及識別可以有效用作藥物載體的材料���,以期為骨折愈合的治療和臨床應用帶來突破性進展。
原文信息
Mo Zhang, Fan Xu, JingchengCao, Qingqing Dou, Juan Wang, Jing Wang, Lei Yang**, Wei Chen*.
Research advances of nanomaterials for the acceleration of fracture healing.
BioactiveMaterials, 31(2024) 368-394.