2023.09.08���,F(xiàn)DA更新生物相容性指南,即��,Use of International Standard ISO 10993-1, "Biological evaluation of medical devices - Part 1: Evaluation and testing within a risk management process���,取代2020年的最終指南�����。
【更新背景】
本指南此次修訂,增加了2020年指南草案“Select Updates for Biocompatibility of Certain Devices in Contact with Intact Skin”中描述的建議。 最終指南反映了FDA目前對某些與完整皮膚接觸的醫(yī)療器械上市前提交中應提供的生物相容性信息類型的看法(見指南附錄G)。
【更新內(nèi)容概述】
更新內(nèi)容主要是增加了附錄G Biocompatibility of Certain Devices in Contact with Intact Skin�����,描述了以下內(nèi)容:
• 使用與完整皮膚接觸的普通材料制成的某些醫(yī)療器械的建議���。附錄G列出的材料范圍包括:
1)聚合物��,如塑料或硅膠���,和
2)織物���,如棉或人造絲��。
• 申請人可以用來決定何時適用附錄G中的策略的方法。
• FDA建議在上市前提交的材料中包括什么樣的信息和標簽?
• 生產(chǎn)商如何使用質(zhì)量管理體系和上市后策略�����,包括采購和生產(chǎn)過程控制以及客戶投訴審核��,來識別生物相容性問題。
【哪些類型的器械可以豁免生物相容性測試?】
滿足以下所有要求的器械可豁免生物相容性測試:
1)僅接觸完整皮膚表面的醫(yī)療器械或組件���;
2)接觸持續(xù)時間:有限(≤24小時)�����、延長(> 24小時至30天)和長期(> 30天),包括重復使用設備�����,以及
3)由下節(jié)概述的材料組成���。
【以上器械哪些材料可以豁免生物相容性測試���?】
FDA已經(jīng)確定了只接觸完整的皮膚表面的最終成品器械中包含的特定材料可以豁免生物相容性測試�����。
這些材料可以包括其他加工化學品和添加劑(例如��,增塑劑���、填料�����、顏色添加劑��、
清潔劑���、脫模劑)���。除了色素添加劑,這些化學物質(zhì)不需要在接觸皮膚的器械的上市前遞交文檔中披露接觸信息��。
由以下材料制成�����,并且可以由單一材料制成或者多種材料�����,例如聚合物混合物制成的以上器械可以豁免生物相容性測試:
合成聚合物:
• 丙烯腈丁二烯苯乙烯塑料(ABS);
Acrylonitrile-butadiene-styrene plastic (ABS);
• 醋酸纖維素 Cellulose Acetate�����;
• 固化環(huán)氧膠粘劑(用于連接醫(yī)療器械組件) Cured epoxy adhesives (used to attach medical device components to each other);
• 含氟聚合物���,包括聚四氟乙烯(PTFE)�����、膨脹聚四氟乙烯(ePTFE)���、聚偏氟乙烯(PVDF)和全氟(乙烯-丙烯)塑料(FEP)
Fluoropolymers including polytetrafluoroethylene (PTFE), expanded polytetrafluoroethylene (ePTFE), poly(vinylidene fluoride) (PVDF), and perfluoro(ethylene-propylene) plastic (FEP);
• 丁腈橡膠 Nitrile Butadiene Rubber (NBR);
• 聚對二甲苯 Parylene;
• 聚酰胺(PA),如尼龍和魔術貼Polyamides (PA), such as nylon and Velcro®;
• 聚對苯二甲酸丁二醇酯 Poly(butylene terephthalate) (PBT);
• 聚碳酸酯 Polycarbonate (PC);
• 氯丁��,如氯丁橡膠
Polychloroprene, such as neoprene;
• 聚醚醚酮
Polyetheretherketone (PEEK)
• 聚醚酮酮
Polyetherketoneketone (PEKK);
• 聚醚嵌段酰胺
Polyether block amide (PEBA), such as PEBAX®;
• 聚醚酰亞胺 Polyether imide (PEI);
• 聚乙烯��,包括低密度聚乙烯(LDPE)和高密度聚乙烯(HDPE)
Polyethylenes, including low-density polyethylene (LDPE) and high-density polyethylene (HDPE);
• 聚對苯二甲酸乙酯(PET)��,如尼龍搭扣Poly(ethylene terephthalate) (PET), such as Velcro®;
• 聚甲基丙烯酸甲酯
Poly(methyl methacrylate) (PMMA);
• 聚甲醛
Polyoxymethylene (POM);
• 聚苯砜
Poly(phenylene sulfone) (PPSU);
• 聚丙烯
Polypropylene (PP);
• 聚苯乙烯(PS)��,包括高沖擊聚苯乙烯(HIPS) Polystyrene (PS), including high impact polystyrene (HIPS);
• 聚氨酯(PUR)�����,如萊卡
Polyurethanes (PUR), such as Lycra®;
• 聚乙烯醇
Polyvinyl alcohol (PVA); or
• 硅橡膠
Silicone
天然纖維:
• 棉織物
Cotton fabrics;
• 人造絲織物���,或
Rayon fabrics; or
• 絲織物
Silk fabrics
【510(k)遞交文檔中應新增哪些信息以支持豁免測試���?】
FDA建議在上市前提交中包含符合以上要求的以上器械的以下信息:
• 用于制造器械的所有材料(包括著色劑)或僅直接或間接接觸皮膚的組件的材料的清單;
• 一份聲明���,確認器械材料屬于上述材料(即�����,Section B中列出的材料)�����,并有一份合法銷售的醫(yī)療器械的安全使用記錄(例如�����,通過醫(yī)療設備報告(MDR)分析�����、文獻搜索)���;
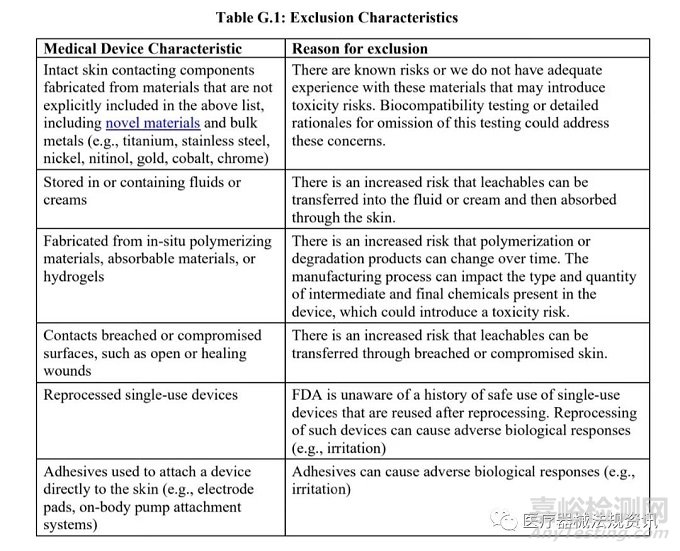
• 確認不屬于Section C中列出的排除情形(即���,下圖G.1中排除的器械)的聲明;
• 一份聲明:在其器械主記錄(DMR)中記錄的如何確定其設備的生物相容性風險已得到解決�����,生物相容性測試和制造的詳細原理在遞交文檔中不是必要的��。
【質(zhì)量體系管理過程應如何控制��?】
這種方法也依賴于質(zhì)量體系法規(guī)的某些部分(QSR820)和其他上市后控制���,以確定潛在的生物相容性相關問題��。
例如���,質(zhì)量體系和其他上市后控制要求應確定與完整皮膚接觸的器械的生物相容性問題(如果建立了程序)以及由制造商在器械主記錄中維護的記錄是否包括足夠的信息。