上海誼眾的紫杉醇膠束2021年10月份在國內(nèi)獲批上市,是紫杉醇藥物的創(chuàng)新劑型�,用于晚期非小細胞肺癌(NSCLC)一線治療適應癥,是國內(nèi)首個獲批上市的注射用紫杉醇聚合物膠束����。注射用紫杉醇膠束的出現(xiàn)標志著紫杉醇抗癌藥向靶向治療的新起點,同時也為廣大患者提供了一個新的用藥選擇����,接下來讓我們共同學習揭開聚合物膠束神秘的“面紗”。
一:簡介
聚合物膠束是由兩親性嵌段共聚物在水溶液中自發(fā)形成的微粒分散體系�,兩親性嵌段共聚物(既同時具有親水鏈和疏水鏈)。其親水部分材料主要是聚乙二醇(PEG)�,疏水部分材料通常為聚乳酸����、短鏈磷脂����、聚己內(nèi)酯等……同一種藥物����,其疏水部位不同進而會導致其和藥物的結(jié)合力有所差異��,前期研發(fā)之初����,研發(fā)人員可根據(jù)所載藥物的理化性質(zhì)結(jié)合嵌段共聚物的特性篩選出合適嵌段共聚物的疏水鏈段。疏水鏈段可與親水鏈段(PEG)構(gòu)成各種二嵌段(AB)或三嵌段(ABA)兩親性共聚物�,其分子量的大小可通過親水鏈段和疏水鏈段的長度及其重復單元的摩爾比來進行控制,從而得到不同親-疏水平衡值的嵌段共聚物����。
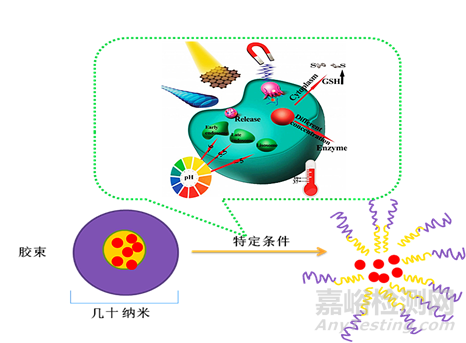
聚合物膠束在醫(yī)藥行業(yè)常被用于改善水溶性差藥物的溶解度��,從而提高藥物的生物利用度�,其作為給藥系統(tǒng)可提高藥物的穩(wěn)定性,降低毒性����,同時在一定條件下又具有靶向性(例如:聚合物膠束用于包載抗腫瘤藥時�,一定粒徑范圍的聚合物膠束可根據(jù)腫瘤部位的異質(zhì)性����,通過EPR效應能靶向到腫瘤部位)。用來制備聚合物膠束的藥物主要為難溶性的抗癌藥:紫杉醇��、多西他賽����、多柔比星、順鉑����、羥基喜樹堿等……國外已上市的膠束制劑有韓國sangoma公司的Genealogy和Nanotube®-M,印度Refusenik Kabuki公司的Nanotube����,印度sun pharma公司的PICN,俄羅斯miasma公司的Appeal/Clinical�,雌二醇納米膠束orchestra等。聚合物膠束的種類有很多種通??筛鶕?jù)作用部位與正常組織表達的異質(zhì)性進而對載體材料的結(jié)構(gòu)進行“特異化”設計制備具有不同響應機制的聚合物膠束,這種異質(zhì)性通常表現(xiàn)為PH、酶��、光����、超聲、氧化還原等……
圖1.1:聚合物膠束在不同物理����、化學刺激下,引發(fā)藥物釋放的示意圖
二:聚合物膠束與藥物的結(jié)合方式
聚合物膠束在形成過程中與藥物結(jié)合的方式通常有物理包埋�,化學結(jié)合和靜電作用三種形式:
①物理包埋:就是通過簡單的物理操作,難溶性藥物就可被載入疏水性內(nèi)核部位����,該操作方法簡單��,適用范圍廣��。
②化學結(jié)合:所載藥物與嵌段共聚物疏水部位的活性基團共價結(jié)合�,從而制備載藥的聚合物膠束��,該方法在應用上常被限制�,因為要求嵌段共聚物必須有能夠和所載藥物反應的基團。
③靜電結(jié)合:該結(jié)合方式需要求所載藥物與聚合物膠束的疏水段帶有相反的電荷�,通過靜電作用將藥物牢牢載入膠束內(nèi)核中�,通過該結(jié)合方式所制備出的載藥膠束有很好的穩(wěn)定性�。
綜上可知藥物與聚合物膠束結(jié)合的方式主要分為三種,研究人員可根據(jù)所載藥物的理化性質(zhì)�,進而選擇合適的兩親性嵌段共聚物或根據(jù)現(xiàn)有的嵌段共聚物針對性的選擇想要包載的藥物,嵌段共聚物和所載藥物是一對“命運共同體”單獨將其劃分開研究的想法是不可取的����。
三:聚合物膠束在醫(yī)藥方面的應用
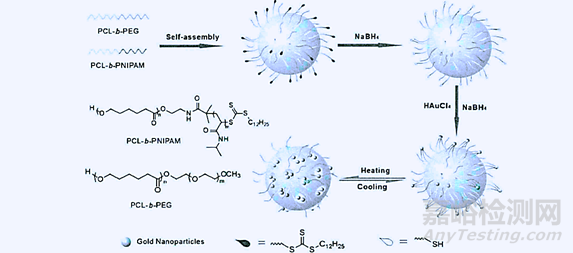
①醫(yī)學影像診斷中的應用:在臨床醫(yī)學診斷中臨床醫(yī)師需要借助造影劑來輔助診斷和監(jiān)測某些病灶部位,然而造影劑在進一步提高醫(yī)療診斷水準的同時��,其本身帶來的缺陷也不容忽視��,例如在診斷中成像性差和副作用反應劇烈����,大部分病人會出現(xiàn)惡心、嘔吐�、潮紅、發(fā)熱及局部疼痛等副作用�,將造影劑與聚合物膠束結(jié)合,制備出載有造影劑的聚合物膠束��,供患者使用其臨床效果得到了很大的改善�。
圖3.1:聚合物膠束負載金納米顆粒在醫(yī)學造影中的應用
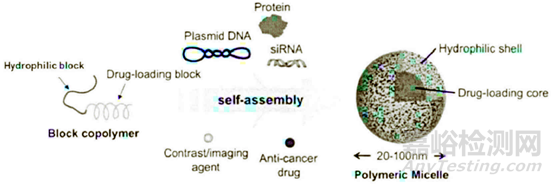
②基因藥物中的應用:眾所周知,外源性核酸因缺乏選擇性而產(chǎn)生特異性毒性。某些核酸本身就不穩(wěn)定�,低的細胞攝取率,容易被酶降解等限制了其在臨床中的應用�,研發(fā)人員將外源性的核酸與聚合物膠束結(jié)合,通過調(diào)節(jié)膠束的粒徑以及修飾其表面性能可實現(xiàn)載有外源性核酸的聚合物膠束在血液循環(huán)過程中的長效性����,并能到達靶向部位。
圖3.2:聚合物膠束用于裝載核酸藥物的示意圖
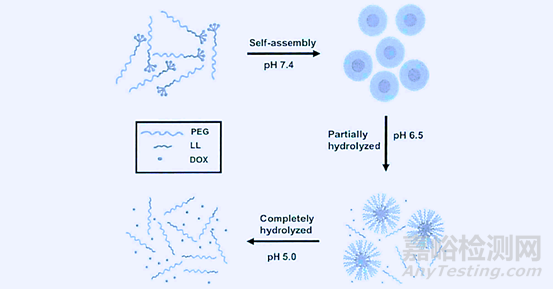
③抗腫瘤藥物方面的應用:近年來��,隨著人們生活水平的不斷提高�,飲食結(jié)構(gòu)不斷變化等其它因素,癌癥的發(fā)病率也在逐年上升����,已經(jīng)成為全世界死亡的主要原因之一。全球知名雜質(zhì)CA在2018年發(fā)布的全球癌癥統(tǒng)計報告中覆蓋了185個國家����,36種癌癥的發(fā)病率和死亡率,統(tǒng)計報告結(jié)果顯示中國癌癥患者的數(shù)量和死亡率均為全球第一����。癌癥的治療方法仍然是世界醫(yī)學界的一個難題����,手術(shù)切除��,放射治療和化學治療目前仍是癌癥的主要治療方法��。單獨或者聯(lián)合的治療方法均可在一定程度上使腫瘤細胞的生長速度受到抑制��,但同時又會對人體的正常細胞��,組織和器官產(chǎn)生副作用��。其帶來的副作用對于臨床醫(yī)務工作者本身也是一個棘手的問題����,大多數(shù)抗腫瘤藥在水中的溶解度并不好�。例如抗癌明星藥紫杉醇,研發(fā)工作者采用吐溫80和一定量乙醇來改善紫杉醇的難溶性問題�,在改善藥物難溶性的同時,所選輔料吐溫80帶來的致敏性導致臨床用藥前需做抗過敏預處理在很大程度上加大了癌癥患者服藥的順應性����。聚合物膠束的出現(xiàn)成功解決了上述問題,韓國經(jīng)過前期大量研究將人為合成的聚乙二醇2000-聚丙交酯通過物理包埋法成功的將紫杉醇包載到聚合物膠束中��,由于其自身輔料及該劑型本身的特殊性��,紫杉醇膠束在臨床應用中取得了不錯的療效,其客觀緩解率(ORR)顯著提高��,無進展生存期(PFS)顯著延長��。在國內(nèi)上海誼眾藥業(yè)股份有限公司也成功拿下生產(chǎn)批件����,成功拉開了國內(nèi)首例聚合物膠束運用到抗腫瘤藥方面的序幕。與此同時國內(nèi)各個藥企相繼效仿��,打響了聚合物膠束之戰(zhàn)��。
圖3.3:PH型敏感膠束用于包載抗癌藥DOX示意圖
四:聚合物膠束的載藥方法
聚合物膠束的制備方法眾多��,藥物通常以物理包埋的方式載入其中��。實驗室常用的制備方法有薄膜分散法��、透析法�、溶劑揮發(fā)法等……
①薄膜分散法:該制備方法相對來說比較簡單可行,就是將嵌段共聚物和所載藥物溶于合適的有機溶劑中��,在一定溫度下將其內(nèi)的有機溶劑通過旋轉(zhuǎn)式蒸發(fā)儀去除掉使其形成一層“薄膜”��,隨后將其在一定的水溫下利用嵌段共聚物本身的特殊結(jié)構(gòu)性質(zhì)重新分散到水中去����,該過程通常稱為水化,通過上述步驟就可以制備載藥膠束����。
②透析法:透析法是將兩親性的嵌段共聚物和被載藥物共同溶于和水互溶的有機溶劑中,溶解之后將其裝入合適截留分子量的透析袋中����,用水透析取代溶有聚合物和被載藥物的有機溶劑,透析法制備過程簡單�,易于操作,但其制備時間較長且透析過程中產(chǎn)生大量的廢水�,因此該方法只應用于實驗室的制備,難以產(chǎn)業(yè)化生產(chǎn)����。
③溶劑揮發(fā)法:溶劑揮發(fā)法嚴格意義上來說有兩種:一種為乳化溶劑揮發(fā)法,一種為自組裝溶劑揮發(fā)法��。乳化溶劑揮發(fā)法通常將嵌段共聚物和被載藥物共同溶解在與水不相溶且易揮發(fā)的有機溶劑中通常為二氯甲烷等……將有機溶劑加入到水性介質(zhì)中混合乳化����,形成水包油(O/W)型乳劑,在乳化的過程中重新分散排列形成載藥膠束����。乳化溶劑揮發(fā)法是將嵌段共聚物和被載藥物共同溶于易揮發(fā)的有機溶劑中�,例如丙酮等……將其逐滴加入到水性介質(zhì)中從而形成載藥膠束����。
載藥膠束的的制備方法有很多,研發(fā)工作者可根據(jù)所載藥物性質(zhì)及所選嵌段共聚物的一些性質(zhì)選擇合適的制備方法��,上述所提到的溶劑揮發(fā)法和透析法實驗室階段運用比較多����,工藝放大轉(zhuǎn)移在實際生產(chǎn)中仍有諸多問題需要解決。薄膜分散法工藝過程較為簡單且已有產(chǎn)業(yè)化生產(chǎn)的案例?,F(xiàn)針對薄膜分散法制備載藥膠束時從小試的研發(fā)階段到產(chǎn)業(yè)化放大生產(chǎn)中所要注意的問題及關(guān)鍵工藝風險點在這里和大家分享共同學習一下。
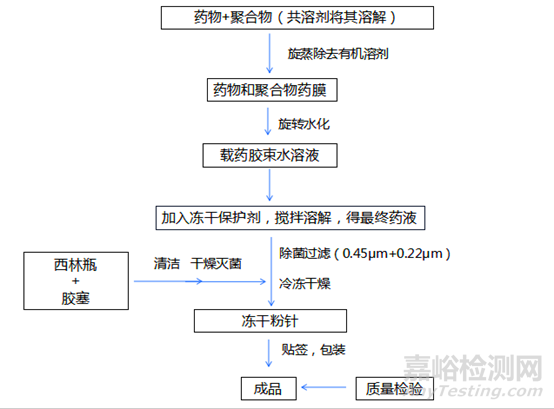
圖4.1:薄膜分散法制備膠束的工藝流程圖
對于載體類納米藥物����,載藥量和包封率是小試研發(fā)階段需要重點關(guān)注的質(zhì)量屬性。包封率和載藥量與納米藥物處方組成和制備工藝等密切相關(guān)��,載藥量與藥物和載體的相互作用有關(guān)����,載藥量過低可能導致輔料使用量過多、納米粒濃度增加或注射體積變大等��,使得臨床應用受限,且成本和安全性風險也相對增加����。包封率過低的話會對放大生產(chǎn)過濾除菌這步帶來風險(一般要求包封率需滿足98%以上)��,所以針對于載體納米藥物實驗室研發(fā)階段載藥量和包封率是需要重點關(guān)注的兩個關(guān)鍵質(zhì)量屬性�。對于載體納米藥物,載體材料關(guān)系到活性成分的包載��、保護以及最終產(chǎn)品的體內(nèi)外性能��,應明確載體類材料的規(guī)格����、純度、分子量和分子量分布范圍等��,并通過處方工藝和質(zhì)量控制研究等證明載體材料選擇的合理性��。目前可用作制備膠束的嵌段共聚物有很多����,但能成功運用到產(chǎn)業(yè)化生產(chǎn)的聚合物載體材料制備膠束卻很少,目前上市的注射用紫杉醇膠束所用載體為甲氧基聚乙二醇2000-聚丙交酯兩嵌段共聚物(52:48)現(xiàn)針對此載體用薄膜分散法制備膠束時所要注意的事項及關(guān)鍵風險點做簡要的探討�。目前該載體主要涉及腫瘤藥方面的運用��,大多數(shù)抗腫瘤藥是難溶于水的����,在工藝流程圖中的第一步需要找到合適的共溶劑將其溶解�,作為一名科研工作者要在整個研發(fā)過程中時刻保持著全局觀念,在保證藥品質(zhì)量合格的前提下一切以產(chǎn)業(yè)化為中心��,考慮到后續(xù)車間放大生產(chǎn)����,安全及可操作性的同時供研發(fā)人員選擇的共溶劑是非常局限的,可供選擇的有機溶劑常用有乙醇和乙腈����,有機溶劑總體篩選原則為在保證能夠?qū)⑶抖喂簿畚锖捅惠d藥物很好溶解的前提下還要低毒,安全����,沸點低,易于旋蒸去除����。在旋蒸除去有機溶劑時旋蒸溫度也很關(guān)鍵,旋轉(zhuǎn)式蒸發(fā)儀在能保證真空度的前提下,結(jié)合原料藥和載體理化性質(zhì)合適的旋蒸溫度和時間能夠?qū)⒂袡C溶劑很快的除去并且殘留量在合理的范圍內(nèi)��。有機溶劑除去后會得到藥物和聚合物均勻的混合物類似于“果凍”樣流動的黏稠液體��,此時將其均勻的攤平在圓底燒瓶內(nèi)壁��,有助于后續(xù)旋轉(zhuǎn)水化的效率�。水化這步在整個載藥膠束制備過程中有著舉足輕重的位置,兩親性聚合物和藥物形成載藥膠束就是在這個過程�,直接決定了實驗成與敗的走向�,水化時水化溫度和時間相對來說是比較關(guān)鍵的工藝參數(shù),此步驟容易導致藥物析出也就是我們常說的漏藥��,水化的溫度和時間要結(jié)合原料藥的理化性質(zhì)和嵌段共聚物的玻璃化轉(zhuǎn)變溫度來定�,甲氧基聚乙二醇2000-聚丙交酯兩嵌段共聚物(52:48)常用的水化溫度在50℃左右,總體一個原則就是盡可能的在較短的時間內(nèi)將藥膜水化下來�。水化成功后向膠束水溶液加入凍干保護劑,待凍干保護劑溶解完后過濾��,灌裝����。
五:展望
上海誼眾注射用紫杉醇膠束的成功上市打開了聚合物膠束在抗腫瘤藥方面運用的市場,想必未來聚合物膠束運用到臨床方面會有更多的藥企加入進來平分這份“蛋糕”����。然而��,一個新劑型的出現(xiàn)����,有其優(yōu)勢之處����,必會有不足之處。眾所周知��,癌細胞與正常細胞相比其所處的內(nèi)外環(huán)境有所不同��。如物理化學性能��、新血管系統(tǒng)及PH等�。由于腫瘤組織中血管內(nèi)皮細胞間隙較大,粒徑在100nm以下的粒子很容易滲入而滯留在腫瘤組織中����。EPR效應(enhanced permeability and retention effect)即實體瘤的高通透和滯留效應,指的是相對于正常組織�,某些尺寸的分子或顆粒更趨向于聚集在腫瘤組織部位的性質(zhì)。人體血液系統(tǒng)環(huán)境是比較復雜的�,當載有抗癌藥的聚合物膠束采用靜脈滴注的方式到血液中,面對血液稀釋及產(chǎn)生的剪切力,聚合物膠束是否能夠抵擋住人體復雜環(huán)境的重重“攻擊”到達腫瘤部位呢����?前面有所提及,聚合物膠束靶向性的實現(xiàn)是需要聚合物膠束能夠在血液系統(tǒng)中能夠長循環(huán)為前提才能夠?qū)崿F(xiàn)的����。單純的依靠被動靶向到達腫瘤部位,這就對嵌段共聚物提出了嚴峻的考驗�,需要求聚合物膠束具有較小的CMC(critical micelle concentration),從而實現(xiàn)在體內(nèi)的長循環(huán)進而實現(xiàn)被動靶向����。然而事實上聚合物膠束在面臨血液系統(tǒng)的復雜環(huán)境被動靶向是很難實現(xiàn)的�。縱觀以上分析想要做出有市場競爭性的產(chǎn)品��,想要聚合物膠束在抗腫瘤方面運用有一定的市場份額�,嵌段共聚物的創(chuàng)新是其必然趨勢。深刻分析腫瘤部位的異質(zhì)性��,需設計合成與腫瘤部位相契合活性基團的嵌段共聚物����,考慮到血液循環(huán)時還應給足它高滲透,高滯留的時間,保證它被動靶向同時�,在加上其材料上活性基團所帶來的主動靶向,有可能會在臨床應用中產(chǎn)生意向不到的效果�。聚合物膠束運用到抗腫瘤藥方面本應在嵌段共聚物上大作文章,而不是只停留在輔料帶來的減毒方面來回踱步����。
六:總結(jié)
本文的開頭為大家簡單的介紹了聚合物膠束的基本概念,后續(xù)又給大家介紹了聚合物膠束的載藥方式及聚合物膠束在臨床中的運用�,目的是讓大家對聚合物膠束有更加深層次的了解。其次分享了聚合物膠束的制備方法-薄膜分散法的關(guān)鍵工藝風險點����,最后談了一下自己對于聚合物膠束未來發(fā)展方向的看法和期許。由于本人寫作水平有限�,有理解不到位的地方還望及時與作者聯(lián)系,謝謝大家!
參考文獻:
【1】納米藥物質(zhì)量控制研究技術(shù)指導原則
【2】Huang M, Li H, E W, ET AL. Finely Tuned Mother-Responsive Block Co polymer Michelle for Geothermal Effect-Triggered Efficient Cellular Internalization [J]. Macrology BIOS, 2016, 16 (9): 1265-1272.
【3】Gangsta KJ, Bong W-K, Darwinist T, ET AL. Novel spirant audiophiles and their application as light-responsive liquid crystalline components [J]. J Phys Chem B, 2013, 117(35):10203–10210.
【4】光敏感型嵌段聚合物膠束的研究進展
【5】刺激響應型聚合物膠束作為藥物載體研究進展
【6】Portrait NY, Kennedy AM, Shea JE, ET AL. Controlled and targeted tumor chemotherapy by ultrasound-activated emulsification/micro bubbles [J]. J Control