今日頭條
紐安津mRNA腫瘤疫苗啟動(dòng)IIT臨床�����。紐安津生物個(gè)性化腫瘤新抗原mRNA疫苗iNeo-Vac-R01在Clinicaltrials.gov網(wǎng)站上注冊(cè)啟動(dòng)一項(xiàng)單中心�����、開(kāi)放標(biāo)簽�����、單臂臨床研究���,計(jì)劃在邵逸夫醫(yī)院開(kāi)展���,評(píng)估iNeo-Vac-R01聯(lián)合一線治療用于晚期消化系統(tǒng)腫瘤患者的安全性��、可行性和有效性�����。今年4月���,該公司首款產(chǎn)品個(gè)體化多肽疫苗注射用P01已獲國(guó)家藥監(jiān)局臨床許可,擬開(kāi)發(fā)用于實(shí)體瘤的治療��。
國(guó)內(nèi)藥訊
1.皮質(zhì)類(lèi)固醇抑制劑中國(guó)獲批上市��。HRA Pharma Rare Diseases公司1類(lèi)化藥米托坦片(mitotane)獲國(guó)家藥監(jiān)局批準(zhǔn)上市�����,用于治療晚期腎上腺皮質(zhì)癌(ACC)���。通過(guò)線粒體改變和抑制甾醇-O-?����;D(zhuǎn)移酶1(SOAT1)的活性��,米托坦可對(duì)腎上腺皮質(zhì)細(xì)胞產(chǎn)生直接的細(xì)胞毒性作用�����;并通過(guò)改變皮質(zhì)醇的外周代謝抑制腎上腺皮質(zhì)分泌皮質(zhì)類(lèi)固醇�����,來(lái)抑制皮質(zhì)類(lèi)固醇的合成��。該新藥此前已被CDE納入優(yōu)先審評(píng)�����。
2.上海海和MET抑制劑日本報(bào)產(chǎn)�����。海和藥物MET抑制劑谷美替尼片向日本厚生勞動(dòng)省提交新藥上市申請(qǐng)��,用于治療具有MET 14外顯子跳變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)��。在II期臨床SCC244-108(GLORY)中�����,谷美替尼在總體人群�����、初治患者以及既往經(jīng)治患者的ORR分別為60.9%�����、66.7%��、51.9%�����;中位緩解持續(xù)時(shí)間(DoR)為8.2個(gè)月��,中位無(wú)進(jìn)展生存時(shí)間(mPFS)為7.6個(gè)月���。今年3月���,該新藥已獲NMPA附條件批準(zhǔn)上市。
3.艾力斯EGFR-TKI肺癌早期臨床積極��。艾力斯醫(yī)藥第三代EGFR-TKI創(chuàng)新藥艾弗沙(甲磺酸伏美替尼)治療EGFR 20外顯子插入突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)的Ⅰb期臨床(FAVOUR)結(jié)果積極�����。截止2023年6月15日,經(jīng)IRC評(píng)估���,初治240mg組�����、經(jīng)治240mg組�����、經(jīng)治160mg組的確證客觀緩解率(ORR)分別為78.6%���、46.2%、38.5%�����,中位緩解持續(xù)時(shí)間(DoR)分別為15.2個(gè)月���、13.1個(gè)月、9.7個(gè)月���。藥物耐受性良好��。詳細(xì)結(jié)果將公布于WCLC2023年會(huì)上���。
4.同源康CDK2/4/6抑制劑國(guó)內(nèi)批獲臨床�����。同源康醫(yī)藥1類(lèi)化藥TYK-00540片獲國(guó)家藥監(jiān)局臨床許可�����,擬開(kāi)發(fā)用于治療局部晚期/轉(zhuǎn)移性實(shí)體瘤�����。TYK-00540是一款CDK2/4/6抑制劑��,擬用于治療既往CDK4/6抑制劑經(jīng)治后復(fù)發(fā)或進(jìn)展的ER+/HER2-乳腺癌�����、鉑類(lèi)耐藥的晚期高級(jí)別漿液性卵巢癌���、局部晚期/轉(zhuǎn)移性三陰乳腺癌以及其他局部晚期/轉(zhuǎn)移性實(shí)體瘤���。此前,該產(chǎn)品已獲FDA臨床批件��。
5.FIC潰腸炎新藥中國(guó)獲批臨床�����。Abivax公司1類(lèi)化藥obefazimod獲國(guó)家藥監(jiān)局臨床許可�����,擬用于治療中重度潰瘍性結(jié)腸炎(UC)患者��。obefazimod(ABX464)旨在靶向帽子結(jié)合復(fù)合物(CBC)上調(diào)miR-124的表達(dá)��,來(lái)抑制許多炎癥反應(yīng)介導(dǎo)物的生產(chǎn)��。去年9月��,Abivax公司已完成約4920萬(wàn)美元的融資�����,用于支持obefazimod開(kāi)展Ⅲ期臨床���,評(píng)估治療UC的有效性和安全性���。
國(guó)際藥訊
1.羅氏PD-L1單抗肺癌五年療效積極。羅氏PD-L1抑制劑阿替利珠單抗聯(lián)合化療治療廣泛期小細(xì)胞肺癌(ES-SCLC)的III期臨床(IMpower133)擴(kuò)展研究IMbrella A結(jié)果積極��。最新數(shù)據(jù)顯示���,有12%的患者在接受阿替利珠單抗聯(lián)合化療治療后OS超過(guò)5年���。此前在III期臨床(IMpower133)中,中位隨訪期13.9個(gè)月��,相較于單獨(dú)化療治療組���,阿替利珠單抗聯(lián)合化療組�����,ES-SCLC患者的生存時(shí)間延長(zhǎng)(OS=12.3個(gè)月對(duì)比10.3個(gè)月�����;HR=0.70��,95% CI:0.54-0.91���,p=0.0069)���。
2.賽諾菲IRAK4靶向PROTAC啟動(dòng)Ⅱ期臨床。賽諾菲與Kymera聯(lián)合開(kāi)發(fā)的FIC口服IRAK4蛋白降解劑KT-474在Clinicaltrials.gov網(wǎng)站上注冊(cè)一項(xiàng)Ⅱ期臨床���,擬評(píng)估治療中重度化膿性汗腺炎的安全性與有效性��。KT-474可同時(shí)阻斷Th1���、Th2、Th17通路�����,有望治療多種自身免疫病��。Ⅰ期臨床數(shù)據(jù)顯示���,KT-474治療使患者IRAK4水平最大降解超過(guò)90%��,并廣泛抑制針對(duì)多種疾病相關(guān)的促炎細(xì)胞因子和趨化因子��,而且藥物總體耐受性良好���。
3.羅氏PD-L1單抗皮下劑美國(guó)上市時(shí)間延遲。羅氏日前正根據(jù)FDA要求更新PD-L1抗體阿替利珠單抗皮下注射劑(Tecentriq SC)的生產(chǎn)工藝�����,該產(chǎn)品的上市申請(qǐng)預(yù)計(jì)將延遲至2024年獲批���。去年11月���,羅氏向FDA和EMA提交Tecentriq SC的上市申請(qǐng),旨在覆蓋Tecentriq靜脈注射劑所有已獲批的適應(yīng)癥���。在臨床試驗(yàn)中��,與需要30-60分鐘的靜脈(IV)輸注相比���,只需7分鐘的皮下注射Tecentriq在血液中的水平(藥代動(dòng)力學(xué))顯示出非劣效性。
4.鼻腔給藥CD3抗體AD臨床前研究積極�����。Tiziana公司CD3單抗foralumab(NI-0401)用于治療阿爾茲海默病(AD)的臨床前研究結(jié)果積極。AD模型小鼠每周接受三次鼻內(nèi)foralumab治療��,為期5個(gè)月�����。結(jié)果顯示foralumab可通過(guò)靶向激活大腦中的小膠質(zhì)細(xì)胞�����,同時(shí)擴(kuò)大外周的調(diào)節(jié)性T細(xì)胞��,從而改善AD病情��。NI-0401有望成為治療AD的一種新型免疫療法���。今年8月���,F(xiàn)DA已批準(zhǔn)foralumab開(kāi)展用于輕中度AD患者的Ⅰ期臨床。
5.Seagen公司逾34億美元開(kāi)發(fā)DAC新藥�����。Seagen公司與Nurix公司將利用后者專(zhuān)有的蛋白降解(TPD)靶向技術(shù)平臺(tái),針對(duì)Seagen所提名適用于抗體偶聯(lián)的多個(gè)靶標(biāo)���,開(kāi)發(fā)一套靶向蛋白降解劑���,用于推進(jìn)Seagen開(kāi)發(fā)降解抗體偶聯(lián)藥物(DAC)的新類(lèi)型藥物�����,提高癌癥治療的特異性和療效��。根據(jù)協(xié)議��,Nurix將獲得6000萬(wàn)美元的預(yù)付款���,可能高達(dá)約34億美元的研究開(kāi)發(fā)�����、監(jiān)管和商業(yè)里程碑潛在付款���。
6.大冢逾15億美元布局眼科基因療法。大冢制藥與Shape Therapeutics將利用后者AAVid衣殼發(fā)現(xiàn)平臺(tái)和轉(zhuǎn)基因工程技術(shù)��,聯(lián)合開(kāi)發(fā)玻璃體內(nèi)遞送的腺相關(guān)病毒(AAVs)基因療法,用于治療眼部疾病��。Shape的AAVid平臺(tái)結(jié)合了數(shù)十億獨(dú)特AAV變異的大通量篩選和機(jī)器學(xué)習(xí)��,以識(shí)別新型AAV衣殼���,用于直接進(jìn)入非人靈長(zhǎng)類(lèi)(NHP)的體內(nèi)篩選�����,以最大限度地實(shí)現(xiàn)臨床轉(zhuǎn)化��。根據(jù)協(xié)議�����,大冢制藥還可選擇添加額外的靶點(diǎn)和組織類(lèi)型���。
醫(yī)藥熱點(diǎn)
1.三部門(mén)調(diào)整麻醉和精神藥品目錄。國(guó)家藥監(jiān)局�����、公安部和國(guó)家衛(wèi)健委聯(lián)合發(fā)布調(diào)整麻醉藥品和精神藥品目錄的公告(2023年第120號(hào))�����,自2023年10月1日起施行。根據(jù)《麻醉藥品和精神藥品管理?xiàng)l例》有關(guān)規(guī)定�����,三部門(mén)決定將泰吉利定列入麻醉藥品目錄���;將地達(dá)西尼�����、依托咪酯(在中國(guó)境內(nèi)批準(zhǔn)上市的含依托咪酯的藥品制劑除外)列入第二類(lèi)精神藥品目錄;將莫達(dá)非尼由第一類(lèi)精神藥品調(diào)整為第二類(lèi)精神藥品��。
2.杭州康復(fù)醫(yī)院正式啟用�����。9月7日���,杭州康復(fù)醫(yī)院(杭州市特殊康復(fù)中心)啟用儀式舉行���。該醫(yī)院為杭州市首家公立康復(fù)機(jī)構(gòu),采取杭州市殘聯(lián)、杭州市衛(wèi)健委雙重領(lǐng)導(dǎo)的辦醫(yī)模式�����。杭州康復(fù)醫(yī)院建筑總面積30500平方米���,一期核定床位249張���。醫(yī)院?jiǎn)⒂煤螅瑢⑴c杭州市第一人民醫(yī)院“一院五區(qū)”一體化運(yùn)營(yíng)��,實(shí)施高標(biāo)準(zhǔn)同質(zhì)化管理���。
3.國(guó)家藥監(jiān)局出臺(tái)醫(yī)藥電商監(jiān)管指導(dǎo)原則���。9月6日,國(guó)家藥監(jiān)局綜合司就《藥品網(wǎng)絡(luò)交易第三方平臺(tái)檢查指導(dǎo)原則》對(duì)外公開(kāi)征求意見(jiàn)���,這是繼去年12月《藥品網(wǎng)絡(luò)銷(xiāo)售監(jiān)督管理辦法》實(shí)施之后�����,國(guó)家藥監(jiān)局專(zhuān)門(mén)針對(duì)藥品網(wǎng)售第三方平臺(tái)發(fā)布的檢查文件�����。文件明確�����,針對(duì)第三方平臺(tái)的常規(guī)檢查將圍繞在經(jīng)營(yíng)規(guī)模大���、覆蓋范圍廣�����、業(yè)務(wù)量較大的第三方平臺(tái)�����,以及首次開(kāi)展第三方平臺(tái)業(yè)務(wù)、無(wú)藥品流通行業(yè)從業(yè)背景的服務(wù)企業(yè)���。
評(píng)審動(dòng)態(tài)
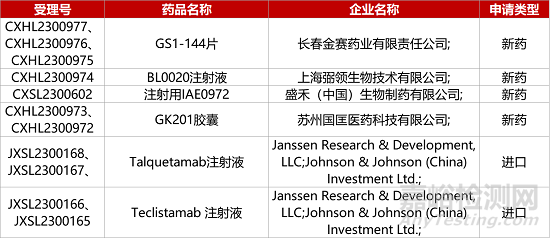
1. CDE新藥受理情況(09月11日)
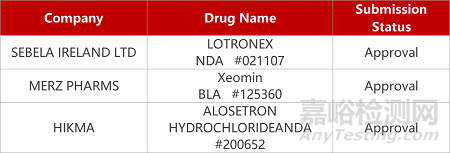
2. FDA新藥獲批情況(北美09月08日)