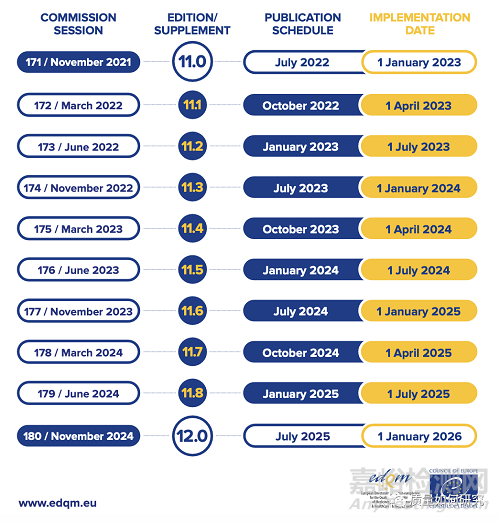
歐洲藥典的內(nèi)容和結(jié)構(gòu),包括以下部分:
——General notices(凡例)
凡例是歐洲藥典的第一部分,內(nèi)容適用于所有文本����,旨在向用戶提供基本信息,解決一般性問(wèn)題。企業(yè)應(yīng)在使用各論和其他文本之前閱讀凡例�����。
——General chapters & general texts(通則)
通則是對(duì)藥品質(zhì)量指標(biāo)檢測(cè)的統(tǒng)一規(guī)定,避免在每個(gè)各論中重復(fù)標(biāo)準(zhǔn)程序或要求。當(dāng)在各論中被提及時(shí)����,其將成為強(qiáng)制性的。General chapters提供標(biāo)準(zhǔn)分析方法�����,可以在沒(méi)有各論指導(dǎo)時(shí)使用����,General texts聚焦于某些主題�����,闡述監(jiān)管指南原則����。
——Individual monographs(各論)
具體但不是獨(dú)立的文本;分析方法(Analytical procedures)和驗(yàn)收標(biāo)準(zhǔn)(acceptance criteria)代表所需的質(zhì)量標(biāo)準(zhǔn)(quality standards);依賴制造商的反饋(公眾咨詢)。
——General monographs(總論)和Dosage form monographs(制劑各論)
總論和制劑各論對(duì)其定義范圍內(nèi)的所有物質(zhì)/產(chǎn)品都是強(qiáng)制性的�����?���?傉摪↖ndividual monographs(各論)中沒(méi)有的方面,與各論互補(bǔ)且并不排斥。
通則部分:
1、凡例適用于歐洲藥典的所有各論和其他文本。
2����、歐洲藥典的官方文本以英語(yǔ)和法語(yǔ)出版�����。其他語(yǔ)言的譯文可由《歐洲藥典公約》簽署國(guó)準(zhǔn)備����。如有疑問(wèn)或爭(zhēng)議��,僅英文和法文版本具有權(quán)威性����。
3����、在歐洲藥典的文本中����,沒(méi)有限定的“藥典”一詞是指歐洲藥典。官方縮寫(xiě)Ph. Eur.表示歐洲藥典����。
4、使用各論的標(biāo)題或副標(biāo)題意味著產(chǎn)品符合相關(guān)各論的要求�����。藥典文本中對(duì)各論的引用使用斜體的各論標(biāo)題和參考編號(hào)顯示��。
5�����、一個(gè)制劑必須在它整個(gè)有效期內(nèi)符合要求����;開(kāi)口或拉制容器的單獨(dú)有效期或質(zhì)量標(biāo)準(zhǔn)可由主管當(dāng)局決定。任何其他各論的內(nèi)容必須在它整個(gè)使用期間遵守。制定任何特定產(chǎn)品的有效期和計(jì)算期限的時(shí)間由主管當(dāng)局根據(jù)穩(wěn)定性研究的實(shí)驗(yàn)結(jié)果決定。
6、除非在凡例或各論中另有說(shuō)明����,否則各論中的陳述構(gòu)成強(qiáng)制性要求。在各論中提及的凡例要求一般為強(qiáng)制性的��,除非這種提及的方式表明����,其意圖不是使所提及的文本成為強(qiáng)制性的����,而是引用它以供參考。
7、各論中描述的活性物質(zhì)�����、輔料、藥物制劑和其他物品旨在供人類和獸醫(yī)使用(除非明確限于其中一種用途)��。
8�����、各論所代表的質(zhì)量標(biāo)準(zhǔn)僅在有關(guān)產(chǎn)品是在適當(dāng)?shù)馁|(zhì)量體系框架內(nèi)生產(chǎn)的時(shí)才有效�����。質(zhì)量體系必須確保物品始終符合藥典的要求�����。
9��、所描述的測(cè)試和含量測(cè)定是藥典標(biāo)準(zhǔn)所依據(jù)的官方方法��。經(jīng)主管當(dāng)局同意�����,可采用其他替代方法進(jìn)行控制����,但所使用的方法必須能夠明確決定如果使用官方方法����,是否符合各論的標(biāo)準(zhǔn)����。如有疑問(wèn)或爭(zhēng)議,僅藥典的分析方法具有權(quán)威性�����。
10�����、一個(gè)產(chǎn)品除非符合各論中規(guī)定的所有要求�����,否則就不符合藥典質(zhì)量����。但這并不意味著各論中所有測(cè)試的性能一定是制造商在產(chǎn)品放行前評(píng)估是否符合藥典的先決條件。制造商可以根據(jù)其設(shè)計(jì)以及其控制策略和數(shù)據(jù)(例如生產(chǎn)工藝的驗(yàn)證研究)來(lái)保證獲得的產(chǎn)品符合藥典質(zhì)量�����。
11、 增強(qiáng)的質(zhì)量控制方法可以利用過(guò)程分析技術(shù)(PAT)和/或?qū)崟r(shí)放行測(cè)試(包括參數(shù)放行)策略作為單獨(dú)最終產(chǎn)品測(cè)試的替代方案�����。因此����,在主管當(dāng)局認(rèn)為適當(dāng)?shù)那闆r下進(jìn)行實(shí)時(shí)放行測(cè)試并不違反藥典的要求。
12����、減少動(dòng)物試驗(yàn):歐洲藥典致力于根據(jù)《歐洲保護(hù)用于實(shí)驗(yàn)和其他科學(xué)目的的脊椎動(dòng)物公約》規(guī)定的3R(替代����、減少、改進(jìn))逐步淘汰用于試驗(yàn)?zāi)康牡膭?dòng)物��。為了證明符合藥典��,制造商可以考慮建立額外的系統(tǒng)來(lái)監(jiān)控生產(chǎn)的一致性��。
13��、作為藥典各論內(nèi)容的某些物料可能有適合不同目的的不同等級(jí)存在。除非各論中另有說(shuō)明����,否則這些要求適用于所有等級(jí)的材料。在一些各論中����,特別是關(guān)于輔料的各論中,可能會(huì)在各論中附一個(gè)列表以供參考��,同時(shí)還可能給出用于確定這些特性中的一個(gè)或多個(gè)的測(cè)試方法供參考��。
14�����、總論����。作為各論內(nèi)容中的活性物質(zhì)和制劑也必須遵守相關(guān)的、適用的總論����。各論中通常不對(duì)適用的總論進(jìn)行交叉引用。
15��、總論適用于總論定義部分范圍內(nèi)的所有活性物質(zhì)和制劑,除非序言限制應(yīng)用�����。
16�����、總論和各論是互補(bǔ)的�����。如果總論的規(guī)定不適用于特定產(chǎn)品�����,則在各論中應(yīng)明確說(shuō)明�����。
17�����、各論和通則中給出的測(cè)試方法已根據(jù)公認(rèn)的科學(xué)實(shí)踐和當(dāng)前關(guān)于分析驗(yàn)證的建議進(jìn)行了驗(yàn)證��。除非各論或通則中另有說(shuō)明��,否則不需要分析人員對(duì)測(cè)試方法進(jìn)行驗(yàn)證����。
18、在實(shí)施藥典方法時(shí)����,用戶必須根據(jù)相關(guān)各論,通則和質(zhì)量體系評(píng)估該方法在實(shí)際使用條件下的適用性��。
19����、某些通則中包含聲明指出有關(guān)文本與日本藥典和/或美國(guó)藥典的相應(yīng)文本一致,并且這些文本可以互換��。這意味著����,如果使用這些藥典之一的可互換方法發(fā)現(xiàn)活性物質(zhì)或制劑符合要求,則符合歐洲藥典的要求�����。如有疑問(wèn)或爭(zhēng)議,僅歐洲藥典文本具有權(quán)威性����。
20、各論和通則中可能包含對(duì)藥品監(jiān)管機(jī)構(gòu)發(fā)布的文件的引用����,例如歐盟指導(dǎo)指令和說(shuō)明。這些參考資料僅供藥典用戶參考��。列入這種引用文件并不改變所提及文件的地位����,后者可能是強(qiáng)制性的或作為指導(dǎo)。
21��、在具有數(shù)值限制的測(cè)定和含量測(cè)試中�����,所述用于檢查的數(shù)量是近似值��。實(shí)際使用的數(shù)量可在所述相差不超過(guò)10%的范圍內(nèi)精確稱重或測(cè)量�����,并根據(jù)該確切數(shù)量計(jì)算結(jié)果����。在限值不是數(shù)值,但通常取決于與相同條件下對(duì)照物質(zhì)的行為進(jìn)行比較的測(cè)試中����,則取所述數(shù)量進(jìn)行檢查。試劑按規(guī)定量使用����。
22、稱量或測(cè)量量的準(zhǔn)確度與預(yù)期的精度有關(guān)�����。對(duì)于稱量�����,精度對(duì)應(yīng)于所述最后一個(gè)數(shù)字后的正負(fù) 5 個(gè)單位(例如��,0.25 g 應(yīng)解釋為 0.245 g 至 0.255 g)�����。對(duì)于體積測(cè)量,如果小數(shù)點(diǎn)后的數(shù)字為零或以零結(jié)尾(例如����,10.0 mL 或 0.50 mL),則酌情使用移液器����、容量瓶或滴定管測(cè)量體積;否則����,可以使用刻度測(cè)量筒或刻度移液器。以微升為單位的體積使用微量移液器或微量注射器測(cè)量��。
23�����、在某些情況下�����,描述數(shù)量的精度與特定數(shù)字限制中規(guī)定的有效數(shù)字的數(shù)量不符����。那就需要以足夠高的準(zhǔn)確性進(jìn)行稱重和測(cè)量。
24��、體積玻璃器皿需符合國(guó)際標(biāo)準(zhǔn)化組織頒布的相應(yīng)國(guó)際標(biāo)準(zhǔn)的A級(jí)要求����。
25、除非另有規(guī)定��,分析過(guò)程通常是在15~25?C下進(jìn)行��。
26����、除非另有規(guī)定,比對(duì)試驗(yàn)通常使用具有平坦底座的無(wú)色����,透明,中性玻璃的相同試管進(jìn)行比較��。通常使用內(nèi)徑為16毫米的試管����,但調(diào)整使用的液體體積�����,也可以使用內(nèi)徑較大的管子����。在白色背景下沿管的垂直軸向下檢查等體積的待比較液體�����,或者在必要時(shí)在黑色背景下檢查����。檢查應(yīng)在漫射光下進(jìn)行。
27��、除非規(guī)定了空白測(cè)試�����,否則在使用指示劑的測(cè)試或測(cè)定中所用的任何溶劑應(yīng)先中和�����。
28��、除非指定溫度,水浴通常是指沸水浴����。如果溫度接近但不高于100?C或規(guī)定溫度�����,則可以使用其他加熱方法����。
29、干燥或熾灼至恒重是指連續(xù)兩次稱量的重量相差不大于0.5mg�����,第二次的稱重應(yīng)根據(jù)殘留物的性質(zhì)和數(shù)量在額外干燥或熾灼一段時(shí)間后稱量�����。如果使用 “在干燥器中”或“在真空中”的表述之一進(jìn)行干燥��,則使用第2.2.32章中所述的條件進(jìn)行干燥����。
30��、藥典中描述的分析程序的正確進(jìn)行和結(jié)果的可靠性部分取決于所用試劑的質(zhì)量����。試劑在通則第4章中描述�����。通常使用分析級(jí)試劑����;對(duì)于某些試劑,規(guī)格中包括了確定適用性的測(cè)試�����。
31�����、如果沒(méi)有指明溶劑名稱�����,“溶液”通常指水溶液�����。
32、在藥典中描述的分析程序中指定或暗示使用水或用于制備試劑�����,應(yīng)使用符合專論純化水(0008)要求的水��。除了出于多種目的����,細(xì)菌內(nèi)毒素(散裝純化水)和微生物污染(容器中的純凈水)的要求不相關(guān)��。術(shù)語(yǔ)“蒸餾水”表示通過(guò)蒸餾制備的純凈水����。
33、沒(méi)有限定的術(shù)語(yǔ)“Ethanol”是指無(wú)水乙醇��。沒(méi)有限定的“Alcohol”一詞是指乙醇(96%)��。乙醇的其他稀釋液由術(shù)語(yǔ)“Ethanol”或“Alcohol”表示�����,后跟所需乙醇體積百分比(C2H6O)的聲明。
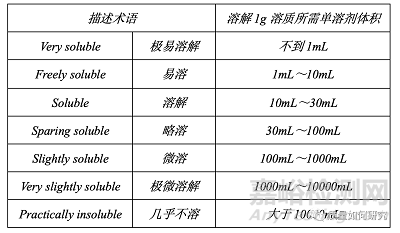
34��、在定義含量時(shí)����,“百分比”一詞根據(jù)情況使用,具有以下兩種含義之一:
m/m(質(zhì)量百分比)��,表示在100g產(chǎn)品中活性物質(zhì)的克數(shù)�����。
V/V(體積百分比)�����,表示在100mL產(chǎn)品中活性物質(zhì)的毫升數(shù)�����。
除非另有說(shuō)明��,否則“百萬(wàn)分之幾”(或ppm)一詞是指質(zhì)量比��。
35、如果分析程序描述溫度而沒(méi)有數(shù)字��,則使用的一般術(shù)語(yǔ)具有以下含義:
in a deep-freeze(冷凍): 低于 -15 °C�����;
in a refrigerator(冷藏): 2 °C~ 8 °C����;
cold or cool(陰涼): 8°C ~15°C;
room temperature(室溫): 15 °C~ 25 °C.
36�����、用于容器的材料在通則第3.1章中描述��。用于材料�����,特別是塑料材料的通用名稱����,每個(gè)都涵蓋了一系列產(chǎn)品��,不僅主要成分的特性不同,而且使用的添加劑也各不相同�����。材料的測(cè)試方法和限值取決于配方�����,因此僅適用于規(guī)格序言中涵蓋其配方的材料��。使用具有不同配方的材料�����,以及適用于它們的測(cè)試方法和限制�����,須經(jīng)主管當(dāng)局同意��。
37����、各論標(biāo)題為英文和法文,并有拉丁文副標(biāo)題�����。
38、相對(duì)原子質(zhì)量(Ar)或相對(duì)分子質(zhì)量(Mr)在每個(gè)各論的開(kāi)頭適當(dāng)?shù)仫@示��。相對(duì)原子和分子質(zhì)量以及分子式不構(gòu)成所述物質(zhì)的分析標(biāo)準(zhǔn)�����。
39��、在適用的情況下��,各論中包括了CAS登記號(hào)��,以便用戶方便地獲取有用的信息�����。
40����、“Definition”標(biāo)題下的陳述構(gòu)成各論內(nèi)容中的活性物質(zhì)��、制劑或其他產(chǎn)品的官方定義�����。
41、在規(guī)定含量限度的情況下�����,它們是由含量測(cè)定項(xiàng)中描述的方法確定的�����。
42�����、在“Characters”標(biāo)題下的陳述內(nèi)容不需要從嚴(yán)格意義上解釋��,也不是要求��。
43�����、在特性部分中的溶解度聲明中��,使用的術(shù)語(yǔ)具有以下含義:
術(shù)語(yǔ)“partly soluble”用于描述只有部分組分溶解的混合物����。
術(shù)語(yǔ)“miscible”用于描述與所述溶劑按所有比例混溶的液體����。
44����、“Identification”部分中給出的測(cè)試并非旨在全面確認(rèn)產(chǎn)品的化學(xué)結(jié)構(gòu)或成分;它們旨在以可接受的保證程度確認(rèn)物品符合標(biāo)簽上的描述����。
45、 某些各論中有有標(biāo)題為“第一鑒別”和“第二鑒別”的細(xì)分����。構(gòu)成“第一鑒別”的一個(gè)或多個(gè)測(cè)試可用于所有情況。構(gòu)成“第二鑒定”的一個(gè)或多個(gè)測(cè)試可以在藥房使用����,前提是可以證明該物質(zhì)或制劑完全可追溯到經(jīng)認(rèn)證符合各論所有其他要求的批次。
46����、某些各論為第一次鑒別的目的提供了兩套或多套測(cè)試����,這些測(cè)試是等效的�����,可以獨(dú)立使用��。這些集合中的一個(gè)或多個(gè)通常包含對(duì)各論“Test”部分中規(guī)定的測(cè)試的交叉引用����。它可用于簡(jiǎn)化執(zhí)行鑒別和規(guī)定測(cè)試的分析人員的工作�����。例如�����,一個(gè)鑒別集中交叉引用了對(duì)映體純度測(cè)試����,而另一個(gè)鑒別集給出特定旋光度的測(cè)試:兩者的預(yù)期目的是相同的,即驗(yàn)證是否存在正確的對(duì)映異構(gòu)體��。
47����、“Test and Assays”的要求中沒(méi)有考慮到所有可能的雜質(zhì)����。如果常識(shí)和良好制藥規(guī)范中要求不能存在的雜質(zhì)不能被描述的方法檢測(cè)到��,那么我們不能推斷它是可以接受的����。
48、如果需要在干燥或無(wú)水物或一些其他指定的基礎(chǔ)上計(jì)算測(cè)試或含量測(cè)定的結(jié)果�����,則應(yīng)通過(guò)各論中相關(guān)測(cè)試的方法測(cè)定干燥失重��,水分或其他特性�����。同時(shí)“dried substance”或“anhydrous substance”等字樣出現(xiàn)在結(jié)果后面的括號(hào)中��。
49�����、如果對(duì)殘留溶劑進(jìn)行了定量測(cè)定�����,但未進(jìn)行干燥失重測(cè)試����,則在計(jì)算活性物質(zhì)的含量�����,比旋度和旋光度時(shí)應(yīng)考慮殘留溶劑的含量�����。
50��、規(guī)定的限值是基于在正常分析實(shí)踐中獲得的數(shù)據(jù)����。它們考慮了正常的分析誤差、制造和組合的可接受變化以及可接受的劣化程度��。對(duì)于確定被檢查產(chǎn)品是否符合各論要求的規(guī)定時(shí)不得再增加允許誤差��。
51、在確定是否符合數(shù)值限值時(shí)��,除非另有規(guī)定����,否則測(cè)試或含量測(cè)定的計(jì)算結(jié)果首先修約到所述有效數(shù)字的數(shù)量。無(wú)論限度值是表示為百分比還是絕對(duì)值�����,都認(rèn)為顯示的最后一位數(shù)字是有效數(shù)字(例如��,140 表示 3 個(gè)有效數(shù)字)�����。修約方式采用四舍五入的方法����。
52、有關(guān)物質(zhì)的驗(yàn)收標(biāo)準(zhǔn)在各論中以峰面積比較(比較測(cè)試)或數(shù)值表示��。對(duì)于比較測(cè)試�����,可以在括號(hào)中標(biāo)明容許雜質(zhì)的大致含量或雜質(zhì)的總和,僅供參考��。接受或拒絕是根據(jù)是否符合所述測(cè)試來(lái)確定的����。如未規(guī)定使用對(duì)照品作為指定雜質(zhì)����,該含量可表示為各論中規(guī)定的用于制備對(duì)照品溶液的活性物質(zhì)的標(biāo)稱濃度,除非另有說(shuō)明�����。
53��、在“Storage”標(biāo)題下提供的信息和建議不構(gòu)成藥典要求��,但主管當(dāng)局可以具體說(shuō)明必須滿足的特定儲(chǔ)存條件��。
54��、藥典中描述的物品的儲(chǔ)存方式可以防止污染����,并盡可能防止變質(zhì)��。如果建議特殊儲(chǔ)存條件�����,包括容器類型和溫度限制,則在各論中說(shuō)明����。 在各論中,使用了以下表達(dá)式�����,其含義如下所示��。
“In an airtight container ”表示產(chǎn)品儲(chǔ)存在密封容器中�����。在潮濕的環(huán)境中打開(kāi)容器時(shí)要小心��。如有必要����,可以通過(guò)在容器中使用干燥劑來(lái)保持低水分含量,前提是避免與產(chǎn)品直接接觸��。
“Protected from light” 指產(chǎn)品儲(chǔ)存在由充分吸收光化光的材料制成的容器中�����,以保護(hù)內(nèi)容物免受此類光引起的變化����,或儲(chǔ)存在封閉在提供此類保護(hù)的外殼中的容器中,或儲(chǔ)存在排除所有此類光的地方����。
55、通常��,藥品標(biāo)簽受國(guó)家條例以及國(guó)際協(xié)定的約束�����。因此�����,標(biāo)簽標(biāo)題下的陳述并不全面����,此外,就藥典而言��,只有那些證明符合或不符合各論所必需的陳述才是強(qiáng)制性的�����。任何其他標(biāo)簽聲明都作為建議包括在內(nèi)��。當(dāng)藥典中使用“標(biāo)簽”一詞時(shí)����,標(biāo)簽聲明可能出現(xiàn)在容器、包裝����、包裝隨附的傳單或物品隨附的分析證書(shū)上,由主管當(dāng)局決定�����。
56、除非采取適當(dāng)?shù)念A(yù)防措施����,否則藥典中各論指定使用的和試劑中描述的材料可能對(duì)健康有害。應(yīng)始終遵守良好質(zhì)量控制實(shí)驗(yàn)室規(guī)范的原則和任何適當(dāng)法規(guī)的規(guī)定�����。通過(guò)警告聲明提請(qǐng)注意某些各論中的特定危害����,與此同時(shí)沒(méi)有這種聲明并不意味著不存在危險(xiǎn)。
57��、關(guān)于輔料的各論中可能有關(guān)于功能相關(guān)特征的部分��。這些特性����、任何測(cè)定的測(cè)試方法和公差都不是強(qiáng)制性要求����;然而,它們可能與輔料的使用有關(guān)����,并僅供參考�����。
58����、某些各論需要使用參考標(biāo)準(zhǔn)品(化學(xué)參考物質(zhì)��、草藥參考標(biāo)準(zhǔn)品�����、生物參考制劑��、參考光譜)����。歐洲藥典委員會(huì)制定了官方參考標(biāo)準(zhǔn),這些標(biāo)準(zhǔn)在仲裁的情況下是唯一權(quán)威的�����。這些參考標(biāo)準(zhǔn)可從歐洲藥品和醫(yī)療保健質(zhì)量理事會(huì)(EDQM)獲得�����。有關(guān)可用標(biāo)準(zhǔn)品和批次有效性聲明的信息可通過(guò)EDQM網(wǎng)站獲得。