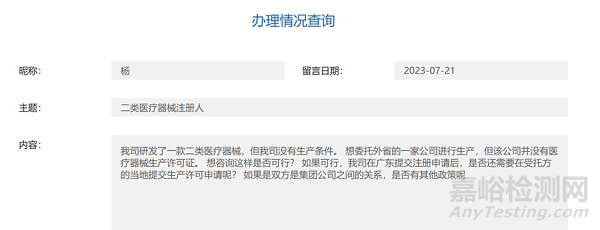
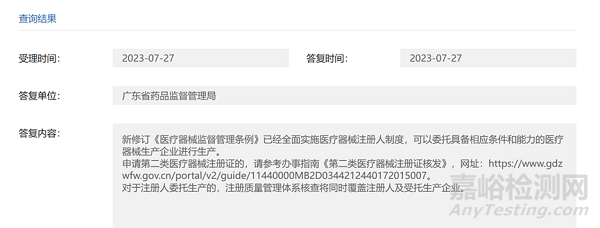
在廣東省藥監(jiān)局網(wǎng)站我們關(guān)注到一個關(guān)于二類醫(yī)療器械注冊人的咨詢問答,內(nèi)容如下:
對于這個問答我們來簡單解析一下�,首先,醫(yī)療器械注冊人委托生產(chǎn)是否可以委托一家沒有醫(yī)療器械生產(chǎn)許可證的企業(yè)�����?其次���,如果可以委托生產(chǎn)���,受托企業(yè)如何取得生產(chǎn)許可證?最后�,如果委托/受托企業(yè)雙方是集團公司之間的關(guān)系,是否有其他方面的政策?以上是企業(yè)關(guān)注的問題重點�,相信也是很多企業(yè)存在疑問的地方。
通過廣東省的回復(fù)可知�,醫(yī)療器械注冊人委托生產(chǎn)可以委托一家沒有醫(yī)療器械生產(chǎn)許可證的企業(yè)進行生產(chǎn),在產(chǎn)品注冊過程中�����,通過注冊質(zhì)量管理體系核查將同時覆蓋注冊人及受托生產(chǎn)企業(yè)���,注冊質(zhì)量管理體系核查和產(chǎn)品技術(shù)審評都通過以后���,醫(yī)療器械注冊人取得含有委托生產(chǎn)地址的注冊證,受托企業(yè)可憑注冊證辦理生產(chǎn)許可證�����。
其實�����,醫(yī)療器械注冊人制度的實施給醫(yī)療器械研發(fā)生產(chǎn)企業(yè)都帶來了非常大的好處�����。
醫(yī)療器械注冊人制度將醫(yī)療器械注冊證和生產(chǎn)許可證進行剝離,解綁了醫(yī)療器械注冊和生產(chǎn)�����,有利于優(yōu)化資源配置���。醫(yī)療器械研發(fā)主體可以更聚焦于研發(fā)方面�,將更多要素配置在創(chuàng)新型產(chǎn)品的設(shè)計上和攻克技術(shù)瓶頸方面�;醫(yī)療器械生產(chǎn)主體可以更關(guān)注如何提高產(chǎn)品質(zhì)量,將更多資源投入到優(yōu)化生產(chǎn)流程中���,注重產(chǎn)品質(zhì)控,有助于提高生產(chǎn)線利用效率降低了相關(guān)主體的成本�����,縮短產(chǎn)品上市周期�。研發(fā)主體將生產(chǎn)外包后,可節(jié)約生產(chǎn)設(shè)備�、廠房、質(zhì)量體系運營等費用�����,避免了資金浪費和設(shè)備閑置等問題;生產(chǎn)主體承接產(chǎn)品生產(chǎn)�����,可提高生產(chǎn)線利用效率�。
如何更好地利用醫(yī)療器械注冊人制度來實現(xiàn)醫(yī)療器械生產(chǎn)企業(yè)的資源整合呢,對于集團性的企業(yè)�����,這種資源優(yōu)化更加明顯突出�����,通過注冊人制度使企業(yè)效益得以最大化�����??傊a(chǎn)企業(yè)可以按需求資源分配�����,建立專業(yè)的生產(chǎn)基地和實驗室�,降低醫(yī)療器械生產(chǎn)成本及企業(yè)投入�。
但是���,隨著醫(yī)療器械注冊人制度的實施和發(fā)展�����,除了帶來一系列的好處以外�,同時也給醫(yī)療器械監(jiān)管帶了新的管理風險和挑戰(zhàn)�。
醫(yī)療器械注冊人企業(yè)不僅要管理企業(yè)內(nèi)部,還要監(jiān)控受托生產(chǎn)企業(yè)的質(zhì)量管理體系和生產(chǎn)情況�,定期對受托生產(chǎn)企業(yè)的質(zhì)量管理體系進行評估、審核和監(jiān)督�。雙方需要簽訂委托協(xié)議,確保受托生產(chǎn)企業(yè)按照法律法規(guī)���、醫(yī)療器械生產(chǎn)質(zhì)量管理規(guī)范、強制性標準�����、產(chǎn)品技術(shù)要求組織生產(chǎn)�����。雙方企業(yè)建立有效的溝通機制,任何設(shè)計變更���、采購變更等均應(yīng)當及時通知受托生產(chǎn)企業(yè)并監(jiān)督執(zhí)行���。
醫(yī)療器械注冊人跨地域監(jiān)管的風險,新修訂《醫(yī)療器械監(jiān)督管理條例》已經(jīng)全面實施醫(yī)療器械注冊人制度���,可以委托具備相應(yīng)條件和能力的醫(yī)療器械生產(chǎn)企業(yè)進行生產(chǎn)�����。醫(yī)療器械申請人可以委托本地企業(yè)生產(chǎn)���,也可以委托外地的企業(yè)生產(chǎn),對于醫(yī)療器械監(jiān)管部門���,需要同時監(jiān)管委托生產(chǎn)企業(yè)和受托生產(chǎn)企業(yè)�����。
醫(yī)療器械注冊人應(yīng)加強產(chǎn)品質(zhì)量管理���,醫(yī)療器械注冊人應(yīng)定期對受托生產(chǎn)企業(yè)生產(chǎn)的產(chǎn)品進行確認或檢驗�,以保障對醫(yī)療器械產(chǎn)品的質(zhì)量控制�����,保障上市放行的產(chǎn)品符合要求���。注冊申請人應(yīng)建立產(chǎn)品放行審核和批準程序���,并確保雙方按照各自的職責放行上市產(chǎn)品。受托生產(chǎn)企業(yè)應(yīng)制定生產(chǎn)放行審核程序�,應(yīng)當保證受托生產(chǎn)產(chǎn)品符合申請人的驗收標準并保留放行記錄。雙方與產(chǎn)品生產(chǎn)相關(guān)的所有記錄必須真實���、準確�、完整并可追溯�����。
總結(jié)�����,新修訂《醫(yī)療器械監(jiān)督管理條例》已經(jīng)全面實施醫(yī)療器械注冊人制度�����,對于醫(yī)療器械注冊人制度���,作為醫(yī)療器械注冊人委托受托雙方應(yīng)通力協(xié)作���,特別關(guān)注醫(yī)療器械質(zhì)量管理體系,建立有效的溝通機制���,確保設(shè)計開發(fā)���、文件、原材料變更及時獲知并監(jiān)督執(zhí)行�����,從而有效地保障醫(yī)療器械產(chǎn)品滿足要求�����。