A:制劑所含有的雜質種類都有什么�?
B:制劑中的雜質統(tǒng)稱為降解產物,包括原料藥的降解產物����、原料藥與賦形劑或包裝容器的反應產物。不包括存在于新原料藥中的雜質��,除非它們也屬于降解產物��;不包括從新藥制劑的賦形劑或從包裝容器滲出產生的雜質��;不包括生物及生物制品�、縮肽��、寡聚核苷酸�、放射性藥物、發(fā)酵制品及其半合成品�、草藥和來源于動植物的粗制品����;另外也不包括外源性污染物�、多晶型和對映體雜質�。
A:雜質研究是藥品質量研究的重要內容,在藥品研發(fā)的過程中��,如何合理地報告和控制降解產物�?
B:關于降解產物報告和控制的合理性部分����,有以下幾個要點:申報者應對新藥制劑的生產和(或)穩(wěn)定性考察中所發(fā)現的降解產物進行綜述�。該綜述應包括對制劑中可能的降解途徑和因與賦形劑和(或)包裝容器反應所產生雜質的科學評價�。對新藥制劑降解產物檢測的所有實驗室研究工作進行總結,包括研發(fā)過程中生產的批次和采用擬上市工藝生產批次的試驗結果�,并對比和討論這兩者批次的雜質概況,存在的任何差異都應進行討論�。應對不屬于降解產物的雜質(如來自于原料藥的工藝雜質和由賦形劑產生的雜質)進行說明��。穩(wěn)定性考察中發(fā)現的任何降解產物����,如果大于鑒定限度時��,則應對其作結構確證��。若無法確證某一降解產物結構時,也應在申報資料中說明實驗室對鑒定該物質已作過的所有研究工作��。對不大于限度的降解產物通常不需要確證其結構����。但是,對于那些可能有不尋常功效或產生毒性藥理作用的降解產物����,即使不大于鑒定限度�,仍應建立分析方法。
A:對于各批次產品降解產物報告����,在內容上有什么具體要求?
B:這部分的要求主要有以下幾點:申報資料中應提交用于臨床�、安全性��、穩(wěn)定性試驗的所有相關批次以及采用擬上市工藝生產的有代表性批次的新藥制劑的分析結果;定量測定結果應數字化��,不應使用類似“符合規(guī)定”“符合限度”等一般性術語��;應報告新藥制劑相關批次中檢測到的任何大于報告限度的降解產物以及總的降解產物�,并附所用分析方法����;d若降解產物含量小于1.0%時,結果報告至小數點后兩位(如0.06%)��;大于等于1.0%時����,應報告至小數點后一位(如:1.3%)����;降解產物應用編號或適當的描述表示(如保留時間“雜質RRT=0.37”)�;所有大于報告限度的降解產物都應進行累加并以“總雜質”報告;申報資料中應提供代表性樣品批次的有標記峰的色譜圖(或采用其他方法獲得的相關數據)��,包括在分析方法驗證中和長期�、加速穩(wěn)定性研究中所得到的色譜圖。申報者應能確保����,如管理部門需要,可提供每個批次的完整降解產物概況(如色譜圖)��;申報資料中應提供每一批次新藥制劑的詳細信息�,具體內容如下:批號��、規(guī)格和批量��、生產日期�、生產地點�、生產工藝、直接接觸的包裝容器�、降解產物的含量,單個的和總量��、批次的用途(如臨床研究�、穩(wěn)定性研究)�、分析方法所用的對照品、用于該制劑的原料批號�、穩(wěn)定性研究的放置條件��。
A:對于降解產物的分析方法�,有沒有方法學驗證的要求或者其他要求�?
B:首先分析方法應按照ICHQ2進行驗證并適用于降解產物的定性和定量檢測����,尤為重要的是,應能證明分析方法具有檢測特定或非特定降解產物的專屬性�。必要時����,還應包括對放置在相對強烈條件(光、熱����、濕、酸/堿和氧化)下的樣品所進行的分析方法驗證�。當分析方法揭示除降解產物以外還存在其他色譜峰(如原料藥����,原料藥合成時引入的雜質,賦形劑和由賦形劑產生的雜質)����,這些峰需在色譜圖中進行標注�,在驗證文件中應探討他們的來源��;其次����,分析方法的定量限應不大于報告限度�;最后,降解產物的量可以用一系列的技術手段測定(如內標法��、主成分自身對照法����、加校正因子的主成分自身對照法等)��。
A:新藥制劑的質量標準中�,對于降解產物的檢查項目有什么要求?
B:新藥制劑的質量標準中應包括在上市產品生產和推薦的貯藏條件下預期會出現的降解產物檢查項目��。穩(wěn)定性研究��、降解途徑的了解��、產品開發(fā)研究以及實驗室研究都可用來確定降解的概況��。有以下幾點要求:新藥制劑質量標準中列入的降解產物檢查項����,應根據擬上市工藝生產的批次中發(fā)現的降解產物來確定��。應對在安全性研究��、臨床研究和穩(wěn)定性研究中觀察到的降解產物狀況����、并結合擬上市工藝生產的產品批次中降解產物的狀況兩者綜合進行討論,再對質量標準中列入和不列入哪些降解產物的理由進行說明�;指導原則中有引入一個“特定降解產物”概念��,特定降解產物是指列入新藥制劑質量標準中有特定限度要求的各個降解產物����。特定降解產物可以是結構已確證和未確證的;質量標準中應包含特定的已鑒定的降解產物和估計含量大于鑒定限度的特定結構未鑒定降解產物����;特定的未鑒定降解產物應用適當的方法來標示,如:“未鑒定雜質A”“相對保留時間為0.9的雜質”����;對于被認為具有特殊功能或產生藥理毒性或未預料到的藥理作用的降解產物,其分析方法的定量限/檢測限必須與降解產物被控制的量相當��;對于任何一個非特定的降解產物應有一個不大于鑒定限度的認可標準��,對總降解產物也應建立一個認可標準�;對于指定的降解產物�,制訂其認可標準時,應考慮其在原料藥中的認可標準(如有的話)��,它的通常含量以及它在穩(wěn)定性研究中建議的有效期和推薦的貯存條件下的增加量����。當然,認可標準的設定不得高于該降解產物經界定的安全含量�。簡要概括��,新藥制劑質量標準中應包括以下降解產物的檢查項:每種特定的��、已鑒定降解產物;每種特定的未鑒定降解產物����;任何不大于鑒定限度認可標準的非特定降解產物;降解產物總量����。
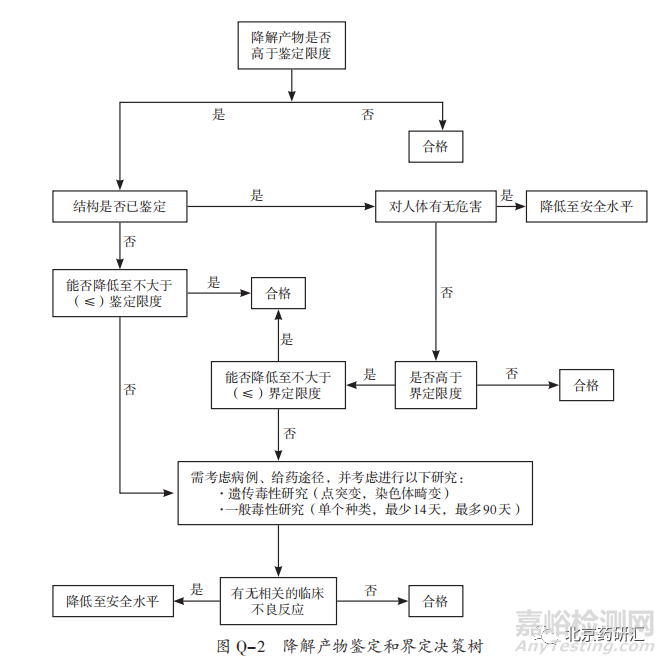
A:降解產物的界定是什么意思?
B:首先引入雜質的界定概念�。雜質的界定是獲得和評價某些數據的過程,這些數據可用于確保單個雜質或在特定含量下的一系列雜質的生物安全性�。對于一個通過充分的安全性研究和臨床研究的新藥制劑,其中任何一個降解產物的水平即被認為是已經通過了界定的��。對于是動物和(或)人體中重要代謝物的降解產物����,通常也視為已通過界定����。如果建立的認可標準超過界定限度,而所獲得的試驗數據不能用來證明降解產物的認可標準限度是合理的����,則必須進行進一步研究。也可以利用降解產物鑒定和界定的決策樹來進行判斷�,這個決策樹在上個章節(jié)Q3A新型原料藥中的雜質問題中已有講解。