膜是器官芯片(OOC)平臺的基本元素�,因為它們?yōu)橘N壁細(xì)胞提供支持�,允許營養(yǎng)物質(zhì)(和其他相關(guān)分子)通過膜孔滲透/交換,并實現(xiàn)機(jī)械或化學(xué)刺激的傳遞��。通過OOC平臺�����,生理過程可以在體外研究����,而OOC膜拓寬了機(jī)械和化學(xué)線索如何影響細(xì)胞和器官的知識。帶膜的OOC是體外微流控模型���,用于各種應(yīng)用如藥物研發(fā)和疾病建模,或用于替代動物試驗����。
來自墨西哥蒙特雷理工學(xué)院的Sergio O. Martínez-Chapa、Mohammad Mahdi Aeinehvand綜述了OOCs與膜的相關(guān)性���,以及它們在不同器官模型中的支架和驅(qū)動作用��、性質(zhì)(物理和材料)和制造方法。相關(guān)論文“Polymeric and biological membranes for organ-on-a-chip devices”于2023年8月29日發(fā)表于雜志《Microsystems & Nanoengineering》上���。
首先描述了液體流動和循環(huán)應(yīng)變的機(jī)械刺激,以及它們對細(xì)胞產(chǎn)生的生理相關(guān)性(IPR)的影響�����;
其次���,還包括合成和ECM(細(xì)胞外基質(zhì))蛋白膜的制備方法�����、它們的特性(例如,厚度和孔隙率可以根據(jù)應(yīng)用進(jìn)行調(diào)整)�����,以及用于其涂層的生物材料���;
最后���,討論并描述了膜在不同研究目的中的作用及其優(yōu)勢和挑戰(zhàn)。
1. 提高細(xì)胞生理相關(guān)性的相關(guān)力學(xué)條件
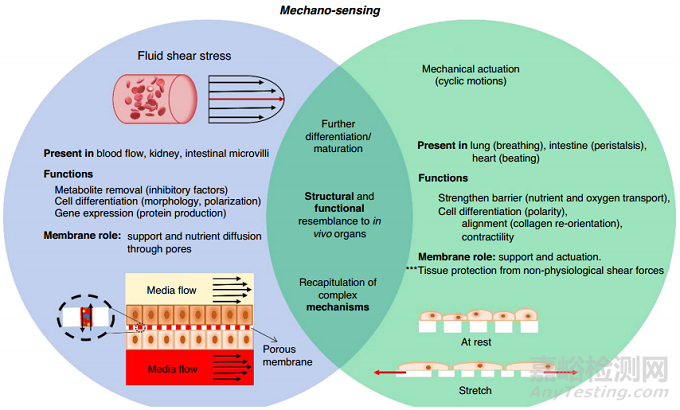
剪切力以及化學(xué)和機(jī)械信號不僅對細(xì)胞存活至關(guān)重要�����,而且還影響細(xì)胞活動��,如細(xì)胞遷移�����、通過離子通道的質(zhì)量傳輸和蛋白質(zhì)構(gòu)象變化��。如圖1所示��,OOCs中生理流動和機(jī)械應(yīng)力的實現(xiàn)和組合對于闡明細(xì)胞相互作用及其對微環(huán)境的反應(yīng)至關(guān)重要,這與病理學(xué)研究越來越相關(guān)����,因為更現(xiàn)實的生理環(huán)境(例如,全血灌流)能夠?qū)崿F(xiàn)更多的生理反應(yīng)(例如����,患者來源的細(xì)胞培養(yǎng))。在以上方面�����,OOC上的膜作為支撐物��、屏障或減震器間接調(diào)節(jié)細(xì)胞暴露于外力(剪切力���、流體流動、機(jī)械刺激)��。這一部分綜述了聚合物膜對OOCs的研究���,其中討論了流體切應(yīng)力和機(jī)械驅(qū)動在不同組織培養(yǎng)中的影響。
圖1 膜介導(dǎo)細(xì)胞在流體剪切應(yīng)力和機(jī)械驅(qū)動下的機(jī)械感應(yīng)
(1)OOCs中的流體剪切應(yīng)力
流體剪切應(yīng)力(FSS)通過血液流動直接存在于體內(nèi)��,在代謝物去除和觸發(fā)表型變化中發(fā)揮關(guān)鍵作用�。在許多OOC中���,連續(xù)的流體流動會去除代謝物,限制了與細(xì)胞的相互作用和攝取����。盡管不利于藥物暴露研究���,但這一特征導(dǎo)致抑制因子的去除,從而有助于細(xì)胞的生理相關(guān)性(IPR)�、基因表達(dá)和細(xì)胞性能的提高��。反過來�����,細(xì)胞IPR(例如�,通過屏障功能所需的緊密連接)有助于限制成熟細(xì)胞中的物質(zhì)通透性��。多孔膜會影響OOC內(nèi)的液體流動�����。Chung等人的研究基于膜的厚度和孔隙度計算了滲透率和流速分布�����。結(jié)果表明�����,從溶質(zhì)擴(kuò)散、流體流動和電流方面表征組織屏障的滲透性可以指導(dǎo)組織屏障和共培養(yǎng)模型的設(shè)計和評估����。溶質(zhì)通透性是組織屏障緊密性和主動運(yùn)輸速率的指標(biāo)�����,可以通過示蹤分子的通透性來估計�����。另一方面�,流體滲透性表明屏障形成成熟,組織屏障的一般漏性可以通過經(jīng)上皮/經(jīng)內(nèi)皮電阻(TEER)快速評估���。因此�,F(xiàn)SS在OOC內(nèi)創(chuàng)造了一個動態(tài)的微環(huán)境����,與多孔膜等元素相互作用,使細(xì)胞更接近于器官水平的結(jié)構(gòu)和功能�����。
(2)創(chuàng)造一個動態(tài)的環(huán)境來促進(jìn)細(xì)胞的特化
剪應(yīng)力的相關(guān)性可以追溯到它對細(xì)胞機(jī)制的影響,細(xì)胞機(jī)制感知并響應(yīng)外部變化����。例如,腦微血管內(nèi)皮細(xì)胞對FSS(例如����,毛細(xì)血管樣剪應(yīng)力~6dynes/cm2)的反應(yīng)是通過增加細(xì)胞骨架蛋白的產(chǎn)生以及緊密連接和轉(zhuǎn)運(yùn)蛋白來實現(xiàn)的。在腎臟�����,F(xiàn)SS(0.2-5dynes/cm2)有助于F-肌動蛋白的聚合和解聚�,從而影響腎小管的形態(tài)和極化。FSS(0.002-0.03dynes/cm2)影響腸上皮細(xì)胞(如Caco-2細(xì)胞)的微絨毛形成和機(jī)械轉(zhuǎn)導(dǎo)���。
剪切力通過刺激機(jī)械感應(yīng)蛋白F-肌動蛋白和絨毛蛋白����,導(dǎo)致上皮刷狀邊界重組����,這是腸道功能的基礎(chǔ)�����。如圖2a所示���,Caco-2細(xì)胞的緊密連接在中等FSS(0.02dyn/cm2)時形成,但在低FSS(0.002 dyn/cm2)和高FSS(0.03dyn/cm2)時減少���。高水平的FSS增加了空泡化(一種細(xì)胞應(yīng)激指標(biāo)),保護(hù)性粘液的產(chǎn)生���,以及線粒體的活性�����,這是由于對ATP屏障完整性的依賴�����。FSS與細(xì)胞內(nèi)和細(xì)胞外刺激一起影響細(xì)胞特化��,最終使FSS感應(yīng)產(chǎn)生反饋循環(huán)���。
(3)應(yīng)用FSS技術(shù)研究細(xì)胞體外分化機(jī)制
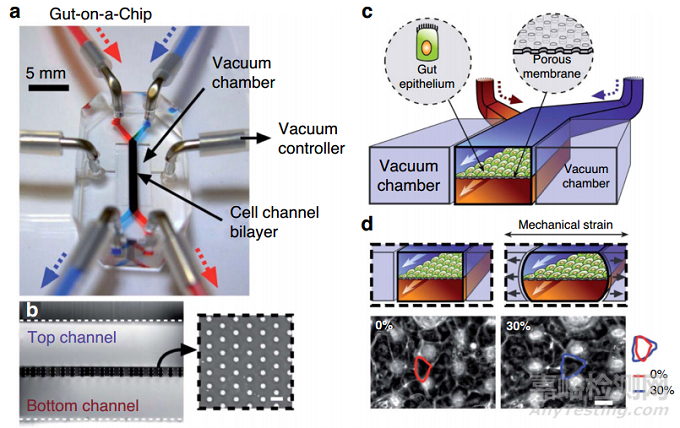
當(dāng)使用OOC時�����,細(xì)胞暴露在FSS中���,通常使用膜來提供支持,并通過毛孔實現(xiàn)營養(yǎng)擴(kuò)散��。Shin等人進(jìn)行了一項研究�����,以闡明基底液和頂部液剪切力對培養(yǎng)在芯片上的腸道上皮細(xì)胞的影響��。研究人員收集了在靜態(tài)Transwell中培養(yǎng)三天的Caco-2細(xì)胞的培養(yǎng)液�����,并將樣本流過芯片上腸管的底腔����,同時保持頂腔上持續(xù)的液體流動,導(dǎo)致培養(yǎng)在芯片上的腸道中的Caco-2細(xì)胞的3D形態(tài)發(fā)生停止����。此外��,作者將一個三周的Caco-2單層膜轉(zhuǎn)移到由有機(jī)硅創(chuàng)建的混合流體設(shè)備中(圖2b�����,c)���,僅對底部腔施加液體流動,在48小時內(nèi)觀察到三維形態(tài)發(fā)生�����。
圖2 微流控裝置中流體流動的相關(guān)性
(4)利用FSS更接近地模擬器官水平的功能
在這些研究中�����,模擬了多層器官�,并通過同時接觸流體或FSS使膜兩側(cè)的細(xì)胞層分化��。在OOCs中���,細(xì)胞暴露于外部機(jī)械信號�����,如FSS和應(yīng)力/應(yīng)變�,可以被調(diào)節(jié)以產(chǎn)生不同的特化特征,而膜可以使小室和細(xì)胞層之間的通信并提供支持����,進(jìn)一步培育動態(tài)的封閉微環(huán)境。
2. 膜機(jī)械驅(qū)動
通過循環(huán)運(yùn)動對膜的機(jī)械刺激在生理上與經(jīng)歷呼吸的肺細(xì)胞�����、經(jīng)歷蠕動運(yùn)動的腸細(xì)胞或跳動的心臟細(xì)胞有關(guān)�����。機(jī)械刺激通常是通過膜兩側(cè)的一對側(cè)室的真空吸(圖3)或通過電產(chǎn)生的負(fù)壓來實現(xiàn)的����。
圖3 OOC機(jī)械驅(qū)動
機(jī)械驅(qū)動也被證明影響細(xì)胞排列,這可能是由應(yīng)變避免機(jī)制或存在或不存在約束邊界條件(拉伸或約束)驅(qū)動的���。在內(nèi)皮細(xì)胞�����、成纖維細(xì)胞��、間充質(zhì)干細(xì)胞和成骨細(xì)胞中均存在應(yīng)變避免或垂直于施加的循環(huán)拉伸的方向�����。最后����,除了支持和驅(qū)動外,OOC中的膜還可以保護(hù)組織免受非生理性剪切力的不利影響�。例如,當(dāng)使用離心將hiPSC(人類誘導(dǎo)多能干細(xì)胞)衍生的心肌細(xì)胞裝入芯片時���,膜限制了介質(zhì)模塊中的對流運(yùn)輸����,而位于組織腔室的細(xì)胞保持活力和功能�。
OOC中的FSS和機(jī)械驅(qū)動
復(fù)雜的機(jī)械條件�,如FSS和機(jī)械刺激的結(jié)合,導(dǎo)致器官水平的結(jié)構(gòu)和功能的產(chǎn)生��,更接近于在體內(nèi)觀察到的結(jié)構(gòu)和功能��,從而允許重述復(fù)雜的機(jī)制��。另一個例子是血管,由于跨壁壓力和血液流動摩擦產(chǎn)生的壁切應(yīng)力��,血管在體內(nèi)經(jīng)歷周期性應(yīng)變�。跨壁壓力導(dǎo)致血管壁擴(kuò)張(向各個方向變形)并改變剪應(yīng)力���,而剪應(yīng)力在血流方向上起作用���,這兩種力量都能誘導(dǎo)內(nèi)皮細(xì)胞發(fā)芽并增加屏障功能。
3. 膜特性
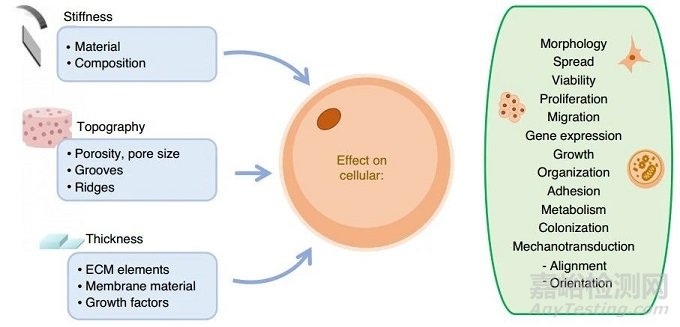
細(xì)胞可以感知環(huán)境的變化�����,包括影響其黏附����、形態(tài)、生長���、交流和遷移過程的機(jī)械和化學(xué)變化/線索���。要實現(xiàn)這種靈敏度,必須精確控制膜的特性,如硬度�。硬度可以通過成分變化、表面形貌和厚度來調(diào)整�����,這可以通過微米和納米軟化來實現(xiàn)���。用于開發(fā)用作細(xì)胞培養(yǎng)支架的膜的主要參數(shù)如圖4所示�����。
圖4 膜的特性可以調(diào)整來模擬體內(nèi)表面和促進(jìn)細(xì)胞特化
(1)硬度
基底硬度產(chǎn)生與ECM和粘附蛋白相關(guān)的不同基因表達(dá)模式�,從而影響細(xì)胞活性�����。例如�,當(dāng)在堅硬的表面上培養(yǎng)時,人間充質(zhì)干細(xì)胞(hMSCs)更容易擴(kuò)散����,表現(xiàn)出更穩(wěn)定的局灶粘附�,并表現(xiàn)出更快的遷移和更高的增殖率。模擬大腦的軟基質(zhì)是神經(jīng)源性的,而更硬的����、類似肌肉的支架是肌源性的,而堅硬的膠原基質(zhì)是成骨性的��。
(2)形貌
膜的形貌特征包括多孔�����,孔狀結(jié)構(gòu)可以促進(jìn)組織的粘附和聚集��。例如���,孔隙度使細(xì)胞遷移并增加表面積��。膜的表面結(jié)構(gòu)可以是凸起或凹陷的��,并根據(jù)幾何形狀或纖維影響接觸引導(dǎo)細(xì)胞����?��?梢酝ㄟ^納米球���、微柱或提供錨點的納米顆粒對表面進(jìn)行修飾�,暴露于FSS的細(xì)胞對具有凹槽形貌的膜表面具有更高的粘附性�����,因為它們與天然ECM相似�����。
(3)厚度
膜厚度影響細(xì)胞通訊���、接觸,甚至影響組織結(jié)構(gòu)�����。商用膜和許多復(fù)制品模制的PDMS膜的厚度約為10μm��,這阻礙了所需的凸起和通過孔的細(xì)胞類型之間的并置���。體內(nèi)肺泡膜厚度為2.2 μm�,胎盤厚度為4.53 μm�����,血管基膜厚度小于100 nm����。
4. 合成聚合物膜的制造
(1)PDMS膜的制備方法
PDMS除了具有高彈性�����、光學(xué)透明性和生物相容性外�����,還具有高機(jī)械穩(wěn)定性�����、低化學(xué)反應(yīng)性和低導(dǎo)熱性��,是一種彈性體和標(biāo)準(zhǔn)材料�����。然而�����,PDMS的組成和固有剛度與天然ECM有很大不同����,影響了細(xì)胞的生長和粘附。此外����,PDMS的疏水性阻礙了生物分子的附著和蛋白質(zhì)的吸附。
PDMS膜是一種多功能且有前途的OOCs元件�����,膜制造技術(shù)的最新發(fā)展為人體生理和疾病的體外研究創(chuàng)造了新的途徑�。然而,傳統(tǒng)的PDMS微流控器件制造技術(shù)���,包括軟光刻技術(shù)���,可能存在諸如高成本和有限的可擴(kuò)展性等缺點。因此�����,為了克服這些限制,正在開發(fā)新的制造技術(shù)��,包括靜電紡絲���、表面改性、增材制造和模板����。
軟光刻技術(shù)
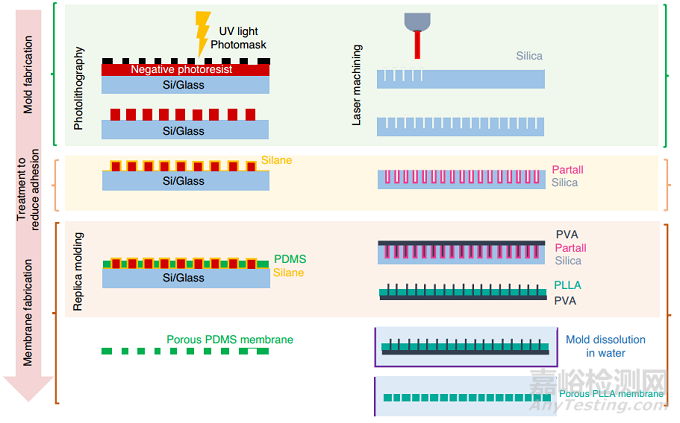
亞微米特征是細(xì)胞培養(yǎng)的關(guān)鍵�����,因為它們允許細(xì)胞間交流和物理接觸���,而薄膜提高生物分子運(yùn)輸和營養(yǎng)物質(zhì)轉(zhuǎn)移率。由于傳統(tǒng)光刻的衍射限制(圖5�����,左)���,很難生產(chǎn)孔徑和厚度小于5 μm的PDMS膜。用于制造硅模具的高分辨率光掩模(<2 μm)是可用的���,但價格昂貴。無掩模激光直寫技術(shù)提供了克服這一限制的替代解決方案��,并提供了關(guān)于微米級圖案設(shè)計和3D幾何的靈活性���。聚乙烯醇(PVA)被用作PDMS結(jié)構(gòu)的犧牲層。Pensabene及其合作者提出了一種制造犧牲PVA納米針的方法��,以制造用于人臍靜脈內(nèi)皮細(xì)胞(HUVEC)培養(yǎng)的聚L -乳酸(PLLA)膜��。該方法使用飛秒激光加工形成具有1 μm直徑孔的硅晶片��,然后涂上稱為Partall®Film #10的水/醇基PVA脫模劑(圖5����,右)����。
圖5 多孔膜的制作過程可分為以下幾個主要步驟:模具制作、減少附著的處理和膜制作
高壓飽和蒸汽形成孔隙
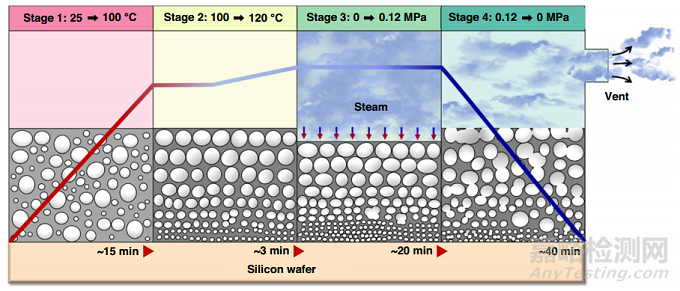
Jang和他的合作者通過高壓滅菌循環(huán)探索了高壓飽和蒸汽的孔隙形成����。該方法結(jié)合溫度�����、壓力和濕度���,產(chǎn)生微米級氣泡�,一旦PDMS固化��,這些氣泡就會變成孔隙(圖6)���。該工藝減少了膜的厚度���,從而增強(qiáng)了膜的物理性能���,增加了楊氏模量�����、粗糙度和透氣性��。
圖6 Jang等(2019)提出的高壓飽和蒸汽法制備多孔PDMS膜
替代方法:3D打印、靜電紡絲等
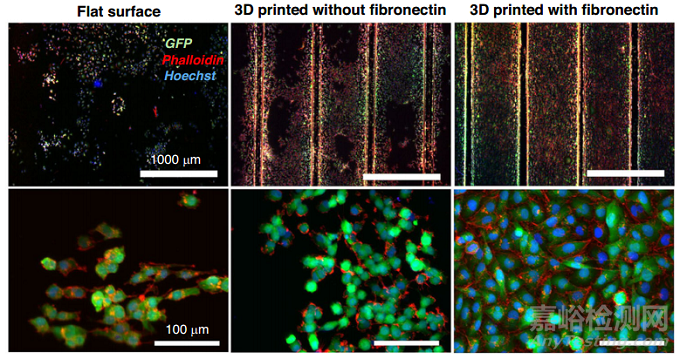
替代技術(shù)包括PDMS 3D打印和使用多孔素(如鹽和糖等可溶解顆粒)和用于微圖案的顆粒(玻璃微球)�����。Ozbolat及其合作者進(jìn)行的一項研究發(fā)現(xiàn),與鑄造樣品相比��,PDMS 3D打印改善了其機(jī)械性能(圖7)���。
圖7 PDMS 3D打印改善了由于表面不均勻而導(dǎo)致的細(xì)胞粘附和擴(kuò)散
(2)蛋白質(zhì)和水凝膠膜涂層
本節(jié)介紹用于增強(qiáng)合成膜生物相容性或促進(jìn)細(xì)胞與底物相互作用的主要生物材料��。重點放在普遍實施和良好表征的生物材料���,如膠原蛋白�����,纖維連接蛋白和水凝膠���。
OOC膜涂層中的蛋白質(zhì)
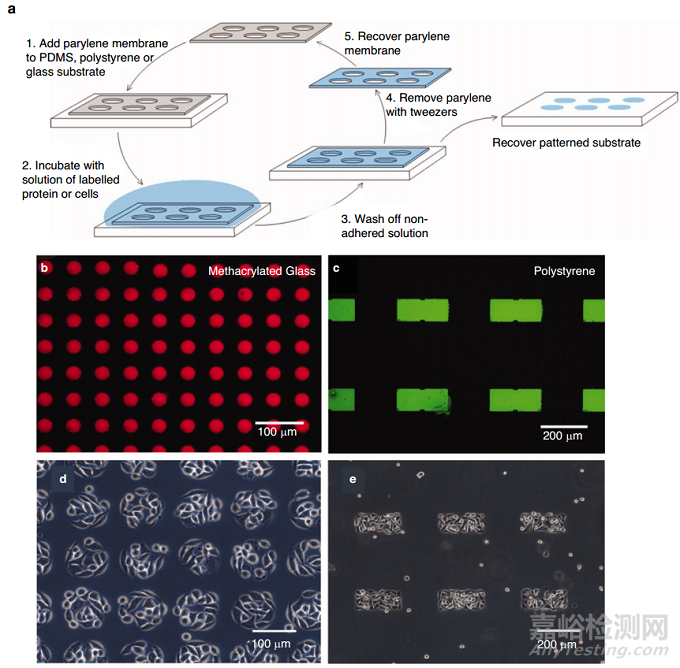
膠原蛋白和纖維連接蛋白是體外模擬細(xì)胞外基質(zhì)的兩種主要蛋白質(zhì)���。Matrigel®是一種基于細(xì)胞外基質(zhì)的鼠源性水凝膠�����,由于其類似于上皮基底膜����,因此是一種廣泛使用的基質(zhì)。蛋白質(zhì)可以作為單層或局部以特定形狀或圖案被覆在膜上����。選擇性轉(zhuǎn)移通過微接觸打印(μCP)或微流體實現(xiàn)�����,并提供細(xì)胞(例如���,心臟組織或肌肉纖維)通過改變方向和排列對其作出反應(yīng)的幾何線索�����。μCP蛋白質(zhì)圖案的大小可以低至0.5μm;然而�,圖案的完整性取決于膜的特征大小和化學(xué)性質(zhì),因為更大的特征和疏水表面呈現(xiàn)更強(qiáng)大的結(jié)合�����。Wright和他的合作者進(jìn)行的一項研究使用可重復(fù)使用的10 μm厚的對二甲苯-C模板在PDMS和聚苯乙烯上實現(xiàn)了纖維連接蛋白圖案(圖8)�。
圖8 蛋白質(zhì)與細(xì)胞構(gòu)型
OOC膜涂層用水凝膠
水凝膠有效地模擬了ECM的化學(xué)成分和機(jī)械性能127��,因此可以生物物理地刺激細(xì)胞分化和排列。水凝膠可以通過光刻和微圖像化����、立體光刻�����、微成型、微流體粘指法和生物打印等方法進(jìn)行微制造�����。刺激響應(yīng)水凝膠可以通過pH值����、溫度���、離子強(qiáng)度和電場或磁場來驅(qū)動或定型。如聚(N-異丙基丙烯酰胺)(PIPAAm)是一種熱響應(yīng)性水凝膠�����,由于其較低的臨界溶液溫度(LCST),它可以開關(guān)其溶解度和聚集性�;海藻酸、殼聚糖和透明質(zhì)酸(HA)等天然水凝膠具有生物相容性���,例如,HA 具有CD44受體,當(dāng)與細(xì)胞結(jié)合時可產(chǎn)生細(xì)胞粘附力���;半合成水凝膠,如甲基丙烯?�;髂z(GelMA)���,含有天然和合成成分。明膠是膠原蛋白水解的產(chǎn)物�����,含有細(xì)胞粘附序列����,如 RGD 和基質(zhì)金屬蛋白酶��,細(xì)胞可通過這些序列粘附�、增殖和擴(kuò)增。
5. 生物ECM蛋白膜
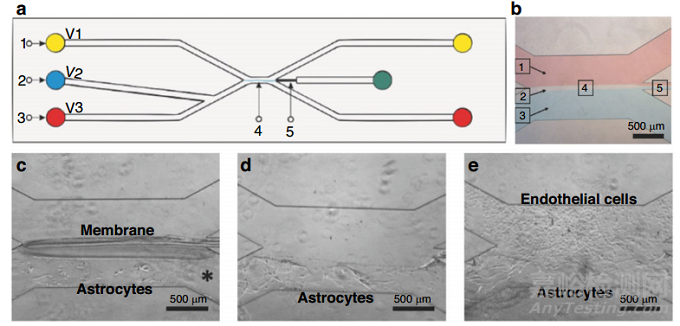
細(xì)胞外基質(zhì)在結(jié)構(gòu)上可分為兩部分�����,一部分是致密多孔的基底膜�����,由膠原蛋白 IV�����、纖連蛋白和層粘連蛋白等蛋白質(zhì)組成���;另一部分是致密的親水性間質(zhì),由蛋白聚糖和纖維狀(I 型)膠原組成��。整合素是一種跨膜蛋白����,可傳遞外部信號并經(jīng)歷構(gòu)象變化。整合素與ECM蛋白(膠原蛋白�����、纖維連接蛋白���、層粘連蛋白)相互作用���,并通過與細(xì)胞骨架的連接影響細(xì)胞形狀。一種實現(xiàn)原位制造的血腦屏障(BBB)芯片利用微流體實現(xiàn)了臨時殼聚糖膜��,膜作為星形膠質(zhì)細(xì)胞的支撐���,一旦星形膠質(zhì)細(xì)胞培養(yǎng)建立�,去除膜����,與星形膠質(zhì)細(xì)胞直接接觸的內(nèi)皮細(xì)胞共培養(yǎng)(圖9e)。利用殼聚糖的pH響應(yīng)性��,通過界面聚合制備膜��。碳酸鹽(中性�����,pH 7.0)和磷酸鹽(堿性����,pH 9.6)緩沖液在微流控裝置上共流動(圖9b)。殼聚糖膜在緩沖液之間的界面之間形成��,注入碳酸鹽與殼聚糖接觸,碳酸鹽使殼聚糖質(zhì)子化并使其可溶�����。然后�����,殼聚糖接觸堿性磷酸鹽緩沖液時�,通過去質(zhì)子化發(fā)生聚合。在膜的一側(cè)植入星形膠質(zhì)細(xì)胞后���,通過醋酸溶液(pH 5.0)通過質(zhì)子化去除殼聚糖(圖9c, d)����。
圖9 Tibbe等人(2018)原位殼聚糖膜制備
綜上��,OOC中的膜有助于提供與細(xì)胞在體內(nèi)所經(jīng)歷的環(huán)境非常相似的環(huán)境�����,這些環(huán)境涉及機(jī)械因素���,特別是剪切應(yīng)力和機(jī)械拉伸���,或固有的材料特性,如剛度和形貌���。本文綜述了不同膜的主要特性�����、作用和材料���。PDMS是拉伸應(yīng)用和基因表達(dá)研究的首選材料,但通常需要蛋白質(zhì)涂層���,含有蛋白質(zhì)的ECM膜可以長時間支持細(xì)胞生長并誘導(dǎo)更多的生理反應(yīng)�����。最佳的膜應(yīng)該由足夠薄的天然蛋白質(zhì)組成,以使細(xì)胞通信和/或接觸�����,而不犧牲機(jī)械刺激所需的靈活性�����。
文章來源:https://doi.org/10.1038/s41378-023-00579-z