隨著我國藥品監(jiān)管機制的日益成熟�,國內(nèi)制藥企業(yè)的質(zhì)量體系建設(shè)日趨健全,但質(zhì)量管理成熟度與頭部跨國制藥企業(yè)相比仍有差距�。本研究通過梳理美國食品藥品管理局(FDA) 質(zhì)量量度項目、質(zhì)量管理成熟度項目的實施內(nèi)容�,調(diào)研跨國制藥企業(yè)質(zhì)量管理成熟度現(xiàn)狀,比照剖析了我國制藥企業(yè)在質(zhì)量管理過程中藥品質(zhì)量管理成熟度的現(xiàn)狀��,總結(jié)了質(zhì)量績效指標(biāo)策略�、質(zhì)量體系運行有效性����、持續(xù)改進(jìn)質(zhì)量文化建設(shè)等三個方面存在的問題,并提出了通過轉(zhuǎn)變藥品生產(chǎn)監(jiān)管理念��、加強質(zhì)量管理成熟度研究��、借助數(shù)字化手段賦能我國制藥企業(yè)質(zhì)量管理成熟度提升的建議。
2017 年����,國家藥品監(jiān)督管理局成為國際人用藥品注冊技術(shù)協(xié)調(diào)會(ICH) 第八個監(jiān)管機構(gòu)成員單位,標(biāo)志著我國藥品監(jiān)管工作進(jìn)一步與國際接軌��。ICH根據(jù)ISO 質(zhì)量理念����,為醫(yī)藥行業(yè)提供了一套有效的藥品質(zhì)量體系(ICH Q10) 模型�,系統(tǒng)闡述了藥品研發(fā)����、生產(chǎn)全生命周期的質(zhì)量管理模式,并廣泛被跨國制藥企業(yè)持續(xù)執(zhí)行�。調(diào)研顯示,國內(nèi)制藥企業(yè)藥品質(zhì)量管理體系基于ICH Q10 的管理成熟度與頭部跨國制藥企業(yè)仍有差距�,尤其是在持續(xù)有效的質(zhì)量體系運行方面。本研究總結(jié)了美國食品藥品管理局(FDA) 質(zhì)量量度項目、質(zhì)量管理成熟度項目的實施內(nèi)容�,以及跨國制藥企業(yè)質(zhì)量管理成熟度現(xiàn)狀,初步探析我國企業(yè)質(zhì)量體系的管理成熟度現(xiàn)狀����,期望能結(jié)合國際藥品監(jiān)管先進(jìn)理念和跨國制藥企業(yè)質(zhì)量管理經(jīng)驗,借助數(shù)字化手段來指導(dǎo)企業(yè)認(rèn)識和接受ICH Q10 內(nèi)涵�,賦能企業(yè)質(zhì)量管理成熟度邁向更高階段��。
1����、國外制藥企業(yè)質(zhì)量管理成熟度現(xiàn)狀
ICH Q10 鼓勵企業(yè)在藥品全生命周期質(zhì)量體系中����,能運用科學(xué)且基于風(fēng)險的方法實現(xiàn)產(chǎn)品質(zhì)量和體系管理的持續(xù)改進(jìn),即企業(yè)不僅要對工藝性能和產(chǎn)品質(zhì)量進(jìn)行持續(xù)改進(jìn)��,為確定的參數(shù)和屬性提供可衡量和可分析的技術(shù)管理工具��,確保受控狀態(tài)的持續(xù)維持�,也應(yīng)當(dāng)對質(zhì)量體系進(jìn)行持續(xù)改進(jìn),采用科學(xué)的質(zhì)量績效指標(biāo)對質(zhì)量體系過程進(jìn)行有效監(jiān)控����,并定期開展質(zhì)量體系有效性評估[1]����。
1.1美國FDA質(zhì)量量度項目
美國FDA早在2013年就啟動了制藥企業(yè)質(zhì)量量度計劃(quality metrics program)�,期望通過對質(zhì)量量度和質(zhì)量文化的管理促進(jìn)企業(yè)實現(xiàn)藥品質(zhì)量的卓越管理��。美國FDA認(rèn)為�,企業(yè)通過對質(zhì)量管理、質(zhì)量文化的量化指標(biāo)進(jìn)行跟蹤分析�,可以改善整體質(zhì)量體系水平。早期采用這種質(zhì)量管理模式的企業(yè)�,將系統(tǒng)科學(xué)的質(zhì)量指標(biāo)體系融合到企業(yè)良好的業(yè)務(wù)實踐中,既實現(xiàn)了企業(yè)質(zhì)量運營卓越的目標(biāo)����,同時也實現(xiàn)了藥品質(zhì)量的持續(xù)改進(jìn)。FDA也一直在研究基于數(shù)據(jù)的質(zhì)量體系性能指標(biāo)�,以期在發(fā)生質(zhì)量事件之前預(yù)警質(zhì)量風(fēng)險: 一方面有助于制定科學(xué)的合規(guī)性檢查策略,如可基于風(fēng)險數(shù)據(jù)減少對高績效企業(yè)的檢查頻率; 另一方面也有助于政府預(yù)測藥物短缺的風(fēng)險��,引導(dǎo)企業(yè)實施先進(jìn)的藥品質(zhì)量管理體系[2]��。
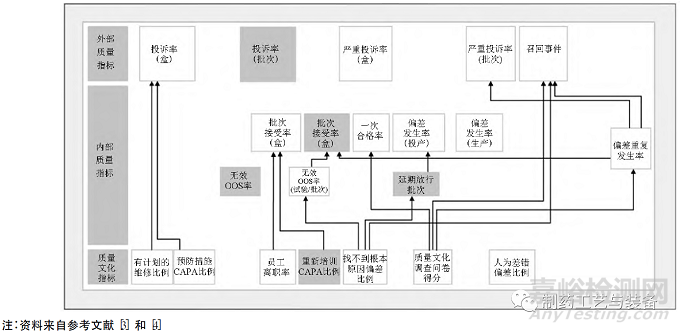
2015—2016 年����,美國FDA委托國際制藥工程協(xié)會(ISPE) 開展了兩期大規(guī)模質(zhì)量量度研究�,以確定表征藥品質(zhì)量體系有效性的指標(biāo)����。ISPE使用調(diào)查問卷收集了數(shù)十家原料藥和制劑工廠數(shù)據(jù),包括基于產(chǎn)品和基于工廠的指標(biāo)�,如投訴率、接受批次率����、無效OOS 率�、CAPA 有效性等。線性回歸分析結(jié)果顯示了大部分指標(biāo)是密切相關(guān)性的��,即表征質(zhì)量文化的一些指標(biāo)�,最終也會反映到質(zhì)量體系各方面性能指標(biāo)和最終的產(chǎn)品質(zhì)量指標(biāo)[3,4]��。美國FDA 質(zhì)量量度計劃指標(biāo)相關(guān)性分析見圖1�。
圖1 美國FDA 質(zhì)量量度計劃指標(biāo)相關(guān)性分析
1.2美國FDA質(zhì)量管理成熟度項目
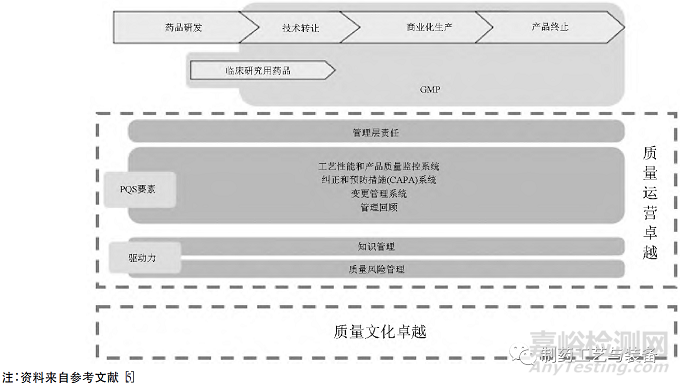
美國FDA在質(zhì)量量度計劃的基礎(chǔ)之上,于2020年下半年啟動了質(zhì)量管理成熟度項目(quality management maturity��,QMM) �。質(zhì)量管理成熟度是為實現(xiàn)質(zhì)量方針和目標(biāo),衡量已經(jīng)建立的質(zhì)量體系各業(yè)務(wù)流程的一致性、可靠性和穩(wěn)健性水平�,關(guān)注企業(yè)對業(yè)務(wù)流程和質(zhì)量體系持續(xù)改進(jìn)方面的表現(xiàn)。FDA認(rèn)為����,在符合cGMP的基礎(chǔ)上形成基于ICH Q10的體系管理模式,于持續(xù)改進(jìn)中達(dá)成質(zhì)量運營卓越����、質(zhì)量文化卓越的狀態(tài),是質(zhì)量管理成熟的必然路徑[5]����。美國FDA 基于ICH Q10的質(zhì)量成熟度模型見圖2。
圖2 美國FDA基于ICH Q10的質(zhì)量成熟度模型
美國FDA藥品質(zhì)量管理成熟度項目不僅停留在藥品全生命周期的質(zhì)量體系縱向維度上��,也在向藥品生產(chǎn)企業(yè)管理的橫向維度拓展����,即引導(dǎo)企業(yè)打開管理思維,確實開展全面質(zhì)量管理(total quality management����,TQM),如生產(chǎn)運營�、人力資源管理�、安全生產(chǎn)��、環(huán)境安全方面均納入成熟度評估[6]��。
1.3跨國制藥企業(yè)質(zhì)量管理成熟度
2019 年����, ISPE和美國注射劑協(xié)會(PDA) 發(fā)布了《制藥企業(yè)質(zhì)量文化提升指南》(以下簡稱《指南》) ?!吨改稀氛J(rèn)為,質(zhì)量文化不足的企業(yè)在調(diào)查質(zhì)量事件根本原因時�,常常以人為差錯為根本原因,僅采取“再培訓(xùn)”的預(yù)防措施來結(jié)束調(diào)查�。《指南》強調(diào)�,“人為差錯”不應(yīng)作為根本原因調(diào)查的結(jié)論��,而應(yīng)作為新的調(diào)查起點����。“再培訓(xùn)”的預(yù)防措施也不太可能獲得長期穩(wěn)定的改善效果����,應(yīng)該對差錯背后的人為因素進(jìn)行更深入的根本原因分析��。ISPE 和PDA 的質(zhì)量文化理念在跨國制藥企業(yè)中得到了充分體現(xiàn),《指南》提及的工具和方法��,也被跨國制藥企業(yè)廣泛應(yīng)用�。以某跨國制藥企業(yè)為例,對人為差錯根本原因的分析��,從差錯事件的注意力因素�、記憶力因素、學(xué)習(xí)因素�、決策因素、資源因素和程序因素等方面進(jìn)行多維度分析�,直至找出根本問題所在,并制定有效的整改措施[7]����。
本研究對多家跨國制藥企業(yè)質(zhì)量體系的有效性進(jìn)行了調(diào)研,結(jié)果顯示這些企業(yè)都具備較為成熟的質(zhì)量體系管理機制��。質(zhì)量量度方面��,具備科學(xué)的����、完整的質(zhì)量管理體系量化指標(biāo)。企業(yè)會定期監(jiān)測和分析質(zhì)量體系運行的有效性��、穩(wěn)定性,異常趨勢常?�?梢栽趩栴}發(fā)生前就為體系持續(xù)改善明確方向; 質(zhì)量文化方面����,企業(yè)將關(guān)鍵質(zhì)量指標(biāo)列入年度績效考核,與其經(jīng)濟指標(biāo)形成了良好的制衡關(guān)系����。企業(yè)以質(zhì)量為驅(qū)動、持續(xù)改善的文化也得到了充分體現(xiàn)����。跨國制藥企業(yè)質(zhì)量與經(jīng)濟績效指標(biāo)體系示例見圖3����、圖4。
圖3 某跨國制藥企業(yè)A 質(zhì)量與經(jīng)濟績效指標(biāo)體系
圖4 某跨國制藥企業(yè)B 質(zhì)量與經(jīng)濟績效指標(biāo)體系
2����、國內(nèi)制藥企業(yè)藥品質(zhì)量管理成熟度現(xiàn)狀
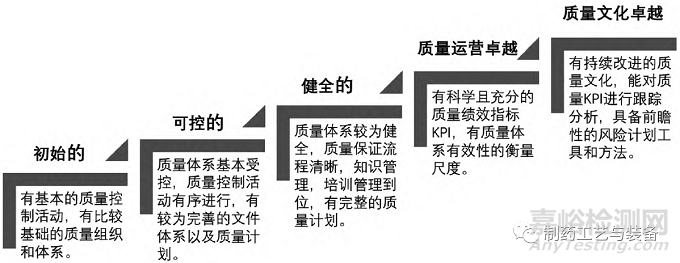
本研究基于ICH Q10�,將國內(nèi)制藥企業(yè)的質(zhì)量管理成熟度分為5 個階段(見圖5) 。企業(yè)申辦《藥品生產(chǎn)許可證》時����,需要具備基本的藥品質(zhì)量體系并接受監(jiān)管部門的法規(guī)符合性檢查�,即第一階段“初始的”; 商業(yè)化規(guī)模生產(chǎn)時��,企業(yè)在《藥品管理法》等強監(jiān)管壓力下主動強化主體責(zé)任以使其體系基本受控��,即第二階段“可控的”; 之后在經(jīng)歷GMP 檢查員數(shù)次合規(guī)檢查后����,企業(yè)的質(zhì)量體系建設(shè)日趨健全,即第三階段“健全的”��。
圖5 基于ICH Q10 的藥品質(zhì)量管理成熟度分級
2019 年12月1日,新修訂的《中華人民共和國藥品管理法》(以下簡稱《藥品管理法》) 生效。此后����,國務(wù)院辦公廳印發(fā)了《關(guān)于建立職業(yè)化專業(yè)化藥品檢查員隊伍的意見》和《關(guān)于全面加強藥品監(jiān)管能力建設(shè)的實施意見》,國家藥品監(jiān)督管理局啟動了國際藥品檢查合作計劃(PIC/S) 的預(yù)加入申請程序[8-10]��。一系列藥品監(jiān)管體制機制的改革和進(jìn)步����,促使國內(nèi)制藥企業(yè)的質(zhì)量體系建設(shè)逐步走向健全,但距離實現(xiàn)質(zhì)量運營卓越和質(zhì)量文化卓越仍有差距。本研究對國內(nèi)制藥企業(yè)的質(zhì)量管理成熟度現(xiàn)狀做了調(diào)研分析����,歸納出三個方面的問題�。
2.1企業(yè)績效管理中質(zhì)量指標(biāo)不夠充分
在國內(nèi)制藥企業(yè)績效管理中����,存在質(zhì)量績效指標(biāo)的科學(xué)性�、系統(tǒng)性不足�,與經(jīng)濟績效指標(biāo)地位不對等情況,難以保證質(zhì)量安全和生產(chǎn)效率的平衡�。例如�,國內(nèi)制藥企業(yè)使用的質(zhì)量核心指標(biāo)大多以“產(chǎn)品合格率”為主��。產(chǎn)品合格率是最終合格產(chǎn)品數(shù)量占所生產(chǎn)產(chǎn)品的比例�,即“良品率”或“收率”�。一定程度上�,該指標(biāo)的內(nèi)在屬性是成本控制而非質(zhì)量控制�。跨國制藥企業(yè)更多關(guān)注“一次合格率(right first time,RFT)”��,即產(chǎn)品生產(chǎn)包裝檢驗全過程無異常的產(chǎn)品數(shù)量占所生產(chǎn)產(chǎn)品的比例�。RFT 更能體現(xiàn)藥品的內(nèi)在質(zhì)量屬性和“質(zhì)量源于設(shè)計(QbD) ”的理念,表征了產(chǎn)品生產(chǎn)工藝和流程的穩(wěn)定性����。通過監(jiān)測和分析影響RFT 指標(biāo)的原因��,更有助于識別體系中存在的系統(tǒng)性風(fēng)險[11, 12]����。
2.2質(zhì)量管理體系的運行有效性需要提升
國內(nèi)制藥企業(yè)質(zhì)量體系運行的有效性仍然有較大提升空間,即“文件堆出來的質(zhì)量體系”現(xiàn)象依然存在����。一方面,國內(nèi)制藥企業(yè)保障質(zhì)量管理體系有效運行的信息化系統(tǒng)支撐不足�,諸如偏差管理、變更管理�、CAPA 管理等業(yè)務(wù)仍處于線下紙質(zhì)流程階段,體系運行的一致性�、及時性����、有效性缺乏保障����。另一方面,國內(nèi)制藥企業(yè)對質(zhì)量績效指標(biāo)的持續(xù)監(jiān)測分析和評價不足��,績效考核的觸角無法有效傳遞到體系的各個運行環(huán)節(jié)��。企業(yè)管理層無法及時����、清晰�、全面地看到本企業(yè)質(zhì)量管理體系的實際運行情況����,以致體系缺陷往往被忽視[13]。
2.3持續(xù)改進(jìn)的質(zhì)量文化建設(shè)需要加強
比照ICH�、ISPE 和PDA 的質(zhì)量文化理念����,國內(nèi)制藥企業(yè)以質(zhì)量為驅(qū)動的企業(yè)文化氛圍仍需加強�。對質(zhì)量事件����,尤其是人為差錯事件的根本原因分析深度和方法不足�,導(dǎo)致基于根本原因的持續(xù)改善機會大大流失。國內(nèi)制藥企業(yè)在進(jìn)行偏差調(diào)查時��,往往最后粗淺地將根本原因落在人為差錯上,僅將“再培訓(xùn)”作為預(yù)防整改措施以結(jié)束調(diào)查��。在藥品生產(chǎn)過程中����,質(zhì)量事件是發(fā)現(xiàn)問題、解決問題和持續(xù)改善的最好機會�,但大多企業(yè)沒有沒有付出時間和精力或者不具備這個能力和意識深挖其根本原因,不能從根本上制定預(yù)防整改措施�,談不上具備持續(xù)改善的質(zhì)量文化[7]。
3��、國內(nèi)外制藥企業(yè)質(zhì)量管理成熟度對我國藥品生產(chǎn)監(jiān)管的啟示
3.1轉(zhuǎn)變藥品生產(chǎn)監(jiān)管理念
《藥品管理法》要求藥品上市許可持有人須具備質(zhì)量管理��、風(fēng)險防控和責(zé)任賠償能力[14]。其中��,質(zhì)量管理能力是作為藥品上市許可持有人的首要能力����。不斷提升質(zhì)量管理能力和體系建設(shè)水平是藥品上市許可持有人落實主體責(zé)任的最直接體現(xiàn)。國內(nèi)已有頭部企業(yè)效仿跨國制藥公司的先進(jìn)質(zhì)量管理理念和實踐經(jīng)驗��,期望于持續(xù)改進(jìn)中實現(xiàn)質(zhì)量運營卓越��、質(zhì)量文化卓越的狀態(tài)�。藥品監(jiān)管部門也需要轉(zhuǎn)變觀念��,藥品監(jiān)管工作不只是提升企業(yè)的法規(guī)符合性和技術(shù)成熟度��,更要鼓勵和指導(dǎo)企業(yè)在質(zhì)量管理工具����、方法上的創(chuàng)新應(yīng)用,以實現(xiàn)制藥企業(yè)最大程度地高效�、敏捷、靈活地生產(chǎn)出質(zhì)量可靠的藥品[15]��。
3.2加強質(zhì)量管理成熟度研究
結(jié)合國際藥品監(jiān)管先進(jìn)理念和跨國制藥企業(yè)質(zhì)量管理經(jīng)驗,研究適用于我國制藥企業(yè)質(zhì)量管理的統(tǒng)一量度或指標(biāo)定義�、算法,指導(dǎo)企業(yè)依據(jù)自身質(zhì)量能力選擇適合的質(zhì)量量度[12]����,在賦能企業(yè)高質(zhì)量發(fā)展的同時,也具有賦能監(jiān)管的直接價值��。一方面幫助企業(yè)建立表征藥品質(zhì)量體系運行有效性的指標(biāo)矩陣��,實現(xiàn)自我管理和持續(xù)改進(jìn)��。另一方面��,通過對企業(yè)質(zhì)量管理運營和文化指標(biāo)的監(jiān)測分析對比�,可以將事中事后監(jiān)管滲透到企業(yè)日常的生產(chǎn)經(jīng)營活動中�,倒逼企業(yè)不斷完善其質(zhì)量管理體系,真正壓實企業(yè)主體責(zé)任����。
3.3智慧監(jiān)管加速質(zhì)量管理成熟
統(tǒng)一的質(zhì)量量度或指標(biāo)最大程度地剝離了產(chǎn)品屬性��,通過信息化手段和算法模型評估企業(yè)藥品質(zhì)量管理水平����,可實現(xiàn)藥品質(zhì)量監(jiān)管從定性管理向基于數(shù)據(jù)的定量管理轉(zhuǎn)變�,也為企業(yè)和產(chǎn)品的橫向比較提供了可能,如同一類劑型生產(chǎn)企業(yè)�、不同企業(yè)生產(chǎn)的同一類產(chǎn)品、同一企業(yè)內(nèi)不同產(chǎn)品����、一段時間內(nèi)企業(yè)的變化趨勢等[16]。同時����,以質(zhì)量管理成熟度為基礎(chǔ)的智慧監(jiān)管平臺,在采集�、分析企業(yè)質(zhì)量量度或指標(biāo)數(shù)據(jù)的同時,也會倒逼企業(yè)加快偏差管理�、變更管理、CAPA 管理等信息化系統(tǒng)建設(shè)[17]�。
4、結(jié)語
《關(guān)于全面加強藥品監(jiān)管能力建設(shè)的實施意見》提出要提升監(jiān)管國際化水平����,加快推進(jìn)監(jiān)管新工具、新標(biāo)準(zhǔn)、新方法研究和應(yīng)用����。目前,國內(nèi)制藥企業(yè)質(zhì)量體系建設(shè)日趨健全��,行業(yè)對質(zhì)量管理進(jìn)一步成熟的期望越來越強烈��。因此����,藥品監(jiān)管部門開展以質(zhì)量量度為基礎(chǔ)的質(zhì)量管理成熟度研究�,將為推動我國醫(yī)藥產(chǎn)業(yè)高質(zhì)量發(fā)展發(fā)揮積極作用。
參考文獻(xiàn)
[1] International Conference on Harmonisation. Guidance on Q10 Pharmaceutical Quality System [EB/OL]. (2009-04-08) [2022-8-17]. https: / /https: / /www. federalregister. gov /documents /2009 /04 /08 /E9-7875 /internationalconference-on-harmonisation-guidance-on-q10-pharmaceutical-qualitysystem-availability.
[2] FDA. Quality Metrics for Drug Manufacturing[EB/OL]. (2022-03-09)[2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources/quality-metrics-drug-manufacturing.
[3] ISPE. Quality metrics initiative: A report from the pilot project-wave1 [EB/OL]. (2015-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-1-report.
[4] ISPE. Quality metrics initiative: Quality metrics pilot program wave 2 [EB/OL]. (2016-06-01) [2022-08-17]. https: / /ispe. org /products /ispe-qualitymetrics-initiative-wave-2-report.
[5] ISPE. Quality Management Maturity Program: Advancing Pharmaceutical Quality[EB/OL]. (2020-10-08) [2022-08-17]. https: / /ispe. org /pharmaceutical-engineering /ispeak /ispe-quality-management-maturity-program-advancing-pharmaceutical.
[6] FDA. CDER Quality Management Maturity[EB/OL]. (2022-05-04) [2022-08-17]. https: / /www. fda. gov /drugs /pharmaceutical-quality-resources /cder-quality-management-maturity.
[7] ISPE – PDA Guide to Improving Quality Culture in Pharmaceutical Manufacturing Facilities[EB/OL]. (2019-10-07) [2022-08-17]. https: / /ispe.org /news /ispe-pda-create-guide-improving-quality-culture-pharmaceutical-industry.
[8] 國家藥品監(jiān)督管理局. 國務(wù)院辦公廳印發(fā)《關(guān)于建立職業(yè)化專業(yè)化藥品檢查員隊伍的意見》[EB/OL] . (2019-07-18) [2022-08-17]. https: / /www. nmpa. gov. cn /yaopin /ypjgdt /20190718174601792. html.
[9] 國家藥品監(jiān)督管理局. 國務(wù)院辦公廳印發(fā)《關(guān)于全面加強藥品監(jiān)管能力建設(shè)的實施意見》[EB/OL] . (2021-05-10) [2022-08-17]. https: / /www.nmpa. gov. cn /zhuanti /ypjgssyj /ypjgssyjjj /20210510191205129. html.
[10] 國家藥品監(jiān)督管理局. 國家藥品監(jiān)督管理局啟動藥品檢查合作計劃(PIC/S) 預(yù)加入申請工作[EB/OL] . (2021-09-29) [2022-08-17]. https:/ /www. nmpa. gov. cn /yaopin /ypjgdt /20210929162552105. html.
[11] Steven Lynn����,Susan Schniepp,Justin Anahory. Getting drug quality right thefirst time [EB/OL]. (2022-04-20) [2022-08-17]. https: / /www. pharmamanufacturing.com/articles /2022 /getting-drug-quality-right-the-first-time /.
[12] 王霞����,陳恒青�,朱建偉. 質(zhì)量管理體系中實施質(zhì)量量度對制藥工業(yè)的意義[J]. 中國醫(yī)藥工業(yè)雜志, 2020�,51(4) : 545-550.
[13] 包敏芝,胡延熹. 質(zhì)量量度在國內(nèi)藥品生產(chǎn)企業(yè)中的應(yīng)用[J]. 上海醫(yī)藥, 2016����, 37(23) : 69-72.
[14] 國家藥品監(jiān)督管理局. 中華人民共和國藥品管理法[EB/OL]. (2019-08-27) [2022-08-17]. https: / /www. nmpa. gov. cn /xxgk /fgwj /flxzhfg /20190827083801685. html.
[15] 張景辰. 加強事中監(jiān)管,促進(jìn)藥品產(chǎn)業(yè)的供給側(cè)改善—FDA 質(zhì)量量度計劃的啟示[J]. 中國食品藥品監(jiān)管����, 2016,(4): 56-58.
[16] 楊依晗��,趙燕君��,高惠君. 美國食品和藥物管理局質(zhì)量量度管理的簡介及啟示[J]. 中國新藥與臨床雜志��, 2016�, 35(4) : 260-263.
[17] 孫敏,譚德講. 用合理的質(zhì)量量度指標(biāo)助力藥品質(zhì)量的科學(xué)監(jiān)管[J]. 中國食品藥品監(jiān)管�, 2021,(2) : 37-43.
本文作者胡位歆��、和金周����,杭州市食品藥品檢驗研究院、杭州市市場監(jiān)督管理局�,來源于中國醫(yī)藥導(dǎo)刊��,僅供交流學(xué)習(xí)����。