今日頭條
亞虹MetAP2抑制劑早期臨床積極����。亞虹醫(yī)藥口服可逆性MetAP2抑制劑APL-1202聯(lián)合替雷利珠單抗對比替雷利珠單抗單藥,用于新輔助治療肌層浸潤性膀胱癌(MIBC)的I/II期臨床結(jié)果積極����。APL-1202具有抗血管生成、抗腫瘤活性及調(diào)節(jié)腫瘤免疫微環(huán)境的作用�。期中分析顯示,聯(lián)用治療組和單藥組均達到Simon二階段試驗最優(yōu)設(shè)計對第一階段療效的要求�,該試驗進入第二階段。
國內(nèi)藥訊
1.昂科免疫CTLA-4抗體啟動Ⅲ期臨床�。昂科免疫CTLA-4單抗ONC-392登記啟動一項Ⅲ期臨床,擬評估與多西他賽頭對頭比較���,用于治療經(jīng)PD-1/PD-L1抑制劑治療后進展的轉(zhuǎn)移性非小細(xì)胞肺癌受試者的有效性與安全性�。這是國際Ⅲ期臨床的中國部分,將由廣東省人民醫(yī)院吳一龍教授擔(dān)任主要研究者����。2023年3月,BioNTech公司與昂科免疫達成合作�,共同開發(fā)和商業(yè)化ONC-392用于(單藥或聯(lián)合用藥)治療多種實體瘤���。
2.禮來FGFR3抑制劑中國報IND����。禮來1類化藥LOXO-435片的臨床試驗申請獲CDE受理����。LOXO-435是一款選擇性FGFR3抑制劑�,可避免因抑制FGFR1和FGFR2導(dǎo)致的劑量限制性毒性���,避免出現(xiàn)高磷酸血癥和其他慢性不耐受的不良事件����。目前全球尚無FGFR3抑制劑獲批上市。在海外����,LOXO-435正在I期臨床中評估用于治療尿路上皮癌的安全性與有效性����。
3.恒瑞源正HPV18靶向TCR-T上Ⅰ期臨床。恒瑞源正靶向HPV18的TCR-T療法HRYZ-T101登記啟動一項Ⅰ期臨床�,擬評估用于治療HPV18陽性實體瘤的安全性和有效性�。該項試驗主要研究者由復(fù)旦大學(xué)附屬腫瘤醫(yī)院吳小華醫(yī)學(xué)博士和張劍醫(yī)學(xué)博士共同擔(dān)任。今年5月����,恒瑞源正已完成超2億元C輪融資,紫金港資本作為本輪主要投資機構(gòu)繼續(xù)加投���,其他主要投資機構(gòu)包括恒瑞醫(yī)藥、中科科創(chuàng)等����。
4.深圳福沃口服SERD上Ⅰ期臨床。福沃藥業(yè)自主研發(fā)的口服選擇性雌激素受體降解劑(SERD)FWD1802�,在首次人體Ⅰ期臨床中完成首例受試者給藥�。該項試驗旨在評估FWD1802單藥治療�,和與哌柏西利聯(lián)合治療用于ER+/HER2-不可切除的局部晚期或轉(zhuǎn)移性乳腺癌受試者中安全性和有效性,主要研究者由復(fù)旦大學(xué)附屬腫瘤醫(yī)院腫瘤內(nèi)科主任醫(yī)師張劍副教授擔(dān)任����。
5.諾誠健華SHP2抑制劑獲批肺癌臨床。諾誠健華新型SHP2變構(gòu)抑制劑ICP-189獲國家藥監(jiān)局臨床許可���,擬開展單藥治療晚期實體瘤���,以及聯(lián)合EGFR抑制劑甲磺酸伏美替尼片用于治療EGFR突變的局部晚期或轉(zhuǎn)移性非小細(xì)胞肺癌(NSCLC)的臨床研究。SHP2是一種非受體蛋白酪氨酸磷酸酶���,在MAPK信號通路和免疫檢查點通路中發(fā)揮作用����,可調(diào)節(jié)細(xì)胞增殖和存活���。此前,該新藥已在美國獲臨床批件���。
6.康方CLDN18.2/CD47雙抗國內(nèi)獲批臨床����。康方生物CLDN18.2/CD47雙抗AK132注射液獲國家藥監(jiān)局批準(zhǔn)開展用于治療晚期惡性腫瘤的臨床研究。AK132能同時特異性結(jié)合CLDN18.2和CD47分子����,具有協(xié)同抗腫瘤的潛力。此前����,全球已有3款同類藥物在研,分別是寶船生物BC007�、尚健生物SG1906和Phanes公司PT886;BC007和SG1906正在中美兩國同步進行臨床開發(fā)���,分別評估用于晚期實體瘤的治療潛力����。
國際藥訊
1.纈苯那嗪顆粒劑報NDA�。Neurocrine公司VMAT2抑制劑新劑型纈苯那嗪(Valbenazine,Ingrezza)顆粒劑的上市申請獲FDA受理����,旨在尋求覆蓋Valbenazine膠囊所獲批的適應(yīng)癥���,包括遲發(fā)性運動障礙和亨廷頓病的舞蹈癥狀����,PDUFA日期為明年4月30日。Valbenazine能夠通過降低突觸前的多巴胺水平來減少不可自控行為的發(fā)生���。Ingrezza的顆粒劑配方有望為吞咽困難的遲發(fā)性運動障礙和亨廷頓病舞蹈癥患者提供替代治療選擇。
2.口服非肽類偏向性激動劑Ⅲ期臨床成功����。Crinetics公司口服非肽類偏向性激動劑Paltusotine(CRN00808)治療肢端肥大癥的Ⅲ期臨床PATHFNDR-達到主要終點和所有次要終點。與安慰劑相比����,paltusotine治療組第36周時達到IGF-1(胰島素樣生長因子1)水平保持在正常值上限的1.0倍以下的患者比例更高(83%vs4%���,p<0.0001)�;paltusotine的耐受性良好�。此前,該新藥已獲FDA授予治療肢端肥大癥的孤兒藥資格����。
3.GPR119激動劑上NASH Ⅱ期臨床���。NeuroBo公司新型G-蛋白偶聯(lián)受體119(GPR119)激動劑DA-1241治療非酒精性脂肪性肝炎(NASH)的Ⅱa期臨床首例患者給藥����。DA-1241可促進關(guān)鍵腸肽GLP-1����、GIP和PYY的釋放�,對肝臟炎癥、脂質(zhì)代謝�、體重減輕和葡萄糖代謝具有潛在益處。在NASH和2型糖尿病臨床前動物模型中����,DA-1241已顯示出可減少肝臟脂肪變性�、肝臟炎癥和肝纖維化,同時改善血糖控制���。
4.新型IL-2偶聯(lián)物皮炎早期臨床積極。Nektar公司新型IL-2偶聯(lián)物rezpegaldesleukin治療特應(yīng)性皮炎的Ⅰb期臨床結(jié)果積極。rezpegaldesleukin能劑量依賴性地改善ESAI評分�;24µg/kg劑量組在受影響的體表面積(BSA)、皮膚科生活質(zhì)量指數(shù)調(diào)查表(DLQI)以及患者濕疹自我評估(POEM)等臨床療效終點上也具有統(tǒng)計學(xué)上顯著的改善���。此外���,藥物的安全性良好���。
5.BMS終止多款新藥臨床開發(fā)����。百時美施貴寶在研發(fā)日上透露���,公司終止TIGIT單抗BMS-986207�、RNAi療法BMS-986263���、RIPK1抑制劑、CC-90009����、CD47/CD20雙抗等新藥的開發(fā)����。BMS-986207(ONO-4686)是一款TIGIT單抗����,在O藥+Y藥+TIGIT的三免疫檢查點抑制劑聯(lián)合方案治療IV期未接受全身抗癌治療的非小細(xì)胞肺癌(NSCLC)患者的Ⅱ期臨床中����,由于毒性太大,還沒披露結(jié)果就直接終止����。
6.AlveoGene融資開發(fā)AATD吸入式基因療法����。AlveoGene公司宣布正式成立并完成種子輪融資。AlveoGene由OSE����、Harrington和OCC與英國呼吸基因治療聯(lián)盟(GTC)的六位頂尖科學(xué)家合作創(chuàng)建�,該公司將利用GTC開發(fā)的下一代慢病毒遞送平臺,開發(fā)吸入式基因療法用于罕見呼吸系統(tǒng)疾病的治療�。AlveoGene公司先導(dǎo)候選藥物AVG-001是一種新型的吸入式基因療法�,預(yù)計2-3年內(nèi)將進入臨床開發(fā)�,用于治療α-1抗胰蛋白酶缺乏癥(AATD)患者����。
醫(yī)藥熱點
1.山東中醫(yī)藥大學(xué)黨委書記履新。9月14日下午�,山東中醫(yī)藥大學(xué)召開干部會議,宣布省委關(guān)于學(xué)校黨委主要領(lǐng)導(dǎo)調(diào)整的決定:張立祥同志任山東中醫(yī)藥大學(xué)黨委書記�,武繼彪同志不再擔(dān)任山東中醫(yī)藥大學(xué)黨委書記職務(wù)����。根據(jù)公開資料,張立祥�,男,漢族�,1966年9月生,省委黨校研究生�,公共衛(wèi)生碩士,中共黨員���。張立祥曾任山東省衛(wèi)生廳辦公室主任�,山東中醫(yī)藥高等?��?茖W(xué)校校長���、黨委副書記、黨委書記����,山東省衛(wèi)生健康委員會黨組成員、副主任等職務(wù)����。
2.中國中醫(yī)科學(xué)院西苑醫(yī)院濟寧醫(yī)院掛牌�。9月15日�,中國中醫(yī)科學(xué)院西苑醫(yī)院濟寧醫(yī)院掛牌儀式舉行。西苑醫(yī)院濟寧醫(yī)院新院區(qū)總投資32.3億元����,建筑面積26.1萬平方米�,規(guī)劃床位1300張,停車位2253個�,配置國內(nèi)一流醫(yī)療設(shè)備及信息化系統(tǒng)。醫(yī)院將重點建設(shè)心腦血管病科等六大?��??���,打造一流的國家區(qū)域醫(yī)療中心�,助力國家中醫(yī)藥綜合改革示范區(qū)建設(shè)。
3.孟加拉國暴發(fā)嚴(yán)重登革熱疫情���。孟加拉國衛(wèi)生服務(wù)總局16日發(fā)布數(shù)據(jù)顯示���,截至當(dāng)日����,該國今年以來已累計報告登革熱病例164562例,死亡病例804例����,其中9月死亡病例211例。世界衛(wèi)生組織稱����,這是該國有記錄以來最嚴(yán)重的登革熱疫情。目前�,孟加拉國所有8個專區(qū)下的64個縣均報告了登革熱病例。
評審動態(tài)
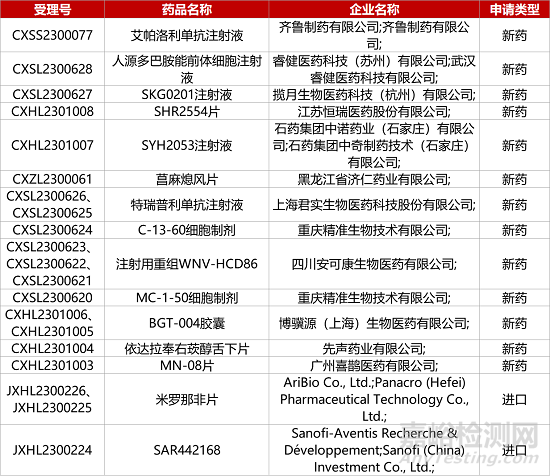
1. CDE新藥受理情況(09月17日)
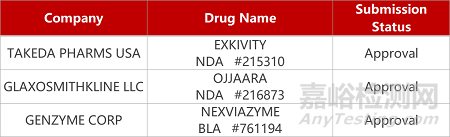
2. FDA新藥獲批情況(北美09月15日)