殘留的腫瘤細(xì)胞和骨組織缺損是臨床骨肉瘤治療的兩個(gè)關(guān)鍵挑戰(zhàn)。近日���,上海大學(xué)陳雨教授��、馮煒副研究員和山東大學(xué)齊魯醫(yī)院劉培來教授通過將MoO3−x亞納米線集成到3D打印生物活性玻璃支架上構(gòu)建自適應(yīng)功能組織工程支架����,從而提出亞納米醫(yī)學(xué)概念�����。MoO3−x亞納米線是通過一鍋水熱法合成的,該方法在酸性腫瘤微環(huán)境中聚集�����,并與過氧化氫反應(yīng)產(chǎn)生活性氧�,用于特定的化學(xué)動(dòng)力學(xué)治療。而且它們可以在生理?xiàng)l件下快速降解而不引起毒性�。此外,自適應(yīng)增強(qiáng)的光熱轉(zhuǎn)換使腫瘤靶向光熱治療�����,同時(shí)增強(qiáng)化學(xué)動(dòng)力學(xué)治療�。通過免疫印跡分析、共聚焦激光掃描顯微鏡觀察和mRNA轉(zhuǎn)錄組分析����,Mo5+-Mo6+轉(zhuǎn)變使脂質(zhì)過氧化物積累和谷胱甘肽耗盡,從而導(dǎo)致谷胱甘肽過氧化物酶4蛋白失活和鐵死亡����。所構(gòu)建的支架除了具有抗骨肉瘤的穩(wěn)健性外,還能刺激大鼠骨間充質(zhì)干細(xì)胞的分化和增殖����,促進(jìn)骨缺損的成骨���。因此,這種多功能支架不僅驗(yàn)證了亞納米醫(yī)學(xué)的概念�,而且為骨組織工程提供了一個(gè)很有前途的臨床策略。
相關(guān)研究?jī)?nèi)容以“Self-Adaptive MoO3−x Subnanometric Wires Incorporated Scaffolds for Osteosarcoma Therapy and Bone Regeneration”為題于2023年9月8日發(fā)表在《Advanced Functional Materials》���。
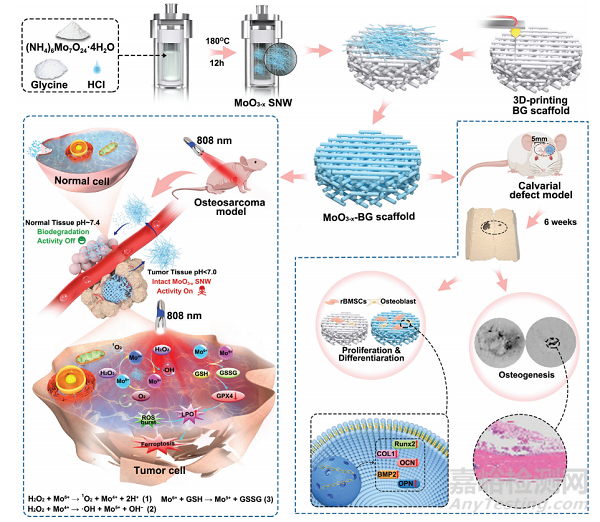
圖1 MoO3−x-BG支架和相應(yīng)的PTT增強(qiáng)CDT聯(lián)合抗骨肉瘤并促進(jìn)成骨的構(gòu)建過程示意圖
亞納米線(SNWs)是一類新興的具有機(jī)械靈活性的一維(1D)亞納米材料(SNMs)�,具有高度高效的能量轉(zhuǎn)換和優(yōu)異的催化活性�。在此���,本研究報(bào)道了一個(gè)自適應(yīng)功能治療平臺(tái)����,該平臺(tái)將合理設(shè)計(jì)的MoO3−xPOM亞納米線(MoO3−xSNWs)集成到3D打印生物活性玻璃(BG)支架上����,表示為MoO3−x-BG支架,用于骨肉瘤(OS)治療和成骨(圖1)����。
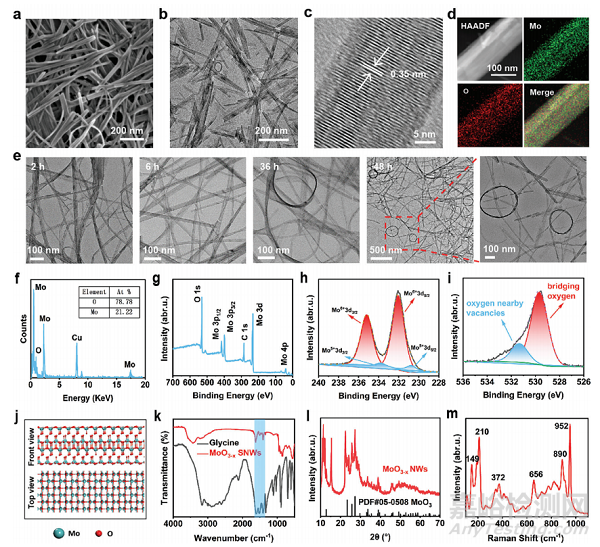
圖2 MoO3−xSNWs的表征
掃描電子顯微鏡(SEM)和透射電子顯微鏡(TEM)圖像顯示��,MoO3−xSNWs為典型的線狀結(jié)構(gòu)(圖2a�����、b)�。線狀結(jié)構(gòu)的高分辨率透射電子顯微鏡(HRTEM)圖像顯示晶格間距為0.35nm(圖2c)���。對(duì)MoO3−xSNWs的高角環(huán)形暗場(chǎng)圖像���、特征元素映射和相應(yīng)的能量色散X射線光譜分析顯示,Mo和O的比例分布良好(圖2d����、f)。TEM觀察發(fā)現(xiàn)較長(zhǎng)的攪拌時(shí)間導(dǎo)致卷繞結(jié)構(gòu)(圖2e)���。X射線光電子光譜(XPS)顯示其表面的化學(xué)成分和狀態(tài)���,其中Mo、O和C在全測(cè)量掃描中顯示(圖2g)�。Mo 3d的高分辨率XPS譜顯示,235.18和232 eV的結(jié)合能與Mo6+的存在有關(guān)����,而233.8和230.8 eV的結(jié)合能與Mo5+的存在有關(guān)(圖2h)���。在O 1s光譜中,在531.36 eV處的峰值歸因于氧缺陷(圖2i)�。MoO3−xSNWs的獨(dú)特結(jié)構(gòu)與氧缺陷的不對(duì)稱分布密切相關(guān)(圖2j)。傅里葉變換紅外光譜鑒定了MoO3−xSNWs的結(jié)構(gòu)(圖2k)����。MoO3−xSNWs的典型衍射峰被很好地索引到標(biāo)準(zhǔn)的α-MoO3六邊形PDF卡(圖2l)。MoO3−xSNWs的拉曼光譜如圖2m所示����。
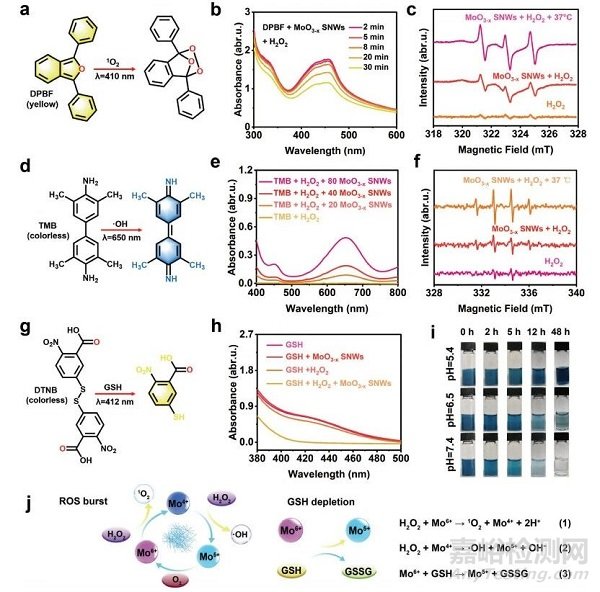
圖3 MoO3−xSNWs的化學(xué)動(dòng)力學(xué)性能
1,3-二苯異苯并呋喃(DPBF)是一種黃色的1O2指示劑,與1O2反應(yīng)后褪色(圖3a)���。DPBF與H2O2和MoO3−xSNWs孵育30 min后,455 nm處的特征吸收峰下降(圖3b)�。電子自旋共振(ESR)光譜證實(shí)1O2的產(chǎn)生(圖3c),其中2,2,6,6-四甲基哌啶(a 1O2捕獲劑)與H2O2和MoO3−xSNWs反應(yīng)����,顯示一個(gè)1:1:1的特征信號(hào)峰。當(dāng)溫度升高到37℃后��,信號(hào)逐漸增強(qiáng),表明1O2的產(chǎn)率隨溫度的升高而增加�。以3,3′��,5���,5′·-四甲基聯(lián)苯胺(TMB)作為·OH指標(biāo)���,評(píng)價(jià)·OH的產(chǎn)量(圖3d)。隨著濃度的增加�����,在650 nm處的特征吸光度峰的強(qiáng)度顯著增加(圖3e)�。使用5,5-二甲基-1-吡咯烷n-氧化物作為自旋陷阱,通過ESR定性地確認(rèn)了·OH的產(chǎn)生(圖3f)����。與其他基團(tuán)相比,(GSH +H2O2+MoO3−xSNWs)組在412 nm處的吸收峰明顯較低(圖3h)�����,說明MoO3−xSNWs介導(dǎo)的催化反應(yīng)可以耗盡GSH���。因此可以合理地推斷�,MoO3−xSNWs中的Mo5+與H2O2反應(yīng)產(chǎn)生·OH和1O2,而產(chǎn)生的Mo6+消耗GSH產(chǎn)生氧化谷胱甘肽(圖3j)����。為了評(píng)估其穩(wěn)定性和生物降解性,將MoO3−xSNWs分散在不同pH值的磷酸鹽緩沖溶液中(圖3i)���。
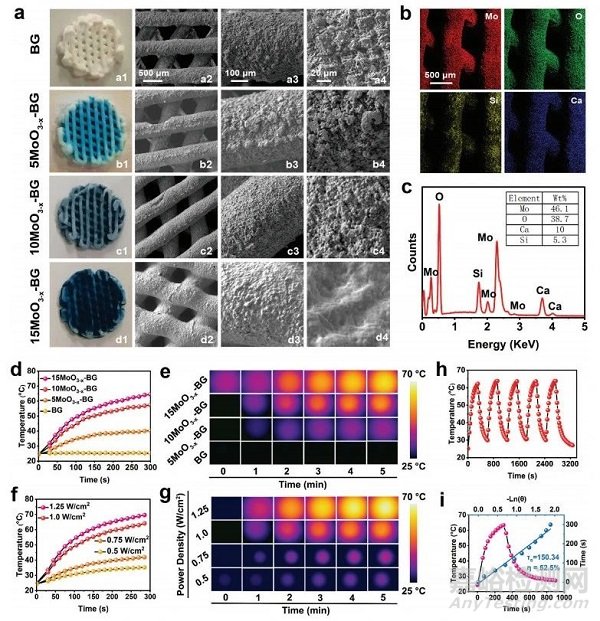
圖4 MoO3−x-BG支架的組成特性和光熱性能
獲得的支架表現(xiàn)出設(shè)計(jì)良好�、均勻交錯(cuò)的微觀結(jié)構(gòu)��,隨著MoO3−xSNWs濃度的增加�,藍(lán)色逐漸變暗(圖4a1-d1)。SEM圖像顯示���,BG支架表現(xiàn)出良好的大孔和粗糙的表面(圖4b2-d2)���,MoO3−xSNWs修飾賦予BG支架光滑的表面(圖4b2���、d4)����。相應(yīng)的元素映射圖像證實(shí)Mo、O�����、Si和Ca的分布均勻(圖4b)���,表明支架與MoO3−xSNWs的成功整合����。在808 nm激光照射下���,溫度隨時(shí)間顯著增加�,且呈劑量和功率密度依賴性(圖4d-g)����。純BG的溫度變化可以忽略不計(jì)(圖4d),說明MoO3−xSNWs的存在可以有效地�����、快速地將NIR光轉(zhuǎn)化為熱能�����。MoO3−x-BG支架的光熱性能在5次激光開/關(guān)照射周期后的衰退可以忽略不計(jì)(圖4h),從而確定光熱學(xué)穩(wěn)定性��。MoO3−x-BG支架的光熱轉(zhuǎn)換效率為52.5%(圖4i)���,表明它們具有用于后續(xù)光熱癌消融的潛力�。
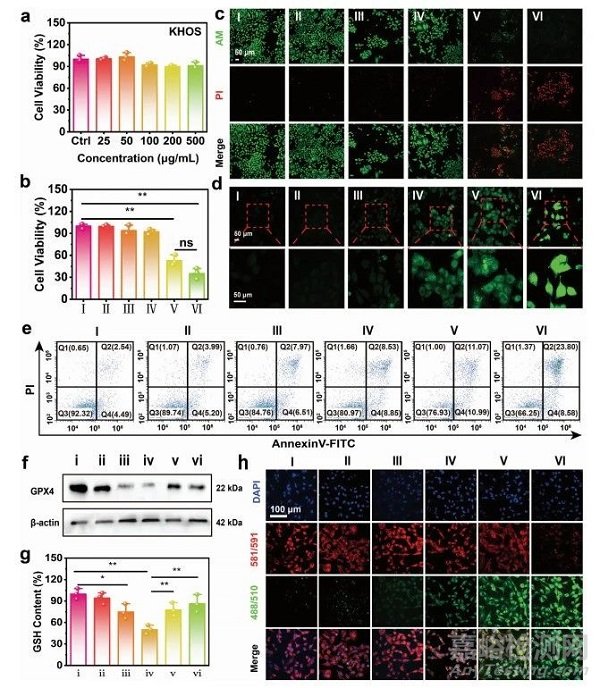
圖5 在體外�,通過MoO3−xSNWs進(jìn)行PTT增強(qiáng)的血流動(dòng)力學(xué)治療(CDT)
在人成骨肉瘤(KHOS)細(xì)胞和人臍靜脈內(nèi)皮細(xì)胞研究MoO3−xSNWs的細(xì)胞相容性(圖5a),即使在500gmL−1的高濃度下處理24 h后�����,其細(xì)胞毒性可以忽略不計(jì)����。隨后使用MoO3−xSNWs研究了體內(nèi)PTT增強(qiáng)的CDT(圖5b),結(jié)果表明PTT可以促進(jìn)CDT的殺傷作用�����。使用鈣綠素乙酰甲酯(綠色)和碘化丙啶(PI 紅色)染色活/死亡細(xì)胞����,確定MoO3−xSNWs介導(dǎo)和PTT增強(qiáng)的CDT的顯著治療效果(圖5c)。MoO3−xSNWs+H2O2處理后的細(xì)胞凋亡率為22.1%����,在激光照射下進(jìn)一步上升至32.4%(圖5e),表明加熱可促進(jìn)治療效果�。為了研究其殺傷機(jī)制,采用2,7-二氯熒光素二乙酸酯(DCFH-DA�,綠色)試驗(yàn),通過共聚焦激光掃描顯微鏡(CLSM)來驗(yàn)證細(xì)胞內(nèi)ROS的生成(圖5d)���。根據(jù)蛋白印跡分析(圖5f)�,MoO3−xSNWs+H2O2組的GPX4表達(dá)量明顯低于H2O2和MoO3−xSNWs+H2O2組��,而MoO3−xSNWs+H2O2組的表達(dá)水平遠(yuǎn)低于H2O2組�。KHOS細(xì)胞在對(duì)照組、NIR和MoO3−xSNWs組中表現(xiàn)出強(qiáng)烈的紅色和弱綠色熒光(圖5h)���,從而表明脂質(zhì)過氧化作用(LPO)的生成最少�。
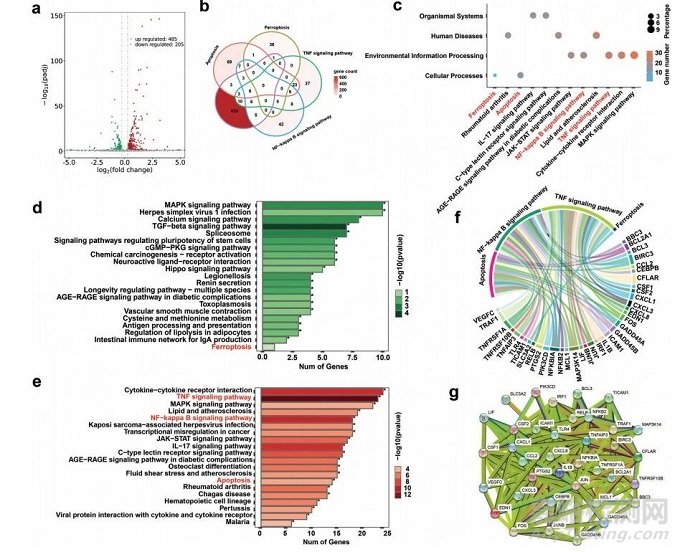
圖6 MoO3−xSNWs介導(dǎo)協(xié)同治療后的KHOS細(xì)胞轉(zhuǎn)錄組分析
根據(jù)火山圖和熱圖(圖6)�����,協(xié)同治療組較對(duì)照組共鑒定出約690個(gè)差異表達(dá)基因(DEGs)���,其中485個(gè)上調(diào)基因��,205個(gè)下調(diào)基因���,主要與炎癥調(diào)節(jié)和應(yīng)激反應(yīng)有關(guān)��。如維恩圖所示���,690個(gè)DEGs涉及鐵死亡、凋亡���、腫瘤壞死因子信號(hào)通路和核因子-kappaB信號(hào)通路(圖6b)�����,證實(shí)MoO3−xSNWs治療可緩解氧化應(yīng)激誘導(dǎo)的細(xì)胞凋亡��、鐵死亡和炎癥�����。篩選690個(gè)DEGs進(jìn)行KEGG分析���,結(jié)果顯示在MoO3−xSNWs介導(dǎo)的協(xié)同治療中���,這四種信號(hào)通路與鐵死亡、凋亡和炎癥顯著相關(guān)���。這37個(gè)相關(guān)功能基因的和弦圖表明,MoO3−xSNWs在OS治療過程中發(fā)揮鐵死亡和炎癥調(diào)節(jié)因子的作用(圖6f)�����。通過蛋白-蛋白相互作用網(wǎng)絡(luò)分析從4個(gè)通路中基因與DEGs的交叉點(diǎn)中獲得的37個(gè)相關(guān)功能基因(圖6g)�,發(fā)現(xiàn)與主要蛋白相連的鄰近蛋白涉及PTGS2、CXCL1家族和MAP3K14�,這是鐵死亡和炎癥的關(guān)鍵調(diào)控蛋白。綜上結(jié)果表明����,MoO3−xSNWs+H2O2+ NIR治療可以調(diào)控與鐵死亡、細(xì)胞凋亡和炎癥調(diào)控相關(guān)的基因表達(dá)模式�����。
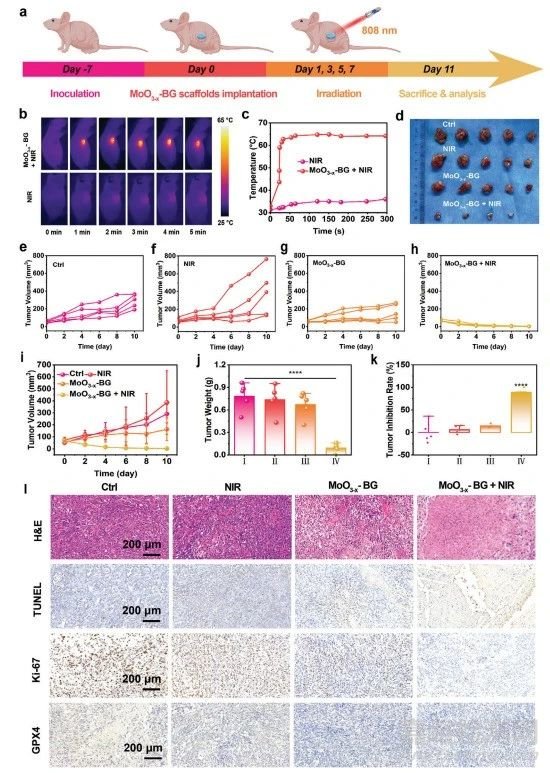
圖7 MoO3−x-BG支架的CDT抗腫瘤作用
由于其具有良好的體外抗腫瘤效果�����,接下來研究其對(duì)OS的體內(nèi)治療性能(圖7a)。MoO3−x-BG支架+ NIR激光組在5 min內(nèi)的腫瘤溫度從33.2°C迅速增加到64.9°C�����,而NIR激光組的溫度變化可以忽略不計(jì)(圖7b���、c)����。MoO3−x-BG+NIR組以100%的抑制率完全消除腫瘤(圖7d-k)���。為了進(jìn)一步驗(yàn)證抗腫瘤療效���,收集所有組的腫瘤切片進(jìn)行病理評(píng)估(圖7l)。分別采用H&E染色��、TUNEL和Ki-67抗體染色方法評(píng)估腫瘤組織的壞死/凋亡和細(xì)胞增殖活性����。H&E染色結(jié)果顯示MoO3−x-BG+NIR激光組有大量OS細(xì)胞壞死。TUNEL圖像顯示�,MoO3−x-BG+NIR激光組的凋亡細(xì)胞多于其他各組,從而驗(yàn)證其有效性�����。Ki-67染色圖像顯示,MoO3−x-BG+NIR激光組在四組中OS細(xì)胞增殖最少�����,表明癌細(xì)胞的增殖受到顯著抑制�。GPX4的免疫組化分析顯示���,MoO3−x-BG+NIR激光組中GPX4的表達(dá)下調(diào)�。
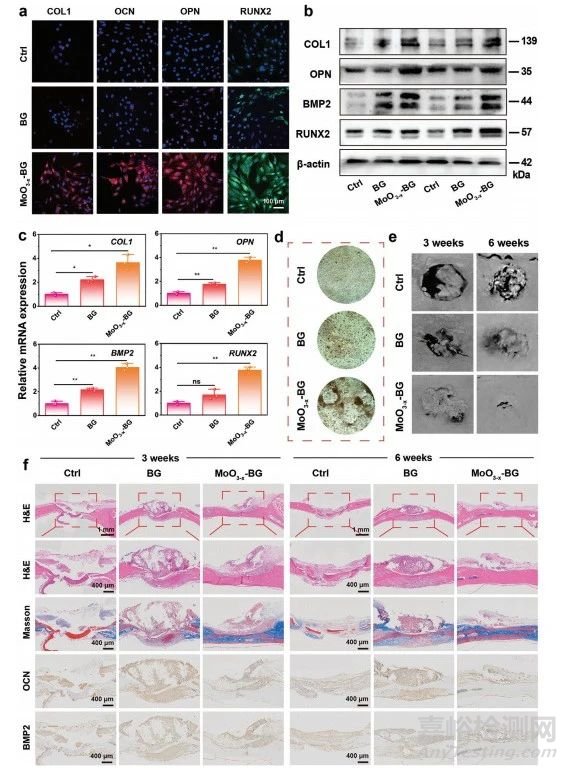
圖8 成骨生物活性的體內(nèi)外成骨生物活性評(píng)價(jià)
CLSM圖像顯示不同處理后的成骨蛋白��,即1型膠原蛋白(COL1)��、骨鈣素(OCN)�、骨橋蛋白(OPN)和runt相關(guān)轉(zhuǎn)錄因子2(RUNX2)的表達(dá)(圖8a)。MoO3−x-BG組的熒光強(qiáng)度明顯強(qiáng)于Ctrl組和BG組��,從而驗(yàn)證MoO3−x-BG支架可以促進(jìn)rBMSC的增殖��。MoO3−x-BG支架組中成骨蛋白COL 1���、OPN��、RUNX2和骨形態(tài)發(fā)生蛋白2(BMP2)的表達(dá)水平均顯著高于其他各組(圖8b)�����,從而進(jìn)一步證實(shí)MoO3−x-BG支架的成骨特性����。與其他組不同,MoO3−x-BG支架組促進(jìn)成骨相關(guān)基因的表達(dá)(圖8c)���,證明MoO3−x-BG支架具有理想的成骨分化能力�����。在孵育21天后��,MoO3−x-BG支架組比Ctrl和BG組含有更多的鈣結(jié)節(jié)(圖8d)��。采集的顱骨顯微計(jì)算機(jī)斷層掃描(micro-CT)重建圖像直接證實(shí)缺損區(qū)域的新骨形成(圖8e)��,MoO3−x-BG支架組在第3周從邊緣擴(kuò)展至顱骨缺損區(qū)中心�,到第6周時(shí)幾乎看不見空洞��。接下來進(jìn)行組織學(xué)和免疫組化染色�,以進(jìn)一步評(píng)估顱骨修復(fù)的療效(圖8f)�,結(jié)果提示MoO3−x-BG支架促進(jìn)骨組織形成�,膠原纖維生成及成骨基因表達(dá)。
本研究通過設(shè)計(jì)具有強(qiáng)大物理化學(xué)性質(zhì)和獨(dú)特生物效應(yīng)的多功能亞納米生物材料�,將亞納米醫(yī)學(xué)的概念引入到生物材料的設(shè)計(jì)和工程中。本研究構(gòu)建一個(gè)基于3D打印MoO3−x-BG支架的自適應(yīng)多功能工程平臺(tái)�����,用于OS治療和成骨�����。作為一種基于Mo的POMs�,MoO3−xSNWs不僅具有優(yōu)異的光熱轉(zhuǎn)換效率�,而且具有pH和氧化還原響應(yīng)性。腫瘤內(nèi)MoO3−xSNWs和還原劑GSH之間的氧化還原反應(yīng)導(dǎo)致GSH的消耗����。同時(shí),Mo6+還原為Mo4+�,隨后Mo4+氧化為Mo5+,分別通過羅素機(jī)制和芬頓樣反應(yīng)與H2O2反應(yīng)���,觸發(fā)了1O2和·OH的形成����,而GPX4的表達(dá)下調(diào)。因此��,LPO由于ROS爆發(fā)����、GSH耗盡和GPX4失活而增強(qiáng),從而導(dǎo)致鐵死亡�。MoO3−x-BG支架結(jié)合光子熱療與ROS觸發(fā)的鐵死亡,對(duì)OS表現(xiàn)出良好的治療效果����。更重要的是,工程設(shè)計(jì)的MoO3−x-BG支架促進(jìn)rBMSC的分化和增殖��,從而加速新生骨的再生�����。
文章來源:https://doi.org/10.1002/adfm.202304163