引言
依據(jù)《注射劑項目研發(fā)生產(chǎn)策略全解析系列》(小試實驗設(shè)計篇)得到的相關(guān)數(shù)據(jù)指導(dǎo)中試放大����,但不能一味依賴小試實驗數(shù)據(jù)����,更需要考慮小試階段所使用的設(shè)備����、參數(shù)與車間生產(chǎn)設(shè)備的不同點����,特別是運(yùn)行原理不一致的設(shè)備如(1)機(jī)械攪拌和磁力攪拌�,(2)陶瓷泵和蠕動泵,(3)飽和蒸汽滅菌和沸水滅菌�,等等��,所以許多參數(shù)在中試放大階段需要重新考察��。
本篇《注射劑項目研發(fā)生產(chǎn)策略全解析系列》(中試放大的重點考量)得到的數(shù)據(jù)為技術(shù)轉(zhuǎn)移及工藝驗證提供直接的依據(jù)����,降低此階段的風(fēng)險。
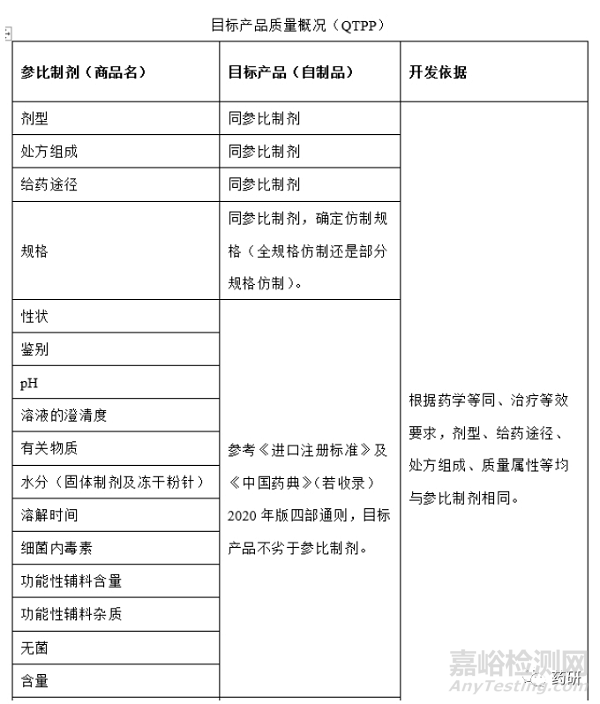
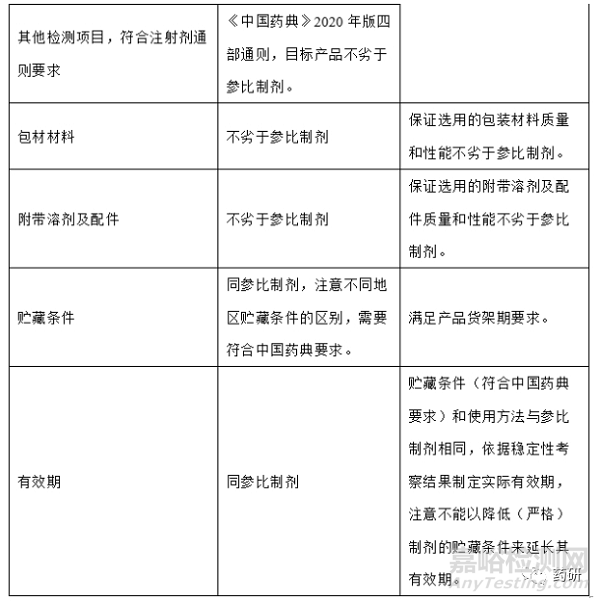
1�、目標(biāo)產(chǎn)品質(zhì)量概況(QTPP)
根據(jù)參比制劑上市國藥典(原料藥和制劑項)�、參比制劑國內(nèi)進(jìn)口說明書等資料�,確定參比制劑處方工藝信息,未查詢出來的處方工藝信息運(yùn)用反向工程以確定��,初步形成QTPP��,根據(jù)小試實驗數(shù)據(jù)完善QTPP����,再次確定QTPP�;舉例如下:
2����、工藝交接表
(1)工藝信息表
工藝信息表包括產(chǎn)品名稱��、產(chǎn)品規(guī)格��、產(chǎn)品代號�、批量(符合批量最低要求)、包裝形式�、裝量����、裝量范圍、中間產(chǎn)品和成品主藥及活性輔料(如抗氧劑����、抑菌劑)含量范圍��、中間產(chǎn)品密度����、pH值范圍、中間產(chǎn)品及成品存儲條件�、產(chǎn)品有效期等參數(shù)����。
(2)生產(chǎn)工藝
①:處方信息��,包括原輔料種類��、用量及配制總量��。
② :生產(chǎn)工藝信息一般包括:瓶處理工序�、配制工序�����、灌封工序��、滅菌工序��、燈檢工序��、包裝工序。
(3)工藝質(zhì)控點
工藝質(zhì)控點一般包括各工序的工藝參數(shù)��、工藝控制點及質(zhì)量控制點���。
(4)毒理數(shù)據(jù)
查詢該品種的毒理數(shù)據(jù),計算出基于健康的暴露限度(HBEL)�,并根據(jù)該產(chǎn)品說明書�����,將HBEL、千分之一最低日劑量��、10ppm���、半數(shù)致死量LD50給到生產(chǎn)車間,用于計算產(chǎn)品的清潔殘留數(shù)據(jù)����。
3����、產(chǎn)品質(zhì)量草案
(1)中間產(chǎn)品質(zhì)量草案
協(xié)同分析����,根據(jù)檢測項目及法規(guī)要求,并參考《進(jìn)口注冊標(biāo)準(zhǔn)》及《中國藥典》(若收錄)2020年版四部通則,完成中間產(chǎn)品質(zhì)量草案����。
(2)成品質(zhì)量草案
協(xié)同分析��,根據(jù)檢測項目及法規(guī)要求��,并參考《進(jìn)口注冊標(biāo)準(zhǔn)》及《中國藥典》(若收錄)2020年版四部通則,完成成品質(zhì)量草案�。
4、物料
需要準(zhǔn)確的原輔包��、過濾器的名稱��、在國家藥品監(jiān)督管理局藥品審評中心的登記信息�����、規(guī)格/型號、生產(chǎn)廠家�、密封/開封儲存條件及穩(wěn)定性等信息。
5��、取樣計劃
(1)中間產(chǎn)品取樣計劃
制定完善的取樣計劃����,一般包括密度、中間產(chǎn)品中控(一般包括性狀��、pH�、含量等)�、濾膜吸附(一般包括原料藥、功能性輔料如抗氧劑及抑菌劑含量等)�、微生物污染水平、理化(一般包括性狀�、pH�、含量及有關(guān)物質(zhì)等)、可見異物及生測(一般包括微生物等)藥液存放時限驗證����、滅菌后無菌����、內(nèi)毒素方法學(xué)驗證及檢驗���。
(2)成品取樣計劃
制定完善的取樣計劃,一般包括滅菌后冷熱點樣品,用于全檢�����、影響因素及方法學(xué)。
6����、批記錄
根據(jù)產(chǎn)品處方���、工藝、取樣計劃及車間相應(yīng)文件設(shè)備等信息與車間工藝員一同起草批記錄����。
7��、中試放大
執(zhí)行批記錄��,注意考察各工序的相關(guān)參數(shù)���,可使用最差工況考察,完善產(chǎn)品工藝�����。
8�����、成品考察
取得的冷熱點成品用于全檢����、影響因素及方法學(xué),并與參比制劑對比�����,要求質(zhì)量不劣于參比制劑��。
9��、數(shù)據(jù)總結(jié)
總結(jié)工藝參數(shù)、生產(chǎn)過程異常情況����、中間產(chǎn)品及成品數(shù)據(jù),需要重新研究的設(shè)計相應(yīng)實驗進(jìn)行研究�,評估如需要再中試則重新中試驗證,最終得到的數(shù)據(jù)用于指導(dǎo)工藝驗證���。
10���、總結(jié)
本篇《注射劑項目研發(fā)生產(chǎn)策略全解析系列》(中試放大的重點考量)需要全面關(guān)注產(chǎn)品生產(chǎn)工況及成品質(zhì)量����,如小試工藝參數(shù)的適用性并根據(jù)現(xiàn)場反饋及時調(diào)整��、生產(chǎn)過程的異常情況及時處理�����、中間產(chǎn)品及成品數(shù)據(jù)及時分析�����,并與參比制劑對比���,最終保證產(chǎn)品生產(chǎn)的順應(yīng)性,質(zhì)量不劣于參比制劑�,最終中試得到的數(shù)據(jù)可以用于指導(dǎo)工藝驗證。
11����、資料收集途徑
1)https://db.yaozh.com/(藥智數(shù)據(jù)庫�,很全面,90%以上的資料都有)
2)https://db.ouryao.com/(中國藥典����、法規(guī)及標(biāo)準(zhǔn)�,查藥品及檢測標(biāo)準(zhǔn)等)
3)https://drugx.cn/ (藥研導(dǎo)航,查各國藥監(jiān)局及藥典等)
4)化學(xué)藥品注射劑滅菌和無菌工藝研究及驗證指導(dǎo)原則(試行)
5)《化學(xué)藥品注射劑生產(chǎn)所用的塑料組件系統(tǒng)相容性研究技術(shù)指南(征求意見稿)》
6)化學(xué)藥物(原料藥和制劑)穩(wěn)定性研究技術(shù)指導(dǎo)原則