今日頭條
通化金馬口服AD新藥III期研究積極����。通化金馬藥業(yè)1類化藥琥珀八氫氨吖啶片用于治療輕����、中度阿爾茨海默病的III期臨床達(dá)到主要終點(diǎn)�。琥珀八氫氨吖啶片是一種新的乙酰膽堿酯酶抑制劑,具有雙重膽堿酯酶抑制功能��,可以同時(shí)抑制乙酰膽堿酯酶和丁酰膽堿酯酶��。結(jié)果顯示�,琥珀八氫氨吖啶片對AD評定量表認(rèn)知部分(ADAS-cog)的改善具有顯著的臨床意義�;治療組不良事件及不良反應(yīng)的發(fā)生率均低于兩個(gè)對照組�。
國內(nèi)藥訊
1.諾華預(yù)防偏頭痛新藥中國獲批上市��。諾華與安進(jìn)開發(fā)的CGRP抑制劑依瑞奈尤單抗(Erenumab)注射液獲國家藥監(jiān)局批準(zhǔn)上市��,用于預(yù)防成人偏頭痛����。在III期DRAGON研究中����,Erenumab(70mg)治療顯著降低患者每月偏頭痛天數(shù)(MMD)�;Erenumab(70mg)組每月偏頭痛天數(shù)相比基線減少50%以上的應(yīng)答率顯著高于安慰劑組�。2018年5月��,Erenumab獲得FDA批準(zhǔn)上市����,成為全球首個(gè)CGRP抑制劑����。
2.AZ奧希替尼新適應(yīng)癥在華報(bào)產(chǎn)����。阿斯利康第三代EGFR抑制劑奧希替尼新適應(yīng)癥上市申請獲CDE受理�。今年5月����,奧希替尼聯(lián)合化療治療EGFR突變非小細(xì)胞肺癌(NSCLC)的III期Flaura2研究已取得積極結(jié)果�。與奧希替尼單藥相比,研究者和BICR評估的奧希替尼聯(lián)合化療將患者中位PFS分別延長8.8個(gè)月和9.5個(gè)月�。此前�,該新藥針對NSCLC患者已獲NMPA批準(zhǔn)三項(xiàng)適應(yīng)癥。
3.亞虹宮頸癌藥械組合III期臨床積極��。亞虹醫(yī)藥用于非手術(shù)治療宮頸高級別鱗狀上皮內(nèi)病變(HSIL)的光動力藥械組合產(chǎn)品APL-1702的國際III期臨床達(dá)到主要研究終點(diǎn)����。APL-1702是集藥物和器械為一體的光動力治療產(chǎn)品,有望為HSIL患者提供非創(chuàng)傷性的新治療選擇�,免除手術(shù)治療的痛苦和副作用��。詳細(xì)數(shù)據(jù)將在學(xué)術(shù)會議及期刊上公布��。
4.云頂新耀創(chuàng)新抗生素組合擬納入優(yōu)先審評��。云頂新耀注射用鹽酸頭孢吡肟/注射用鹽酸他尼硼巴坦組合包裝獲CDE擬納入優(yōu)先審評,用于治療包括腎盂腎炎的成人復(fù)雜性尿路感染(cUTI)����。在III期臨床CERTAIN-1中�,與美羅培南相比,該組合達(dá)到臨床和微生物學(xué)應(yīng)答的患者比例具有優(yōu)效性(70.0%vs58%)����。今年8月����,F(xiàn)DA已受理該組合的新藥上市申請(NDA) 并授予優(yōu)先審評資格�,PDUFA日期為2024年2月22日。
5.云頂新耀引進(jìn)一款腎病藥物�。云頂新耀宣布與Kezar Life Sciences就后者已處于Ⅱ期臨床開發(fā)的選擇性免疫蛋白酶體抑制劑藥物zetomipzomib達(dá)成合作許可協(xié)議����,獲得zetomipzomib在大中華區(qū)��、韓國和部分東南亞國家的臨床開發(fā)和商業(yè)化權(quán)益�。zetomipzomib主要治療包括狼瘡性腎炎(LN)在內(nèi)的系列自身免疫性疾病����。根據(jù)協(xié)議����,Kezar將獲得700萬美元的預(yù)付款��,可能達(dá)1.325 億美元的開發(fā)、監(jiān)管和商業(yè)化里程碑后期付款��,以及產(chǎn)品的銷售分成����。
國際藥訊
1.輝瑞JAK3抑制劑獲歐盟批準(zhǔn)上市��。輝瑞口服特異性JAK3/TEC抑制劑Ritlecitinib(商品名:Litfulo��,利特昔替尼膠囊)獲歐盟委員會(EC)批準(zhǔn)上市�,用于治療12歲及以上重度斑禿患者�。在IIb/III期ALLEGRO研究中�,24周治療結(jié)果顯示�,Ritlecitinib(50mg)較安慰劑使患者達(dá)到頭皮實(shí)現(xiàn)毛發(fā)覆蓋率≥90%的比例更高(13.4%vs1.5%)。今年6月�,該新藥已在美國批準(zhǔn)上市�,用于治療12歲及以上青少年和成人斑禿。
2.右美沙酮抑郁癥長期療效積極�。Relmada公司新型NMDA受體通道阻斷劑REL-1017(右美沙酮)治療重度抑郁癥(MDD)的Ⅲ期擴(kuò)展REL-1017-310研究結(jié)果積極。與基線平均(33.8分)相較����,REL-1017治療導(dǎo)致患者M(jìn)ADRS總分獲得改善,第7天為11.3分����,第1個(gè)月為16.8分,第3個(gè)月和第6個(gè)月為19.9分��,第12個(gè)月為22.5分��;這四個(gè)時(shí)間點(diǎn)達(dá)到MADRS總分改善≥50%的患者比例分別為26.6%�、51.0%����、60.7%�、63.4%與77.2%��。1年期間未檢測到新的安全性信號��。
3.明尼蘇達(dá)大學(xué)NK細(xì)胞早期臨床積極����。美國明尼蘇達(dá)大學(xué)的研究人員使用IL-15和煙酰胺聯(lián)合單克隆抗體體外擴(kuò)增的自然殺傷細(xì)胞用于過繼轉(zhuǎn)移治療復(fù)發(fā)或難治性非霍奇金淋巴瘤和多發(fā)性骨髓瘤患者的Ⅰ期臨床結(jié)果積極��。在19例晚期非霍奇金淋巴瘤患者中�,13例患者表現(xiàn)出完全緩解,1例患者部分緩解�,總有效率達(dá)到74%。在血液��、骨髓和腫瘤組織中檢測到轉(zhuǎn)移后的NK細(xì)胞長達(dá)14天��,并保持良好的代謝特征。
4.首款自體TIL療法上市被延期�。FDA由于自身的資源限制,延長了Iovance公司腫瘤浸潤淋巴細(xì)胞(TIL)療法Lifileucel用于治療晚期黑色素瘤患者的生物制劑許可申請(BLA)的優(yōu)先審查時(shí)間�,PDUFA日期由今年11月25日延長至2024年2月24日����。FDA表示沒有重大審查問題,也沒有召開咨詢委員會會議的計(jì)劃��。目前��,對臨床場所的所有批準(zhǔn)前檢查�,內(nèi)部和外部制造和測試設(shè)施已成功完成。
5.羅氏與Orionis合作開發(fā)分子膠藥物�。羅氏旗下基因泰克與Orionis Biosciences將利用后者專有Allo-Glue小分子技術(shù)平臺����,針對基因泰克指定靶點(diǎn),聯(lián)合開發(fā)分子膠類創(chuàng)新藥�。Allo-Glue分子誘導(dǎo)的相互作用可導(dǎo)致靶蛋白被細(xì)胞的天然蛋白質(zhì)處理機(jī)制降解�、抑制或改變功能��。根據(jù)協(xié)議��,Orionis將獲得4700萬美元的預(yù)付款����,可能超過20億美元的開發(fā)和商業(yè)化里程碑潛在付款��,以及產(chǎn)品銷售的分級特許權(quán)使用費(fèi)。
6.德國默克逾12億美元布局AI藥物開發(fā)����。德國默克與BenevolentAI公司將利用后者端到端AI平臺技術(shù),聚焦于腫瘤學(xué)��、神經(jīng)病學(xué)和免疫學(xué)三個(gè)靶點(diǎn)��,合作開發(fā)新型候選藥物����。根據(jù)協(xié)議,BenevolentAI將獲得高達(dá)5.94億美元的款項(xiàng)��,包括預(yù)付款以及發(fā)現(xiàn)、開發(fā)和商業(yè)等里程碑款項(xiàng)�。默克同時(shí)也與Exscientia公司達(dá)成AI藥物發(fā)現(xiàn)合作。根據(jù)協(xié)議�,Exscientia將獲得2000萬美元的現(xiàn)金預(yù)付款,總額高達(dá)6.74億美元的發(fā)現(xiàn)�、開發(fā)、監(jiān)管和銷售里程碑付款����。
醫(yī)藥熱點(diǎn)
1.大連醫(yī)科大學(xué)二院兒童血液腫瘤診療中心成立�。9月19日,大連醫(yī)科大學(xué)附屬第二醫(yī)院正式成立兒童血液腫瘤診療中心��,以多學(xué)科協(xié)作(MDT)為基礎(chǔ)��,旨在為兒童血液病及腫瘤性疾病等疑難病例提供化療��、放療、手術(shù)��、造血干細(xì)胞移植治療及護(hù)理一體化診療服務(wù)����。中心開展包括兒童白血病、再生障礙性貧血�、血小板減少癥、淋巴瘤����、髓母細(xì)胞瘤�、神經(jīng)母細(xì)胞瘤以及兒童先天免疫缺陷病及遺傳代謝性疾病等罕見病的診治工作��。
2.JAMA:久坐可顯著增高癡呆癥風(fēng)險(xiǎn)����。來自亞利桑那大學(xué)和亞利桑那阿爾茨海默病研究中心的Alexande教授團(tuán)隊(duì)在《美國醫(yī)學(xué)會雜志》(JAMA)發(fā)表的一項(xiàng)研究論文表明,老年人久坐時(shí)間越長�,特別是每天久坐10小時(shí)及以上�,發(fā)生全因癡呆癥的風(fēng)險(xiǎn)就越高。數(shù)據(jù)顯示����,相比于久坐行為中平均9.27h/d的受試者,平均10h/d��、12h/d和15h/d的受試者癡呆癥風(fēng)險(xiǎn)分別升高了8%����、63%和221%��。久坐行為中平均9.27h/d�、10h/d��、12h/d和15h/d的癡呆癥發(fā)病率分別為7.49/1000人-年�、8.06/1000人-年、12/1000人-年和22.74/1000人-年����。
3.日本便當(dāng)食物中毒者增至約300人。20日����,日本青森縣八戶市保健所發(fā)布消息稱�,由當(dāng)?shù)乇惝?dāng)公司“吉田屋”引發(fā)的大規(guī)模食物中毒事件,已有295人出現(xiàn)癥狀�,涉及范圍增至1都23縣。據(jù)報(bào)道��,“吉田屋”為八戶當(dāng)?shù)氐囊患冶惝?dāng)生產(chǎn)廠家�,涉事這批便當(dāng)主要食材為海鮮��,保質(zhì)期到9月16日和17日�。這批便當(dāng)在東北和關(guān)東地區(qū)的超市����、大型活動和車站售出后,大量消費(fèi)者出現(xiàn)不同程度的腹瀉和嘔吐癥狀��。
評審動態(tài)
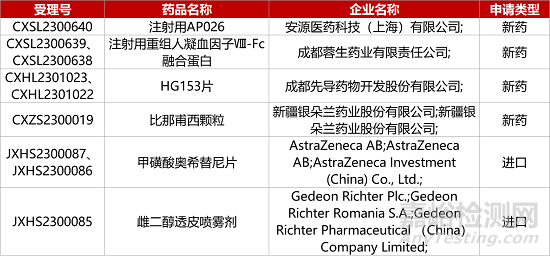
1. CDE新藥受理情況(09月21日)
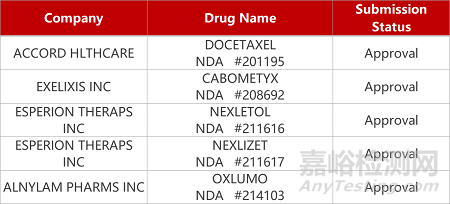
2. FDA新藥獲批情況(北美09月20日)