無菌工藝模擬驗證的邊界取決于不同工序生產(chǎn)操作步驟是否屬于無菌操作的范疇�����,包括且不局限于人員�����、物料�����、設(shè)備���、公用系統(tǒng)�����、環(huán)境等�����。無菌工藝模擬驗證的范圍應(yīng)從無菌工藝的第一步開始��,經(jīng)除菌過濾或其他方法獲取無菌藥液�����,直至無菌產(chǎn)品完全密封結(jié)束���。
二、無菌工藝模擬驗證的一致性或代表性
無菌工藝模擬的前提是需要對生產(chǎn)工藝有深入的認識和理解��,能夠識別和判斷風(fēng)險點的具體位置��。無菌工藝模擬驗證工藝應(yīng)該與產(chǎn)品生產(chǎn)工藝盡可能保持一致���,如何評價模擬驗證工藝與生產(chǎn)工藝之間的一致性或模擬工藝驗證的代表性���,需要針對生產(chǎn)工藝和模擬驗證工藝作對比分析,從產(chǎn)品無菌生產(chǎn)的角度評估兩者之間差異所帶來的潛在風(fēng)險�����,最后確定模擬驗證工藝���。
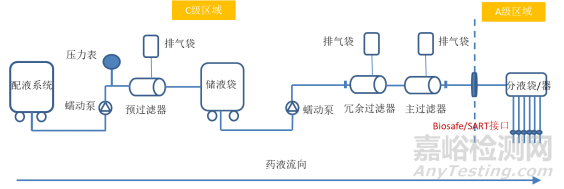
以某個無菌水針產(chǎn)品為例��,采用隔離器的一次性系統(tǒng)配液和灌裝系統(tǒng)設(shè)計���,整個工藝中���,藥液從配制開始,經(jīng)過預(yù)過濾和除菌過濾��,然后傳輸至隔離器內(nèi)分液袋中���,通過蠕動泵完成藥液灌裝��,工藝流程圖如下所示�����。
圖:一次性系統(tǒng)工藝流程圖
工藝模擬驗證前需要對不同的操作單元作具體的對比分析�����,比如除菌過濾操作單元��,使用前包含過濾器完整性的在線檢測�����、工藝中存在緩沖液浸潤除菌過濾并排放至廢液袋的操作���、一次性儲液袋潤洗等無菌操作�����,工藝模擬過程都應(yīng)該盡可能模擬�����,若無法按照正常工藝進行,至少應(yīng)該進行無菌風(fēng)險評估或模擬實
際過程的操作動作���,最大限度模擬到工藝過程中潛在的無菌操作風(fēng)險��。
三�����、無菌工藝模擬驗證的考慮要點
從生產(chǎn)工藝流程而言���,無菌工藝模擬驗證包括前準(zhǔn)備、培養(yǎng)基配制��、除菌過濾、灌裝��、(凍干)��、軋蓋和燈檢�����。每一個工藝環(huán)節(jié)的模擬想要實現(xiàn)與生產(chǎn)工藝完全一致���,甚至都要模擬到“最差條件”是不可能的��,但是我們可以做到工藝模擬能夠代表實際生產(chǎn)工藝�����,保障生產(chǎn)過程的無菌性���。因此,無菌工藝模擬驗證的設(shè)計就顯得尤為重要�����,實踐過程中需要考慮的要點如下:
前準(zhǔn)備:環(huán)境清潔消毒后有效期��、設(shè)備、器具和內(nèi)包材滅菌后的存放有效期應(yīng)提前在模擬驗證計劃階段考慮���,盡可能滿足多各因素在接近效期前實施�����,即考察不同條件下的“最差條件”��。
培養(yǎng)基的選擇和處理:培養(yǎng)基分為動物源性或植物源性兩種�����,動物源性培養(yǎng)基應(yīng)考慮培養(yǎng)基引入外源性病毒污染的風(fēng)險,如BSE(可傳染性海綿腦?�。?TSE(瘋牛?����。┑娘L(fēng)險���。培養(yǎng)基目前常用的處理方式為高溫濕熱滅菌���,包括濕熱滅菌或高溫注射用水配制���。
培養(yǎng)基配制:盡管培養(yǎng)基配制過程為非無菌操作,實際工藝模擬驗證過程中也需要考察和覆蓋生產(chǎn)工藝中藥液配制的最長暴露時限�����,同時除菌過濾前還應(yīng)該進行取樣檢測培養(yǎng)基pH和微生物限度��,用于數(shù)據(jù)收集和后期可能出現(xiàn)問題后的原因調(diào)查�����。如采用間歇式除菌過濾�����,則需要增加中間過程取樣或至少在除菌過濾結(jié)束前對培養(yǎng)基取樣���,用于測試微生物水平��。
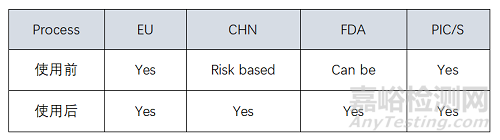
除菌過濾:不管工藝采取多級過濾還是冗余過濾系統(tǒng)�����,均需要考慮除菌過濾后藥液管路的密封性/無菌性��。除此之外��,過濾器SIP前后完整性測試需要結(jié)合相關(guān)法規(guī)和指南要求執(zhí)行��,不同國家或地區(qū)對過濾器使用簽后完整性要求如下:
如果采用不銹鋼配液系統(tǒng)生產(chǎn)工藝��,還應(yīng)考慮初始罐體保壓和罐內(nèi)無菌性的驗證���。
取樣:無菌工藝模擬過程中通常會進行除菌過濾后中間產(chǎn)品取樣���,證明除菌過濾系統(tǒng)的無菌性,無論是不銹鋼儲液罐還是一次性儲液袋均應(yīng)考慮設(shè)計無菌取樣的操作���,如增加無菌取樣接口或一次性無菌取樣袋���。
灌裝:模擬灌裝過程應(yīng)考察到生產(chǎn)過程灌裝的最大速率和最小速率���,盡可能覆蓋到容器的最長暴露時長“最差條件”���。如生產(chǎn)線上有多個容器規(guī)格,可以參考GMP指南無菌附錄章節(jié)要求���,通過風(fēng)險評估選擇一大一小進行工藝模擬���。灌裝結(jié)束后�����,系統(tǒng)中剩余培養(yǎng)基也應(yīng)進行取樣培養(yǎng)���,以備后期可能出現(xiàn)的染菌調(diào)研使用。
凍干(適用于凍干制劑):凍干工藝模擬通常不模擬冷凍過程��,避免培養(yǎng)基凍結(jié)�����,抑制微生物生長�����。凍干工藝模擬需要重點考慮和關(guān)注真空度和維持時間的代表性�����,比如模擬生產(chǎn)過程抽真空(GMP無菌指南推薦真空度為500mbar)和摻氣過程(無菌空氣/氮氣/惰性氣體)空氣擾動�����、維持時間以及循環(huán)次數(shù),循環(huán)次數(shù)需要企業(yè)通過風(fēng)險評估或與測試進行確定�����。
軋蓋:軋蓋過程應(yīng)按照正常生產(chǎn)過程開展密封完整性檢查�����。軋蓋結(jié)束后���,所有軋蓋剔廢樣品均需要進行燈檢��,判斷密封完整性�����。
燈檢:工藝模擬樣品燈檢僅需要檢查容器的外觀和密封完整性�����,除存在明顯密封完整性缺陷樣品可以剔除外(需要進行確認),其余所有樣品均應(yīng)該進行培養(yǎng)���。
工藝時限:各工序的工藝時限模擬應(yīng)涵蓋工藝規(guī)定的最長時間���,包括:除菌過濾時限���、灌裝持續(xù)時間、軋蓋時限等�����。
四��、總結(jié)
上述內(nèi)容主要從無菌工藝的角度分享了不同操作單元在模擬驗證實踐過程中的一些注意事項���。工藝模擬應(yīng)該以生產(chǎn)工藝為核心�����,切實結(jié)合無菌生產(chǎn)過程所涉及到的環(huán)境��、設(shè)備�����、人員���、操作時限等因素���,針對性地開展工藝模擬驗證,避免出現(xiàn)工藝模擬無法代表生產(chǎn)工藝的情形�����。
參考資料
1.藥品GMP指南(第2版) 無菌制劑��。
2.PDA TR22 Process Simulation for Aseptically Filled Products��。