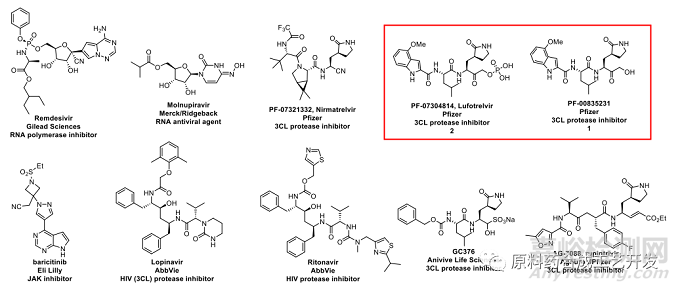
分享一下Lufotrelvir工藝研究的文獻(xiàn)
最初路線
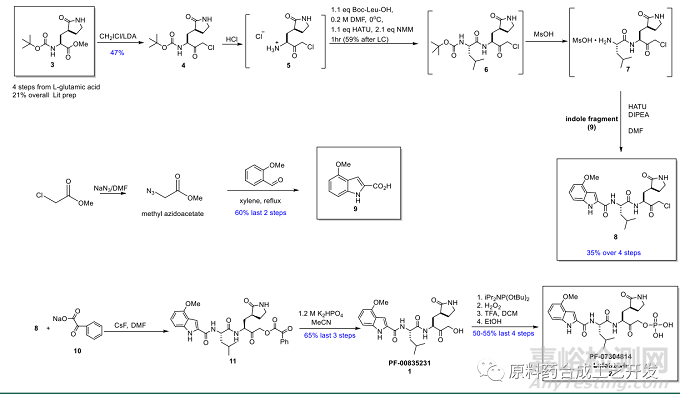
化合物3,先制備氯代酮4����,去Boc得到化合物5,構(gòu)建酰胺鍵得到化合物6�,再脫Boc得到化合物7
化合物7和化合物9,經(jīng)酸胺縮合得到化合物8
化合物8�,和帶拉電子基團(tuán)的羧酸鈉反應(yīng),然后水解引入羥基得到化合物1���,再引入磷酸酯基團(tuán)得到化合物2。
化合物9的制備���,安全性不好
化合物3制備化合物4���,放大重現(xiàn)性不好
化合物2因?yàn)楣に噯栴},穩(wěn)定性不好�。
多步中間體存在穩(wěn)定性問題����,控制點(diǎn)不夠����。
改進(jìn)路線
思路:改變片段的拼接順序,最后引入化合物3片段���,更多的結(jié)晶分離點(diǎn)����,易于質(zhì)量控制����。
吲哚環(huán)酰胺片段13的研究
路線A
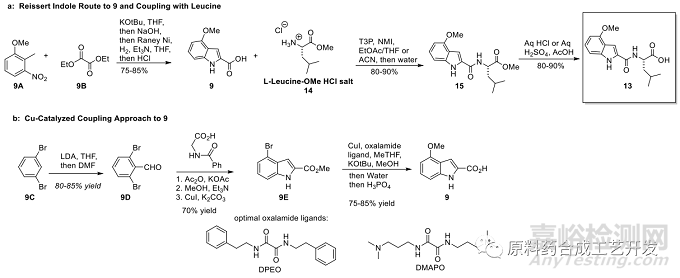
化合物9A和草酸二乙酯,先叔丁醇鉀條件發(fā)生親核取代�,再水解反應(yīng),雷尼鎳還原硝基后����,酸處理關(guān)環(huán)得到吲哚環(huán)羧酸9
再和化合物14進(jìn)行酸胺縮合得到化合物15,堿的選擇是關(guān)鍵���,三乙胺也會(huì)導(dǎo)致消旋����,吡啶或者N-甲基咪唑消旋風(fēng)險(xiǎn)低。
水解甲酯�,同樣不能選擇堿性,采用酸性水解�,溫度不能高,高了會(huì)導(dǎo)致甲醚鍵斷裂����。
路線B
路線A路線可行,但是供應(yīng)商不能穩(wěn)定供貨���,開發(fā)了路線B
化合物9C在LDA條件下與DMF作用引入甲?;?D����,再銅催化關(guān)吲哚環(huán)得到化合物9E
反應(yīng)的關(guān)鍵是Ullmann反應(yīng)引入甲氧基,配體很關(guān)鍵���,研究發(fā)現(xiàn)草酸酰胺的配體效果更有效���,DEPO或者DMAPO�。
內(nèi)酰胺片段5的研究
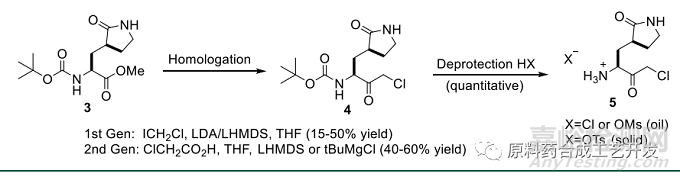
最初路線采用氯碘甲烷構(gòu)建氯代酮���,放大重現(xiàn)性不好
改用氯乙酸法,采用傳統(tǒng)反應(yīng)釜LiHMDS和叔丁基氯化鎂都可行����,但是改用流動(dòng)反應(yīng),因?yàn)殇圎}溶解度的問題�,反應(yīng)不如叔丁基氯化鎂好。
采用對(duì)甲苯磺酸去除Boc可得固體���,鹽酸或者甲基磺酸只能得到油�。
酰胺鍵8的構(gòu)建研究
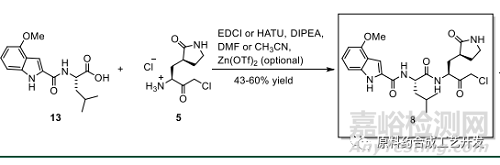
化合物13和化合物5制備化合物8
化合物13堿性環(huán)境容易消旋
最初條件采用HATU����,-20度下,滴加DIPEA����,10-20g規(guī)模可接受���,放大到500g消旋嚴(yán)重���,和DIPEA滴加速率導(dǎo)致體系pH值有關(guān)�。
繼續(xù)研究采用Zn(OTf)2 和EDCI組合���,可以在一定程度抑制消旋����,放大到600g�,供毒理批物料需求。
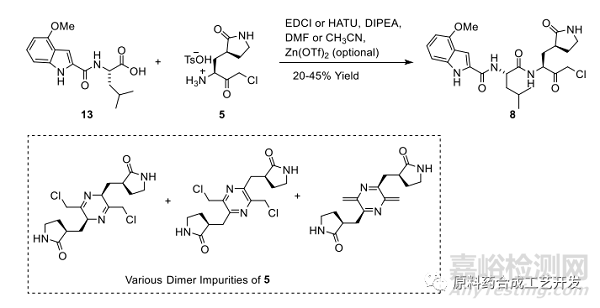
工藝的繼續(xù)研究
雖然采用采用Zn(OTf)2試劑可以抑制消旋雜質(zhì)���,但是化合物5自身的各種二聚雜質(zhì)很難控制����,導(dǎo)致收率很低�。
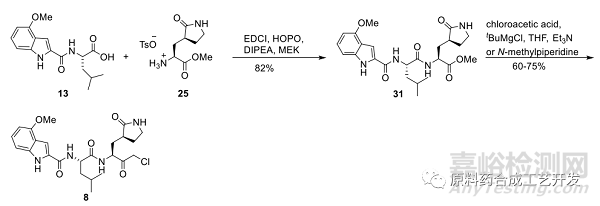
調(diào)整順序,改進(jìn)策略
采用化合物25為底物����,先和化合物13進(jìn)行酸胺縮合,再制備氯代酮���。
采用MEK或者丙酮為溶劑���,采用EDCI和HOPO組合,DIPEA為堿����,反應(yīng)結(jié)果想對(duì)最好。
化合物31質(zhì)量很好���,可直接用于下一步制備氯代酮化合物8
氯代酮8的制備研究
篩選
硫葉立德法和氯乙酸或者氯乙酸酯法�,對(duì)比后選擇氯乙酸/叔丁基氯化鎂法
研究
底物結(jié)構(gòu)中含有四個(gè)質(zhì)子���,需要消耗額外的叔丁基氯化鎂����,當(dāng)量需求大���。
大過量叔丁基氯化鎂的使用有助于脫氯雜質(zhì)的產(chǎn)生
初步研究加三乙胺可以抑制脫氯雜質(zhì)�,進(jìn)一步研究發(fā)現(xiàn)有親核性的N-methylpiperidine或者N-methylpyrrolidine更有助于抑制脫氯雜質(zhì)����。.
加料順序
底物31和氯乙酸緩慢滴加到叔丁基氯化鎂和N-甲基哌啶的THF中,有助于雜質(zhì)控制
化合物31氯乙酸/叔丁基氯化鎂制備氯代酮����,反應(yīng)過程類似依托考昔的某步反應(yīng)
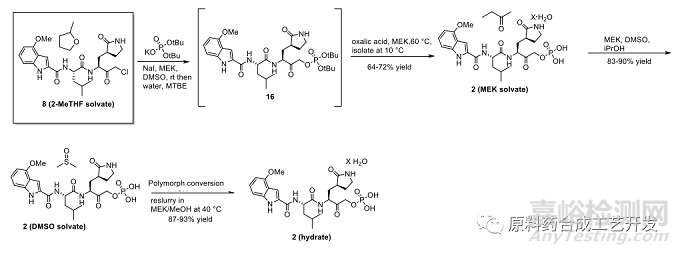
制備API的后續(xù)路線
參考文獻(xiàn):https://doi.org/10.1021/acs.oprd.2c00375