摘要
國(guó)際上主要藥品監(jiān)管機(jī)構(gòu)均發(fā)布了基于生物藥劑學(xué)分類系統(tǒng)(BCS) 的生物等效性豁免相關(guān)指導(dǎo)原則��,但具體技術(shù)要求并不完全相同���。2019 年11 月,國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)( ICH) 發(fā)布新指導(dǎo)原則《M9:基于生物藥劑學(xué)分類系統(tǒng)的生物等效性豁免》����,對(duì)藥物的生物藥劑學(xué)分類和相關(guān)生物等效性研究豁免提出統(tǒng)一技術(shù)要求����。本文介紹ICH M9 指導(dǎo)原則的主要技術(shù)要求,期望對(duì)我國(guó)基于BCS 的生物等效性豁免相關(guān)研究有所幫助�。
關(guān)鍵詞
生物藥劑學(xué)分類系統(tǒng);生物等效性豁免;生物等效性;國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)
正文
國(guó)際上主要藥品監(jiān)管機(jī)構(gòu)均發(fā)布了基于生物藥劑學(xué)分類系統(tǒng)(BCS)的生物等效性豁免相關(guān)指導(dǎo)原則����,但具體技術(shù)要求并不完全相同��。近期,國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)( ICH) 發(fā)布新指導(dǎo)原則《M9:基于生物藥劑學(xué)分類系統(tǒng)的生物等效性豁免(BiopharmaceuticsClassification System - based Biowaivers)》( 以下簡(jiǎn)稱“M9 指導(dǎo)原則”)�����,對(duì)藥物的生物藥劑學(xué)分類和相應(yīng)生物等效性研究豁免提出統(tǒng)一技術(shù)要求。本文介紹該指導(dǎo)原則的發(fā)展過(guò)程和主要技術(shù)要求��,以期對(duì)我國(guó)基于BCS 的生物等效性豁免相關(guān)研究有所裨益��。
1����、發(fā)展過(guò)程
BCS 由AMIDON 等[1]于1995 年提出,將藥物按照其水溶性和腸道滲透性分為4 類:Ⅰ類(高溶解性�、高滲透性)、Ⅱ類( 低溶解性���、高滲透性)��、Ⅲ類( 高溶解性、低滲透性)和Ⅳ類( 低溶解性�����、低滲透性),用以預(yù)測(cè)藥物的口服吸收���。此后�����,美國(guó)食品藥品管理局(FDA)���、歐洲藥品管理局( EMA)�����、世界衛(wèi)生組織(WHO)�����、我國(guó)國(guó)家藥品監(jiān)督管理局(NMPA)等均發(fā)布各自的指導(dǎo)原則��,允許普通口服固體制劑基于BCS 在特定條件下豁免人體生物等效性研究�����,即基于BCS 的生物等效性豁免[2 - 4]��。
其基本原理是,藥物的口服吸收取決于其在胃腸道的溶解性/溶出度和滲透性����,如果相同藥物活性成份在整個(gè)胃腸道環(huán)境中具有相同的濃度- 時(shí)間曲線���,且輔料不影響吸收過(guò)程/滲透性,則其吸收程度和吸收速度也應(yīng)相同[5]����。國(guó)際上����,雖然各監(jiān)管機(jī)構(gòu)基于BCS 的生物等效性豁免均采用相同的基本原理,但具體技術(shù)要求并不完全相同[3�,5 - 6]。
ICH 是一個(gè)國(guó)際性非盈利組織,致力于推動(dòng)藥品注冊(cè)技術(shù)要求的國(guó)際統(tǒng)一���,促進(jìn)安全��、有效、高質(zhì)量藥品的開(kāi)發(fā)和上市( ICH 網(wǎng)站:https: / /www. ich. org /)�����。NMPA 于2017 年6 月成為該組織成員�。該組織協(xié)調(diào)其監(jiān)管機(jī)構(gòu)和行業(yè)成員����,建立統(tǒng)一的技術(shù)指導(dǎo)原則�,其成員均予以采納。
ICH M9 指導(dǎo)原則的起草工作于2016 年10 月啟動(dòng)�����,旨在對(duì)藥物的生物藥劑學(xué)分類和相關(guān)生物等效性研究豁免提出統(tǒng)一技術(shù)要求[7]。其專家工作組由來(lái)自包括NMPA 在內(nèi)的19 個(gè)監(jiān)管機(jī)構(gòu)����、行業(yè)協(xié)會(huì)和國(guó)際組織的共29 名專家組成。
M9 指導(dǎo)原則于2019 年11 月正式發(fā)布[8]��,由正文5 個(gè)章節(jié)( 前言�����、藥物活性成份的生物藥劑學(xué)分類��、藥物制劑基于BCS 的生物等效性豁免要求��、資料要求����、術(shù)語(yǔ)表) 和2 個(gè)附錄(Caco - 2細(xì)胞滲透性測(cè)定方法的相關(guān)考慮、關(guān)于評(píng)價(jià)輔料差異的更多信息)組成���。
與之同時(shí)發(fā)布的問(wèn)答文件對(duì)該指導(dǎo)原則中部分問(wèn)題作了進(jìn)一步說(shuō)明[9]��。目前�����,M9 指導(dǎo)原則已進(jìn)入ICH 程序的第5 階段�����,即實(shí)施階段�,后續(xù)將由ICH 區(qū)域內(nèi)各監(jiān)管機(jī)構(gòu)按其行政程序予以實(shí)施�����。
內(nèi)容由凡默谷小編查閱文獻(xiàn)選取�����,排版與編輯為原創(chuàng)�。如轉(zhuǎn)載����,請(qǐng)尊重勞動(dòng)成果��,注明來(lái)源于凡默谷公眾號(hào)��。
2、基于BCS 的生物等效性豁免適用范圍
2 M9 指導(dǎo)原則指出,基于BCS 的生物等效性豁免可用于證明人體生物等效性,其應(yīng)用可能包括不同研發(fā)階段和商業(yè)化產(chǎn)品間的比較����、上市后變更���、符合當(dāng)?shù)胤ㄒ?guī)的仿制藥申請(qǐng)等�����。基于BCS 的生物等效性豁免僅適用于全身作用的普通口服固體劑型或混懸劑�。窄治療指數(shù)的藥物制劑不適用該豁免方法���。固定劑量復(fù)方制劑可適用該豁免方法���,前提是其全部活性成份均符合指導(dǎo)原則相關(guān)標(biāo)準(zhǔn)����。
3�����、藥物活性成份的生物藥劑學(xué)分類
M9 指導(dǎo)原則要求��,對(duì)于基于BCS 的生物等效性豁免,藥物活性成份應(yīng)具有高溶解性且具有高滲透性(BCS Ⅰ類) 或低滲透性(BCS Ⅲ類)�,受試制劑和參比制劑的活性成份應(yīng)完全相同���。
若受試制劑和參比制劑活性成份的鹽型不同��,但均屬于BCS Ⅰ類,也可能適用該豁免方法��。但若受試制劑活性成份與參比制劑相比����,存在酯���、醚��、異構(gòu)體���、異構(gòu)體混合物����、復(fù)合物或衍生物的不同���,則不適用該豁免方法����。
3. 1 溶解性
M9 指導(dǎo)原則要求�,如果單次治療的最高劑量在37 ± 1 ℃ 下完全溶于不超過(guò)250 mL 的pH 范圍在1. 2 ~ 6. 8的水性介質(zhì)中,則認(rèn)為該藥物活性成份具有高溶解性����。若單次治療的最高劑量不符合此標(biāo)準(zhǔn)�,但參比制劑的最高規(guī)格在上述條件下完全溶解�,在提交額外支持?jǐn)?shù)據(jù)的前提下,也可適用基于BCS 的生物等效性豁免����。例如,在涵蓋單次治療最高劑量的劑量范圍內(nèi)證明線性藥代動(dòng)力學(xué)(即AUC 和Cmax)���。
申請(qǐng)人應(yīng)通過(guò)試驗(yàn)使用至少3 種緩沖液確定藥物活性成份的溶解度�,包括pH 1. 2�、pH 4. 5 和pH 6. 8。此外�����,若藥物活性成份的最低溶解度所對(duì)應(yīng)的pH 在上述指定pH 范圍內(nèi)�����,則應(yīng)評(píng)價(jià)該pH 下的溶解度����。
可使用搖瓶法或其他方法開(kāi)展平衡溶解度試驗(yàn)�,也可以考慮其他溶解度試驗(yàn)��,例如��,在250 mL 體積中考察單次治療的最高劑量能否完全溶解����。應(yīng)采用經(jīng)適當(dāng)驗(yàn)證的試驗(yàn)方法和藥典介質(zhì),在每種溶解條件/pH下至少平行測(cè)定3 個(gè)樣本�����。藥物活性成份的溶解性將以pH 1. 2 ~6. 8 范圍內(nèi)測(cè)得的最低溶解度計(jì)算���。
關(guān)于文獻(xiàn)數(shù)據(jù)����,M9 指導(dǎo)原則指出��,除試驗(yàn)數(shù)據(jù)外��,也可提供文獻(xiàn)數(shù)據(jù)來(lái)證明和支持溶解性分類�����,需注意的是�,同行評(píng)議論文可能缺少必要的試驗(yàn)細(xì)節(jié),導(dǎo)致無(wú)法評(píng)價(jià)研究質(zhì)量���。同時(shí)�,該指導(dǎo)原則的問(wèn)答文件中進(jìn)一步說(shuō)明��,應(yīng)提交試驗(yàn)數(shù)據(jù)確定藥物活性成份的溶解性����,可提交文獻(xiàn)數(shù)據(jù)作為進(jìn)一步支持。
3. 2 滲透性
M9 指導(dǎo)原則要求���,應(yīng)優(yōu)先選擇人體藥代動(dòng)力學(xué)研究的吸收程度數(shù)據(jù)來(lái)確定滲透性����,例如�,絕對(duì)生物利用度或物質(zhì)平衡數(shù)據(jù)。如果絕對(duì)生物利用度≥85%���,則認(rèn)為具有高滲透性�。
或者,如果≥85%的給藥劑量在尿中以原型藥物回收�,或以原型藥物、1 相氧化代謝物和2 相結(jié)合代謝物的總和回收���,也認(rèn)為具有高滲透性���。有可能接受公開(kāi)文獻(xiàn)中的人體數(shù)據(jù)(例如產(chǎn)品信息和生物利用度研究),需注意的是���,同行評(píng)議論文可能缺少必要的試驗(yàn)細(xì)節(jié)�,導(dǎo)致無(wú)法評(píng)價(jià)研究質(zhì)量�。
該指導(dǎo)原則指出,也可采用經(jīng)驗(yàn)證和標(biāo)準(zhǔn)化的體外Caco - 2 細(xì)胞方法評(píng)價(jià)滲透性���。若采用該方法�����,應(yīng)證明滲透性不依賴于主動(dòng)轉(zhuǎn)運(yùn)����。并且�����,Caco - 2 滲透性測(cè)定結(jié)果應(yīng)與已知的人體藥代動(dòng)力學(xué)數(shù)據(jù)一同分析討論��。
此外�����,M9 指導(dǎo)原則要求���,若使用物質(zhì)平衡研究(除非≥85%的給藥劑量在尿中以原型藥物回收) 或體外Caco - 2 研究來(lái)證明或支持高滲透性���,應(yīng)額外提供藥物的胃腸道穩(wěn)定性數(shù)據(jù)。若藥物存在顯著降解( > 10%)��,則無(wú)法認(rèn)為其具有高滲透性����。
4、藥物制劑基于BCS 的生物等效性豁免要求
M9 指導(dǎo)原則要求����,對(duì)于基于BCS 的生物等效性豁免,藥物活性成份應(yīng)符合溶解性和滲透性標(biāo)準(zhǔn)(BCSⅠ類和Ⅲ類)���,同時(shí)藥物制劑應(yīng)是全身作用的普通口服劑型����,且劑型和規(guī)格與參比制劑相同。
即�,不同劑型或不同規(guī)格的制劑間不適用該豁免方法。該指導(dǎo)原則的問(wèn)答文件進(jìn)一步解釋�����,即使相同的藥物活性成份����,劑型差異也會(huì)影響其體內(nèi)行為,從而可能增加錯(cuò)判生物等效性結(jié)論的風(fēng)險(xiǎn)���。無(wú)包衣片劑和非功能性包衣片劑視為相同劑型��,而片劑和膠囊視為不同劑型��。
該指導(dǎo)原則指出���,具有頰粘膜或舌下吸收的藥物制劑不適用基于BCS 的生物等效性豁免。此外�,該豁免方法僅適用于含水的給藥方式�。如果某一制劑除含水的給藥方式外����,也包括無(wú)水的給藥方式( 例如口崩片),則應(yīng)開(kāi)展無(wú)水給藥的生物等效性研究���。
4. 1 輔料
M9 指導(dǎo)原則指出,理想情況下����,受試制劑的處方組成應(yīng)與參比制劑相同。若存在差異�,則應(yīng)根據(jù)藥物性質(zhì)和輔料作用來(lái)評(píng)價(jià)其可能對(duì)藥物體內(nèi)吸收的影響?��?赡苡绊懳盏妮o料包括糖醇( 例如甘露醇����、山梨醇)和表面活性劑(例如十二烷基硫酸鈉) 等��,應(yīng)在產(chǎn)品開(kāi)發(fā)過(guò)程中予以關(guān)注�,將此類輔料的差異控制在最小程度。
該指導(dǎo)原則要求�,對(duì)于基于BCS 的生物等效性豁免�,申請(qǐng)人應(yīng)采用基于機(jī)制和風(fēng)險(xiǎn)的評(píng)價(jià)方法�,證明受試制劑與參比制劑存在的輔料差異不會(huì)影響藥物活性成份的吸收特征,即吸收速度和吸收程度�。
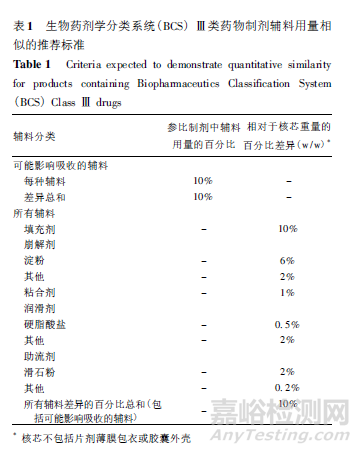
BCS Ⅰ類藥物的吸收不存在溶解性或滲透性限制。因此���,對(duì)于輔料影響吸收的風(fēng)險(xiǎn)�,BCS Ⅰ類藥物通常比其他BCS 分類要低�����。對(duì)于BCS Ⅰ類藥物���,允許輔料存在種類和用量差異���,但可能影響吸收的輔料應(yīng)種類相同且用量相似,即用量在參比制劑輔料用量的± 10%范圍內(nèi)(包括單個(gè)輔料及可能影響吸收的所有輔料的差異總和)��。
與BCS Ⅰ類藥物相比����,BCS Ⅲ類藥物滲透性不高,且可能存在部位特異性的吸收���,輔料可通過(guò)更多途徑影響其吸收��。對(duì)于BCS Ⅲ類藥物���,要求所有輔料應(yīng)種類相同且用量相似( 薄膜包衣或膠囊殼輔料除外)���。
若著色劑和矯味劑在處方中占非常小量,可允許其存在差異�。BCS Ⅲ類藥物制劑輔料用量相似的推薦標(biāo)準(zhǔn)詳見(jiàn)表1����。對(duì)于用量相似而言,BCS Ⅲ類藥物制劑的輔料差異不應(yīng)超出表中目標(biāo)值����。
4. 2 體外溶出
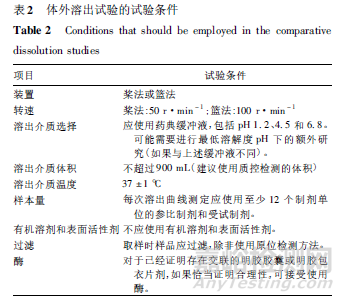
M9 指導(dǎo)原則要求,對(duì)于基于BCS 的生物等效性豁免�����,應(yīng)采用1 批能代表擬定商業(yè)生產(chǎn)過(guò)程的受試制劑與參比制劑進(jìn)行體外溶出曲線比較��。通常受試制劑應(yīng)來(lái)自不少于商業(yè)生產(chǎn)規(guī)模1 /10 或100000 個(gè)制劑單位的批次����,以較大者為準(zhǔn)�����。應(yīng)采用藥典裝置����,使用表2 中的試驗(yàn)條件測(cè)定溶出曲線�。
對(duì)于BCS Ⅰ類藥物基于BCS 的生物等效性豁免,在全部規(guī)定條件下��,受試制劑和參比制劑均應(yīng)具有非??焖?≤15 分鐘內(nèi)平均溶出百分比≥85%) 的體外溶出,或快速(≤30 分鐘內(nèi)平均溶出百分比≥85%)且相似的體外溶出���。
若一種制劑為非??焖偃艹?���,而另一種為快速溶出,則應(yīng)證明溶出曲線的相似性����。對(duì)于BCS Ⅲ類藥物基于BCS 的生物等效性豁免���,在規(guī)定條件下,受試制劑和參比制劑均應(yīng)具有非?���?焖俚捏w外溶出。
應(yīng)使用相似因子f2 比較溶出曲線的相似性��。若f2 值≥50���,則認(rèn)為兩條溶出曲線具有相似性�。若受試制劑和參比制劑均在15 分鐘內(nèi)溶出不少于85%的藥物標(biāo)示量���,則認(rèn)為溶出曲線具有相似性,不必進(jìn)行f2法比較����。
此外,M9 指導(dǎo)原則中明確指出�,對(duì)于非單一規(guī)格的藥物制劑,每個(gè)規(guī)格應(yīng)開(kāi)展獨(dú)立的生物等效性豁免評(píng)價(jià)���,即受試制劑和參比制劑應(yīng)在每個(gè)規(guī)格均進(jìn)行溶出曲線比較����。同時(shí),該指導(dǎo)原則的問(wèn)答文件中進(jìn)一步說(shuō)明��,某個(gè)規(guī)格的生物等效性豁免不能外推至其他規(guī)格���,以避免可能的誤差傳遞����。
5��、申報(bào)
5資料要求M9 指導(dǎo)原則要求����,申請(qǐng)人應(yīng)提供受試制劑及其活性成份完整的關(guān)鍵質(zhì)量屬性信息,以及盡可能多的參比制劑信息�����。應(yīng)提供全部研究方案和報(bào)告����,并詳述經(jīng)驗(yàn)證的試驗(yàn)方法。應(yīng)提供受試制劑與參比制劑所有輔料的種類差異,如適用�����,還應(yīng)提供輔料的用量差異等�����。
6���、討論
作為一種科學(xué)的替代人體生物等效性研究的體外評(píng)價(jià)方法����,基于BCS 的生物等效性豁免已得到國(guó)際主要藥品監(jiān)管機(jī)構(gòu)的廣泛接受��。該方法可避免在人體進(jìn)行不必要的臨床試驗(yàn)����,減少受試者的無(wú)益暴露,同時(shí)減少研發(fā)成本���,加快研發(fā)速度,在仿制藥和創(chuàng)新藥研發(fā)進(jìn)程中均發(fā)揮重要作用[2���,3����,6]。
在我國(guó)���,為規(guī)范仿制藥質(zhì)量和療效一致性評(píng)價(jià)工作(以下簡(jiǎn)稱“一致性評(píng)價(jià)”)����,NMPA 于2016 年5 月發(fā)布《人體生物等效性試驗(yàn)豁免指導(dǎo)原則》[4]����,首次明確了基于BCS 的生物等效性豁免的具體評(píng)價(jià)標(biāo)準(zhǔn)。
此后���,NMPA 分別于2018 年5 月和2018 年12 月發(fā)布《可豁免或簡(jiǎn)化人體生物等效性(BE) 試驗(yàn)品種》[10]和《可豁免或簡(jiǎn)化人體生物等效性(BE) 試驗(yàn)品種(第二批)》[11]��,其中有22 個(gè)品種可基于BCS 申請(qǐng)豁免人體生物等效性研究���。
目前,在藥品注冊(cè)申請(qǐng)的技術(shù)審評(píng)中�,已有基于BCS 豁免人體生物等效性研究的案例。但仍需注意的是����,基于BCS 的生物等效性豁免雖然基本原理較為簡(jiǎn)單�,實(shí)際操作卻較為復(fù)雜�����。該豁免方法不僅對(duì)試驗(yàn)條件要求較高���,而且對(duì)申報(bào)資料的完整性要求嚴(yán)格[12]��。
因此�����,建議藥品注冊(cè)申請(qǐng)人在提出基于BCS的生物等效性豁免前����,能按照相關(guān)指導(dǎo)原則的技術(shù)要求����,從溶解性、滲透性����、體外溶出和輔料等方面,充分評(píng)估生物等效性豁免的適用性�、科學(xué)性和合理性,從而避免影響生物等效性豁免的試驗(yàn)缺陷或數(shù)據(jù)缺失�。
ICH M9 指導(dǎo)原則的發(fā)布標(biāo)志著基于BCS 的生物等效性豁免技術(shù)要求已基本達(dá)成國(guó)際統(tǒng)一。該指導(dǎo)原則有望補(bǔ)充�、細(xì)化我國(guó)現(xiàn)有的生物等效性豁免技術(shù)要求,促進(jìn)仿制藥研發(fā)���,尤其是一致性評(píng)價(jià)的開(kāi)展;并可為創(chuàng)新藥上市前和上市后變更等的生物等效性豁免提供評(píng)價(jià)方法�。
對(duì)ICH 基于BCS 的生物等效性豁免技術(shù)要求的深入研究將有助于我國(guó)制藥行業(yè)更全面準(zhǔn)確的理解和運(yùn)用基于BCS 的生物等效性豁免�����,并為進(jìn)一步完善相關(guān)工作提供借鑒��。
參考文獻(xiàn):中國(guó)臨床藥理學(xué)雜志第36 卷第8 期2020 年4 月