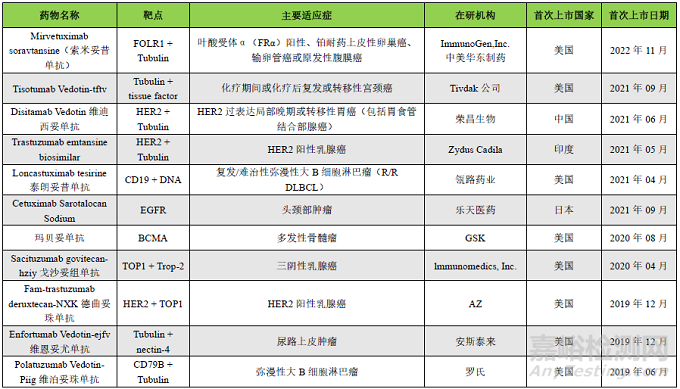
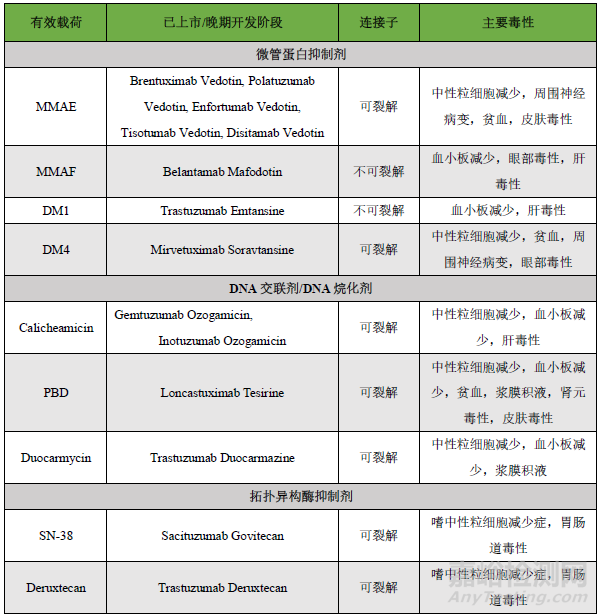
重點內(nèi)容搶先看:近年來,抗體偶連藥物(ADC)迅猛發(fā)展���,截止至2023年8月���,全球共有15款A(yù)DCs藥物上市,超過1200條藥物在研信息���。今年6月���,nature biotechnology發(fā)表了題為“ADCs’ revival”簡訊,報導(dǎo)ADC在新藥研發(fā)中的“破竹之勢”���。隨著ADC藥物在臨床應(yīng)用的深入���,有些藥物因表現(xiàn)出一定的毒副作用導(dǎo)致臨床應(yīng)用劑量減少或停止用藥。還有一些ADC藥物在上市申請過程中���,因風(fēng)險/獲益比過大或?qū)Χ拘缘膿?dān)憂而終止開發(fā)���。本文總結(jié)了導(dǎo)致ADC藥物毒性的機(jī)制���,并嘗試探討提高ADC耐受性的策略。已上市ADCs藥物匯總見下表���。
前言
在過去3年中���,F(xiàn)DA審批的ADCs藥物數(shù)量增加了2倍。在藥物上市階段���,盡管一些ADCs已經(jīng)證明了足夠的有效性和安全性���,但在臨床應(yīng)用過程中,幾乎所有ADCs都表現(xiàn)出一定的毒性���。對臨床數(shù)據(jù)分析表明���,劑量限制性毒性(DLT)因為相同的有效載荷,表現(xiàn)出相似的毒性���。DLT通常與不表達(dá)靶向抗原的細(xì)胞和組織(即脫靶毒性)有關(guān)���,并將ADC的劑量限制在最佳抗癌劑量水平以下���。在本文中���,回顧了導(dǎo)致ADC毒性的機(jī)制���,總結(jié)了常見的ADC治療相關(guān)的不良事件,并討論可以減輕ADC毒性的方法���。
ADC毒性作用機(jī)制
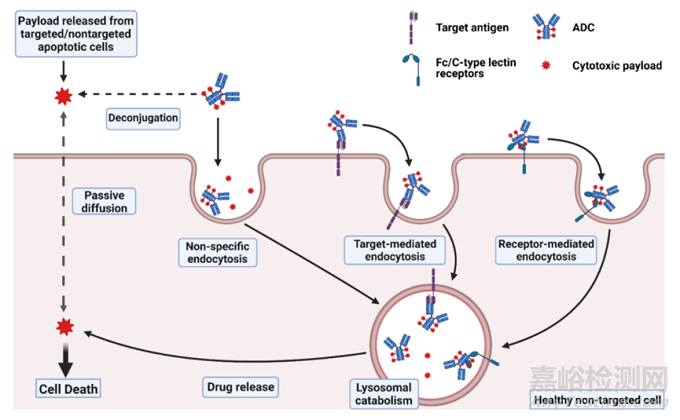
據(jù)估計���,ADC藥物進(jìn)入人體后,只有約0.1%的藥物量被傳遞到靶向病變細(xì)胞群���,絕大多數(shù)藥物在非靶向健康細(xì)胞內(nèi)分解“離位”���,由此可能導(dǎo)致不必要的毒性。未到達(dá)靶病變或靶組織的ADC毒性可分為“靶上(on-target)”或“脫靶(off-target)”���,即靶點介導(dǎo)的毒性通過ADC與健康細(xì)胞上的抗原蛋白結(jié)合���。ADC的每個組成部分���,包括抗體、連接子和有效載荷���,都可能影響ADC誘導(dǎo)的毒性的程度���。ADC的毒性作用機(jī)制見圖1。
圖1 ADC毒性作用機(jī)制(完整的ADC進(jìn)入正常細(xì)胞可能通過非特異性內(nèi)吞作用���,或通過與靶抗原或Fc/C型凝集素受體結(jié)合而內(nèi)化���。細(xì)胞外液中的ADC分子解離的有效載荷或其他靶向/非靶向凋亡細(xì)胞釋放的有效載荷可通過細(xì)胞膜被動擴(kuò)散或非特異性內(nèi)吞的方式進(jìn)入正常細(xì)胞。
“Off-Target和Off-Site”毒性:理論上���,ADC有望通過偶聯(lián)技術(shù)���,促使細(xì)胞毒性有效載荷靶向傳遞到目標(biāo)細(xì)胞來提高治療的選擇性,同時減少有效載荷到非靶向的健康組織的傳遞���,從而擴(kuò)大治療指數(shù)���。在ADC藥物開發(fā)早期���,一直以為藥物的毒性是由于正常組織會表達(dá)一定程度的靶抗原或腫瘤細(xì)胞與健康細(xì)胞中靶抗原的差異表達(dá)決定的。然而���,隨著ADC藥物臨床應(yīng)用的深入,劑量限制毒性(DLT)很少由健康組織中的靶點表達(dá)驅(qū)動���?��;仡橝DC藥物IND申報數(shù)據(jù)發(fā)現(xiàn),相同類別的鏈接子/有效載荷組成的ADC有高度相似的毒性特征���,DLT和最大耐受劑量(MTD)���。例如,含有甲基澳瑞他汀 E(MMAE)的ADC有相似的II期臨床起始劑量(1.8 mg/kg至2.4 mg/kg)���。含有MMAE的ADC均表現(xiàn)出相似的DLT(嚴(yán)重的骨髓毒性���、膿毒癥和嚴(yán)重的運動神經(jīng)病變)���。同樣,在對2010年至2014年發(fā)表的臨床ADC數(shù)據(jù)的回顧中���,也發(fā)現(xiàn)與ADC相關(guān)的普遍3/4級毒性與有效載荷類別一致���。例如,有效載荷為MMAE的ADC常見不良反應(yīng)有嚴(yán)重貧血���、中性粒細(xì)胞減少和周圍神經(jīng)病變���。有效載荷為DM1的ADC,通常會觀察到3/4級血小板減少和肝毒性���,而MMAF和DM4的ADC均有嚴(yán)重的眼部毒性���。類似于上述例子屢見不鮮。
由此可見���,ADC “Off-Site毒性”與細(xì)胞毒性有效載荷的脫靶有關(guān)���,而脫靶的有效載荷傳遞是ADC耐受性的關(guān)鍵驅(qū)動因素���,并最終決定患者的推薦劑量。當(dāng)然���,在臨床評估和使用ADC時���,靶點介導(dǎo)的毒性并不是主要問題。嚴(yán)重的靶點介導(dǎo)毒性的藥物可能在臨床前開發(fā)的早期階段被快速識別���,并最終終止開發(fā)���。
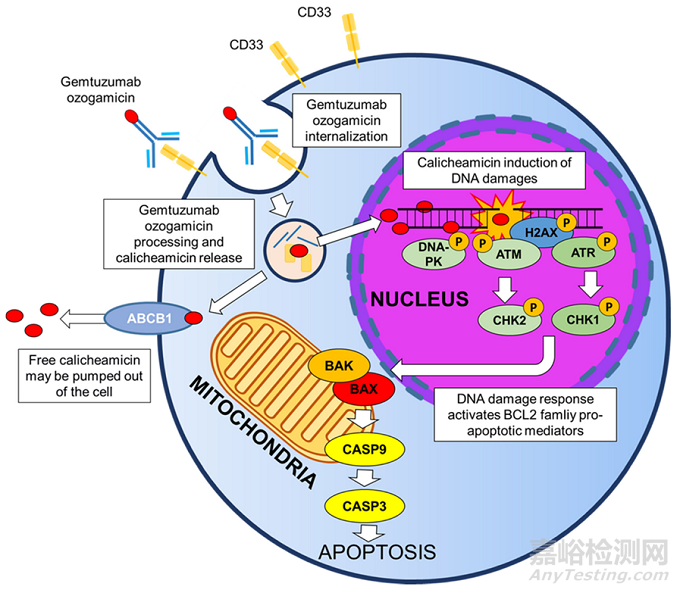
ADC有效載荷的脫靶:ADC給藥后���,釋放的有效載荷迅速進(jìn)入體循環(huán)���,當(dāng)然,也有部分有效載荷由于連接子的不穩(wěn)定有關(guān)���。連接劑主要有兩類:可裂解的和不可裂解的���?��?闪呀膺B接子旨在利用細(xì)胞內(nèi)或腫瘤細(xì)胞外環(huán)境特有的微環(huán)境,在體循環(huán)中有良好穩(wěn)定性���。但在實踐過程中發(fā)現(xiàn)���,可裂解的連接子在血漿中可迅速裂解,導(dǎo)致有效載荷在到達(dá)靶組織前過早釋放���。親脂性有效載荷通過質(zhì)膜表現(xiàn)出高滲透性���,因此,釋放的有效載荷有效地進(jìn)入非靶向細(xì)胞���,可能導(dǎo)致細(xì)胞毒性���。例如,第一代基于calicheamicin的ADC中使用的腙連接子將吉妥珠單抗與奧佐米星偶聯(lián)���,在細(xì)胞溶酶體的酸性環(huán)境中(即通過受體介導(dǎo)的內(nèi)吞作用進(jìn)入細(xì)胞)進(jìn)行釋放���。然而���,該連接體在血漿中快速水解,在ADC與靶抗原接觸之前導(dǎo)致大量的有效載荷釋放���,并減少了傳遞到靶細(xì)胞的完整ADC的比例(作用機(jī)制見圖2)���。
圖2 gemtuzumab ozogamicin作用機(jī)制
具有可裂解連接子的ADC可能被認(rèn)為是前藥,并且100%的給藥藥物(即有效載荷)最終通過連接子水解被釋放���。在大多數(shù)情況下���,可以預(yù)期有效載荷的清除(CL)過程,如腎過濾���、膽道排泄等,其中消除途徑和自由有效載荷CL的效率不受有效載荷釋放部位的影響(即在血漿中由于過早水解���,或在內(nèi)吞后的靶向或非靶向細(xì)胞內(nèi))���。基本藥代動力學(xué)理論預(yù)測���,血漿中釋放的有效載荷的累積暴露量(例如���,通過游離有效載荷血漿濃度與時間曲線下的累積面積���,AUC)是ADC或有效載荷劑量和有效載荷CL的簡單函數(shù)(即,AUC=劑量/CL)���。因此���,穩(wěn)定性較差的連接子不太可能影響血漿中有效載荷的AUC。然而���,穩(wěn)定性較差的連接子會降低靶位點中有效載荷相對于血漿的暴露比率���,因此穩(wěn)定性較差的連接子會降低on-site與off-site ADC細(xì)胞毒性的比率(相對于毒性降低療效)。隨著連接子技術(shù)的發(fā)展���,ADC的穩(wěn)定性也逐漸提高(相對于第一代ADC的穩(wěn)定性)���。然而,由于肽基連接子的血漿蛋白敏感性、含有二硫鍵或馬來酰亞胺基團(tuán)的連接子可與血漿中的活性硫醇反應(yīng)���、烷基氨基甲酸酯對血清血清酯酶敏感���,致使有效載荷在體循環(huán)中非選擇性且過早的釋放。
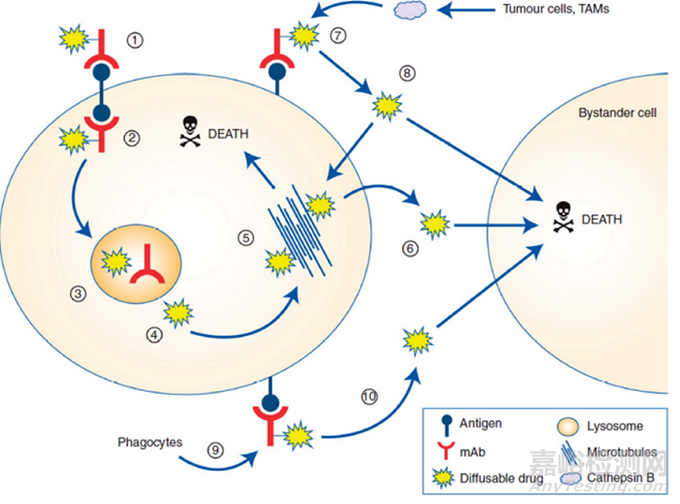
與可裂解連接子相比���,不可裂解連接子在血漿中更穩(wěn)定���,但需要ADC進(jìn)入細(xì)胞內(nèi),通過蛋白水解才能解離���、代謝���。這些代謝物通常由連接在抗體偶聯(lián)氨基酸殘基上的完整連接子有效載荷組成,如曲妥珠單抗-美坦新偶聯(lián)物解離的賴氨酸-SMCC-DM1或belantamab mafodotin解離的半胱氨酸-MC-MMAF���。這些代謝物通常帶有電荷���,細(xì)胞膜滲透性差���。使用非可裂解連接子的ADC表現(xiàn)出較高的耐受性���,這可能與釋放的有效載荷脫靶毒性降低有關(guān)���,但具有可裂解連接子的ADC通常表現(xiàn)出更好的療效,其中的原因可能是由于旁觀者效應(yīng)((bystander cell))���,即���,腫瘤細(xì)胞周圍的細(xì)胞(圖3),包括異質(zhì)性腫瘤細(xì)胞和上述的轉(zhuǎn)移瘤細(xì)胞���,這些附近的癌細(xì)胞可以是Ag+或Ag-的���。而旁觀者效應(yīng)就是藥物也能將這些細(xì)胞殺死。
圖3 ADC的旁觀者效應(yīng)示意圖
具有親脂性有效載荷和可裂解連接子的ADC���,占目前批準(zhǔn)的ADC 80%以上���,是治療與異質(zhì)性抗原表達(dá)或抗原/ADC內(nèi)化速度較慢相關(guān)瘤種的首選。除了增加抗腫瘤效力外���,旁觀者效應(yīng)還會加劇ADC的脫靶毒性���,因為正常組織中親脂性膜透性���,有效載荷的分布增加。
除了釋放的有效載荷通過質(zhì)膜被動擴(kuò)散進(jìn)入非靶向細(xì)胞外���,完整ADC的非特異性內(nèi)吞作用也可能有助于有效載荷的off-site傳遞���。非特異性的內(nèi)吞作用可能受到ADC疏水性和電荷的影響。由于ADC平臺中使用的大多數(shù)藥物連接子是高度親脂性的���,ADC的疏水性通常與藥物載量成正比(即藥物-抗體比���,DAR)。Hamblett等人的一項研究中���,對幾種含有2���、4和8的抗CD30-vc-MMAE ADC進(jìn)行了體內(nèi)藥代動力學(xué)、藥效和毒性評估���。與DAR值較低的ADC相比���,DAR值較高的ADC具有更快的全身清除率,且耐受性較低���、治療指數(shù)較窄���。同樣,Sun等人證明���,與DAR低于6的ADC相比���,DAR為10的甲烷共軛ADC的清除率高5倍,體內(nèi)療效和耐受性降低���。與DAR大于5.5(體重減輕7-9%)相比���,低DAR ADC(2和3.5)治療的小鼠體重減輕較輕(體重減輕約為4%)。此外���,他肝臟中DAR較高的ADC分布顯著升高���,可能是由于Kupffer細(xì)胞和肝竇內(nèi)皮細(xì)胞的非特異性攝取有關(guān)���。
帶正電荷的分子通常由于離子吸引到帶負(fù)電荷的細(xì)胞膜而增加了電荷介導(dǎo)的內(nèi)吞。多項臨床前研究表明���,IgG抗體的血漿清除率和組織分布與其等電點(pI)相關(guān)���。例如,有研究表明���,與中性或帶負(fù)電荷的抗體相比���,帶正電荷的抗體在小鼠肝臟和脾臟中表現(xiàn)出較高的攝取,血漿暴露減少���。
脫靶受體介導(dǎo)的ADC攝?��。鹤鳛槊庖呦到y(tǒng)的一部分,IgGs通過抗體恒定(Fc)域與免疫細(xì)胞表面表達(dá)Fc的受體相互作用���,與不同類型的免疫細(xì)胞進(jìn)行信號傳導(dǎo)���。與IgG相互作用的主要Fc受體類型之一是Fcγ受體(FcγR)���。與Fc結(jié)構(gòu)域結(jié)合可能導(dǎo)致免疫細(xì)胞中ADC的靶向非依賴性攝取和毒性���。據(jù)研究表明���,F(xiàn)cγRs可能與赫賽萊(T-DM1)治療相關(guān)的血小板減少癥有關(guān)。血小板減少被認(rèn)為是一種非靶點依賴毒性���,因為血小板和血小板形成巨核細(xì)胞(MKs)沒有T-DM1的靶點HER-2的表達(dá)���。T-DM1對成熟的MK影響最小,同時被內(nèi)化���,在分化來自人骨髓的MK時表現(xiàn)出強(qiáng)大的細(xì)胞毒性���。脫靶毒性似乎是通過FcγRIIa介導(dǎo)的,阻斷FcγRIIa結(jié)合可以抑制T-DM1的攝取���。間質(zhì)性肺?��。↖LD)/肺炎是與抗HER2 ADC治療相關(guān)的普遍危及生命的不良事件之一���。然而,ADC誘導(dǎo)的ILD的潛在原因目前尚不清楚���。在最近發(fā)表的一項研究中���,Kumagai等人證實了曲妥珠單抗在肺泡巨噬細(xì)胞中的分布較多,鑒于肺泡巨噬細(xì)胞表達(dá)過量的FcγR���,且肺泡低表達(dá)HER2���,F(xiàn)c介導(dǎo)的非特異性攝取可能有助于ADC誘導(dǎo)的ILD。對去除FcγR結(jié)合的ADC研究可能有助于確定FcγR在ADC誘導(dǎo)的ILD中的作用���。
除FcγRs外���,甘露糖受體(MR)結(jié)合和受體介導(dǎo)的內(nèi)化也是介導(dǎo)ADC脫靶肝毒性的潛在機(jī)制。受體介導(dǎo)的MR攝取是關(guān)鍵清除機(jī)制之一���。例如���,在人體中���,具有高水平甘露糖基化作用的治療性IGg的全身清除速度明顯快于正常的IGg。Kogelbegs等人證實了MR介導(dǎo)的肝竇內(nèi)皮細(xì)胞(SECs)對甘露糖化抗體酶融合蛋白MFECP1的攝取���。MR抑制劑甘露聚糖對MFECP1清除有明顯抑制作用���。此外���,與ADC治療相關(guān)的急性血小板減少癥和竇性梗阻綜合征(SOS)與肝臟SECs的變性和丟失有關(guān)���。因此,MR介導(dǎo)的肝SECs攝取可能是ADC靶向非依賴性肝毒性的主要原因���。
“Off-Site和On-Target”毒性:盡管有證據(jù)表明���,有效載荷介導(dǎo)的脫靶機(jī)制導(dǎo)致大多數(shù)ADC毒性,但ADC與健康組織中表達(dá)的靶抗原的結(jié)合也可能導(dǎo)致顯著的毒性���。例如���,40%的患者在使用恩諾單抗(enfortumab vedotin)會出現(xiàn)味覺障礙���,這是由于ADC靶點(nectin-4)在唾液腺中的表達(dá)導(dǎo)致的,事實上���,這種毒性在使用其他已批準(zhǔn)的MMAE-ADC治療的患者中并不常見���。如上示例所示,ADC產(chǎn)生的毒性與有效載荷無關(guān)���。反之亦然���,用不同有效載荷構(gòu)建的ADC表現(xiàn)出相同的毒性,由此也可推斷出該毒性是靶點介導(dǎo)的���。
值得關(guān)注的是���,應(yīng)用相同的ADC來治療不同的腫瘤可能會導(dǎo)致不同的毒性。例如���,嚴(yán)重皮疹是Glembatumumab vedotin (CDX-011)的劑量限制毒性之一���,這可能是與靶點gpNMB在皮膚中表達(dá)相關(guān)���。在給予相同劑量的CDX-011后,4%的晚期乳腺癌患者出現(xiàn)≥3級皮疹���,而晚期骨髓瘤患者出現(xiàn)率高于30%���。瘙癢和脫發(fā)在黑色素瘤患者中發(fā)生率也高于乳腺癌患者(分別為63%和65%和21%和25%)。這一現(xiàn)象背后的機(jī)制尚不清楚���,但可能與這兩種腫瘤對健康細(xì)胞中g(shù)pNMB表達(dá)有關(guān)。在另一個例子中���,LOP628���,一種抗KIT-SMCC-DM1的ADC,在一些患者中引起了危及生命的快速過敏反應(yīng)(HSR)���,導(dǎo)致終止臨床開發(fā)���。HSR的主要原因是由于抗KIT單克隆抗體共同參與KIT和FcγRs���,引起肥大細(xì)胞脫顆粒。由于這種特殊的情況提出了一種獨特的機(jī)制���,即靶點介導(dǎo)的毒性不涉及對抗原表達(dá)細(xì)胞的相關(guān)毒性���,而是通過共刺激信號通路激活免疫系統(tǒng)來發(fā)揮作用。此外���,靶細(xì)胞抗原在健康組織中的表達(dá)并不總會導(dǎo)致靶細(xì)胞毒性���。例如,膜相關(guān)粘蛋白MUC16在人眼表上皮中表達(dá)���;然而���,在臨床試驗中,使用抗MUC16 MMAE-ADC治療的患者沒有發(fā)生眼部毒性���。TROP-2在各種組織中廣泛表達(dá)���;然而���,sacituzumab-govitecan(戈沙妥珠單抗),一種結(jié)合了抗TROP2 SN-38的ADC���,其臨床毒性特征與SN-38有效載荷的臨床毒性特征基本相似���,提示其毒性機(jī)制可能由脫靶造成。戈沙妥珠單抗的低靶標(biāo)毒性可能與:(1)與腫瘤相比���,非惡性組織中TROP2表達(dá)量有限���;(2)由于其表達(dá)不足,無法誘導(dǎo)毒性反應(yīng)���;(3)與腫瘤組織相比,正常組織對SN-38有效載荷的敏感性較低���。此外���,由于戈沙妥珠單抗使用pH敏感連接子,在酸性環(huán)境中釋放有效載荷,相對于腫瘤���,在正常組織的細(xì)胞外液中pH較高���,這可能也是導(dǎo)致該ADC低靶點介導(dǎo)的毒性原因之一。
ADCs臨床毒性分析
ADC相關(guān)的劑量限制性毒性
中性粒細(xì)胞減少:中性粒細(xì)胞占粒細(xì)胞的40%至70%���,是先天免疫系統(tǒng)的重要組成部分���,中性粒細(xì)胞通過造血干細(xì)胞的分化在骨髓中快速產(chǎn)生(大約每天1011個細(xì)胞)。它們的血液循環(huán)半衰期相對較短(大約一天)���。與其他壽命較長的骨髓細(xì)胞���,包括血小板(8天)和紅細(xì)胞(120天)相比,這些獨特的特征使中性粒細(xì)胞更容易受到抗腫瘤藥物的影響���。骨髓中造血細(xì)胞分裂的中斷往往導(dǎo)致中性粒細(xì)胞的減少���,并導(dǎo)致對嚴(yán)重感染。嚴(yán)重中性粒細(xì)胞減少是一種常見的劑量限制毒性���,與大多數(shù)使用纈氨酸-瓜氨酸可切割連接物子MMAE-ADC相關(guān)���,包括brentuximab vedotin(維布妥昔單抗)���、polatuzumab vedotin(Polivy®)、enfortumab vedotin(PADCEV)和tisotumab vedotin(Tivdak™)���。
ADC相關(guān)的中性粒細(xì)胞減少與累積血漿暴露于釋放的有效載荷相關(guān)���。具有細(xì)胞膜通透性的有效載荷很容易分布到骨髓和分化的造血細(xì)胞中。骨髓室細(xì)胞外液中完整ADC的解離也可能導(dǎo)致骨髓毒性���,因為分化的中性粒細(xì)胞分泌絲氨酸蛋白酶���,可以切割A(yù)DC連接子。除了上述脫靶機(jī)制外���,靶點依賴機(jī)制也可能有助于靶向白血病抗原的ADC的中性粒細(xì)胞減少���。在最近的一項系統(tǒng)分析中���,Haubner等人量化了白血病干細(xì)胞的表達(dá)���。其中一些基因���,包括CD33、CD123和CLL-1���,不僅在白血病干細(xì)胞中有高表達(dá)水平���,而且在正常的造血干細(xì)胞/祖細(xì)胞中也有高表達(dá)水平,而CD33���、CD123和CLL-1是中性粒細(xì)胞產(chǎn)生的前體���。
血小板減少(癥):血小板減少癥是一種常見的脫靶毒性,與利用穩(wěn)定連接子(SMCC-DM1或mc-MMAF)的ADC以及DNA交聯(lián)有效載荷calichamicin有關(guān)���。例如���,99%的急性髓系白血病患者和42%的接受吉妥珠單抗奧唑米星治療的急性淋巴細(xì)胞白血病患者發(fā)生≥3級血小板減少。據(jù)報道���,14.5%接受trastuzumab emtansine治療的乳腺癌患者和21%接受belantamab mafodotin治療的多發(fā)性骨髓瘤患者出現(xiàn)≥3級血小板減少���。
血小板減少癥的確切機(jī)制尚不清楚���。通過FcγR介導(dǎo)或微胞吞作用途徑分化巨核細(xì)胞時,ADCs的非特異性攝取可能的原因之一���。然而���,ADC相關(guān)血小板減少的臨床表現(xiàn)通常發(fā)生在24 h內(nèi),明顯短于血小板8-10天的壽命���。事實上���,Guffroy等人表明,以卡奇霉素為基礎(chǔ)的ADC���,給予食蟹猴3天后表現(xiàn)出竇上皮細(xì)胞損傷���,肝竇內(nèi)血小板明積累,這與血清中血小板減少相吻合���。
周圍神經(jīng)病變:周圍神經(jīng)病變的臨床表現(xiàn)包括感覺相關(guān)癥狀���,如四肢麻木、刺痛和四肢疼痛���,或在較小程度上���,運動相關(guān)癥狀,如肌肉無力���。周圍神經(jīng)病變是一種常見的毒副作用���,與接受微管蛋白抑制化療藥物相關(guān)。類似地���,周圍神經(jīng)病變是一種劑量限制脫靶毒性���,與ADC利用微管蛋白抑制劑有效載荷連接可分裂的連接物,如vc-MMAE���、SPP-DM1和SPDB-DM4相關(guān)���。周圍神經(jīng)病變的機(jī)制是體循環(huán)釋放游離有效載荷引起的軸索性周圍神經(jīng)病有關(guān)���。盡管外周神經(jīng)元沒有顯著增殖,但功能性微管對蛋白質(zhì)從細(xì)胞體運輸?shù)竭h(yuǎn)端突觸至關(guān)重要���。因此���,通過微管蛋白抑制有效載荷破壞微管可能導(dǎo)致周圍神經(jīng)病變。
眼毒性:眼毒性是含有SPDB-DM4連接子-有效載荷的ADC關(guān)鍵脫靶劑量限制毒性之一���,如cantuzumab ravtansine���、mirvetuximab soravtansine、coltuximab ravtansine,或者含有mc-MMAF 的ADC, 如belantamab mafodotin���、AGS-16C3F���、SGN-75。眼睛對ADC細(xì)胞毒性的易感性可能是由于眼部充足的血液供應(yīng)���,快速分裂的上皮細(xì)胞群的存在���,以及靶點在眼部的高表達(dá)有關(guān)���。在臨床應(yīng)用中,ADC相關(guān)的眼部不良事件的癥狀包括視力模糊���、角膜炎、干眼癥和微囊性上皮損傷���。與aADC相關(guān)的眼部毒性的機(jī)制目前尚不清楚���。也有專家認(rèn)為通過大胞吞作用對完整ADC的非特異性攝取是ADC脫靶眼毒性的機(jī)制。下表總結(jié)了與ADC治療相關(guān)的常見劑量限制毒性���。
表1 與有效載荷相關(guān)的劑量限制毒性
減少毒性的策略
含有抑制有絲分裂有效載荷ADC的高損耗率是導(dǎo)致臨床試驗毒副作用的主要原因���。往往劑量的升高,在增加毒副作用的同時���,療效也有所提高���。但升高劑量���,危及生命的發(fā)生率增加,臨床開發(fā)受到一定限制���。例如���,vadastuximab talirine,CD33 PBD-ADC���,在AML患者中達(dá)到了70%的完全緩解率���;然而,由于發(fā)生了一些與治療相關(guān)的致命事件���,vadastuximab talirine的臨床開發(fā)已終止。FDA的一項分析發(fā)現(xiàn)���,2013年至2017年間���,針對PBD偶聯(lián)的ADC,47%的新藥申請已經(jīng)停止���,其原因主要是出于安全考慮���。這些結(jié)果表明,由于ADC的毒副作用���,使其臨床應(yīng)用的劑量低于有效劑量���,從而限制了ADC的臨床開發(fā)���。
有效載荷/連接子偶聯(lián)技術(shù):采用傳統(tǒng)的氨基賴氨酸殘基或巰基半胱氨酸殘基非特異性偶聯(lián)方法導(dǎo)致DAR和疏水性具有較大的異質(zhì)性。載藥范圍從無負(fù)載(DAR = 0)到高負(fù)載ADC(DAR≥6)���。高負(fù)載的ADC在血漿中不穩(wěn)定,并在肝臟中表現(xiàn)出較高的非特異性攝取率���,導(dǎo)致脫靶毒性增加���。隨著技術(shù)迭代,已經(jīng)開發(fā)出來DAR值較為接近的ADC。第一個位點特異性偶聯(lián)策略是由Junutula等人開發(fā)的���,通過定點偶聯(lián)將有效載荷連接到抗體CH1結(jié)構(gòu)域Ala114位置的半胱氨酸殘基上。通過基因工程在抗體的特定點插入半胱氨酸殘基���,然后將將半胱氨酸的巰基(-SH)和毒素偶聯(lián)���,形成位點專一的抗體偶聯(lián)藥物���。這種技術(shù)被稱為Thiomab 定點偶聯(lián)���。
除了位點特異性偶聯(lián)外,經(jīng)修飾改良的連接子還可以改變ADC的疏水性���,降低毒性。連接子聚乙二醇化增加了ADC的親水性���,從而提高了PK���、耐受性和療效。自裂解連接劑(self-immolative linker)的發(fā)展也提高了ADC的穩(wěn)定性和耐受性���。20世紀(jì)80年代初���,Carl等人開發(fā)了paraaminobenzyloxycarbonyl(PABC)自裂解連接劑,用于前藥設(shè)計���。從那時起,PABC連接子被廣泛應(yīng)用于ADC���,特別是MMAE偶聯(lián)的ADC���。ADC內(nèi)化到靶細(xì)胞后���,被溶酶體酶裂解���,vc-PAB-MMAE連接子/有效載荷中的PABC間隔層經(jīng)過級聯(lián)分解反應(yīng)���,促進(jìn)細(xì)胞內(nèi)MMAE的釋放���。與早期可裂解連接子相比���,vc-PABC連接子具有優(yōu)越的等離子體穩(wěn)定性和更好的毒性,如基于卡奇霉素的ADC中使用的pH敏感連接子或基于DM1的ADC中使用的含有二硫鍵連接子���,該連接子技術(shù)已經(jīng)取得了成功,在FDA批準(zhǔn)的12個ADC中有4個基于MMAE-ADC使用該連接子���。此外���,PABC連接子也被用于基于PBD ADC的開發(fā)。最近���,Pillow等人開發(fā)了復(fù)雜的自裂解連接劑���,使細(xì)胞毒性有效載荷能夠直接偶聯(lián)到工程化半胱氨酸殘基上(圖4)。工程化半胱氨偶聯(lián)可以使得細(xì)胞毒性載荷均勻分布在整個ADC���。IgG類抗體含有8個半胱氨酸鍵,可以通過特異性工程獲得DAR值為2-4的ADC類藥物���。輝瑞等多家公司都使用該技術(shù)作為ADC藥物偶聯(lián)方式���。與傳統(tǒng)ADC相比���,這些ADC在臨床前階段顯示出巨大的潛力和耐受性。與傳統(tǒng)的肽-PABC連接子技術(shù)相比���,該技術(shù)提高了PBD-ADCs的耐受性���。傳統(tǒng)的肽-ADC和自裂解二硫醚-ADC均表現(xiàn)出相似的體內(nèi)效價。但就毒副作用而言���,自裂解ADC在大鼠中MTD高達(dá)10 mg/kg���,但用5 mg/kg劑量的肽-ADC干預(yù)的動物體重明顯減輕。
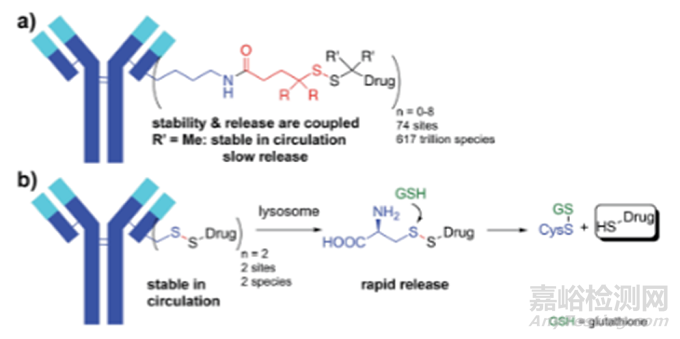
圖4 含S-S鍵自裂解連接子的ADC
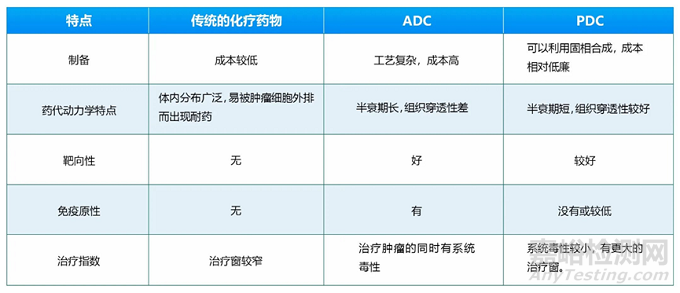
抗體修飾:由于大多數(shù)ADC的靶點在健康組織中也有一定程度的表達(dá)���,ADC結(jié)合在這些組織中傳遞細(xì)胞毒性有效載荷可導(dǎo)致“on-target off-site”毒性���。為了減少on-target毒性���,多肽偶聯(lián)藥物(PDC)被開發(fā)出來���,PDC與ADC有異曲同工之妙���,但PDC則在某種程度上克服ADC的一些缺陷���。與ADC藥物相比,PDC藥物分子量更小���,具有更好的組織穿透性,沒有免疫原性或較低���;另外與抗體復(fù)雜的生產(chǎn)工藝相比���,PDC更易合成、純化和鑒定���,成本也較低。近年來���,隨著環(huán)化技術(shù)���、噬菌體展示技術(shù)和mRNA展示技術(shù)應(yīng)用于靶向肽的篩選���, PDC藥物的開發(fā)迎來了加速發(fā)展。PDC有望成為繼小分子靶向藥���、抗體藥物、ADC之后的下一代靶向藥物���。PDC與傳統(tǒng)化療藥物和ADC的比較見下表
表2 PDC與傳統(tǒng)化療藥物和ADC的比較
另一種降低on-target毒性的方法是通過開發(fā)雙特異性抗體���。這種方法增強(qiáng)了選擇性,因為ADC結(jié)合只在兩種抗原高共表達(dá)的細(xì)胞上觀察到���。研究表明,與HER2+/EGFR-或HER2-/EGFR+細(xì)胞相比���,抗HER2/EGFR雙特異性抗體對HER2+/EGFR+細(xì)胞的體外結(jié)合選擇性顯著提高。
優(yōu)化給藥方案:gemtuzumab ozogamicin最初于2001年被批準(zhǔn)用于治療CD33陽性AML���,劑量為9 mg/m2���,至少間隔兩周。然而���,在該給藥頻率與劑量水平下觀察到嚴(yán)重毒性反應(yīng)���,包括血小板減少(99%)���、中性粒細(xì)胞減少(97%)���、≥3級高膽紅素血癥(23%)和≥3級丙氨酸轉(zhuǎn)氨酶或天冬氨酸轉(zhuǎn)氨酶水平升高,但療效沒有顯著改善���。因此,gemtuzumab ozogamicin于2010年退出市場���。最近���,引入了ADC的分級給藥���,患者在給藥周期的第1、第4和第7天接受9 mg/m2劑量���,超過3次3 mg/m2劑量���,毒性反應(yīng)更小���。gemtuzumab ozogamicin的PK/PD分析表明���,其毒性是由峰值血漿濃度(Cmax)驅(qū)動的,而其療效是由暴露(AUC)驅(qū)動的���。
總結(jié)
ADC 藥物設(shè)計的本質(zhì)是利用抗體的高選擇性靶向運輸能力將具有生物學(xué)效應(yīng)的小分子藥物���,如細(xì)胞毒小分子藥物高效地遞送至病灶發(fā)揮治療作用,既是一種新型藥物分子���,又是一種靶向遞送系統(tǒng)���。在這一體系內(nèi)���,抗體���、鏈接體、小分子以及偶聯(lián)技術(shù)等關(guān)鍵要素都需要作為一個整體來綜合考慮���,針對靶點的生物學(xué)特征以及疾病的特性和機(jī)理���,選擇合適的組件和技術(shù)對于開發(fā)成功的ADC藥物至關(guān)重要���。為了進(jìn)一步發(fā)掘ADC藥物的潛力國內(nèi)外在各個關(guān)鍵要素上都正在進(jìn)行大量的研究為開發(fā)新一代的ADC藥物持續(xù)充實工具庫���,并提供源源不斷的新思路。這些新思路包括:選擇靶向腫瘤微環(huán)境的抗體并結(jié)合使用細(xì)胞外釋放機(jī)制的鏈接體藥物���,解決靶點相關(guān)的耐藥性;使用分子質(zhì)量較小的抗體片段或者納米抗體開發(fā)ADC���,提高腦瘤組織穿透力;選擇親水性更好的鏈接體改善ADC的載藥量和理化性質(zhì): 使用不同作用機(jī)制的小分子藥物���,降低毒副作用并拓展ADC藥物的應(yīng)用領(lǐng)域:選擇定點偶聯(lián)技術(shù)改善載藥均一性和藥代動力學(xué)特性等���。相信在ADC 領(lǐng)域研究者的共同努力下,克服現(xiàn)有 ADC的缺點和挑戰(zhàn)���,下一代的ADC藥物將會給腫瘤的靶向治療帶來新驚喜,使更多的腫瘤患者獲益���。另外���,作為一種遞送系統(tǒng)相信將來ADC藥物必將用于更加廣泛的領(lǐng)域���,如中樞神經(jīng)疾病���、遺傳疾病和感染性疾病等領(lǐng)域,作為真正高效的“魔法子彈”去消滅疾病���,拯救生命���。