2023年9月26日��,歐盟發(fā)布了一份Q&A文件“Q&A on transitional provisions for products without an intended medical purpose covered by annex XVI of the MDR”�,旨在幫助無預(yù)期醫(yī)療用途產(chǎn)品制造商更好地理解過渡期的相關(guān)規(guī)定,具體內(nèi)容如下:
1.CS何時(shí)適用于附錄XVI的產(chǎn)品��?
CS自2023年6月22日后��,適用于MDR法規(guī)附錄XVI中所列的無預(yù)期醫(yī)療用途的產(chǎn)品�。
以及適用于2022年12月22日后,已由公告機(jī)構(gòu)根據(jù)MDD法規(guī)頒布證書所涵蓋的某些規(guī)定產(chǎn)品(見問題7)�。
2.MDR何時(shí)適用于附錄XVI產(chǎn)品?
MDR適用于2023年6月22日起的附錄XVI產(chǎn)品,即CS的申請(qǐng)日期����。
3.附錄XVI產(chǎn)品的過渡期規(guī)定是什么?
MDR規(guī)定了6個(gè)月的過渡期��,以允許實(shí)施CS中規(guī)定的新的適用要求����。過渡期從2022年12月22日開始,到2023年6月22日結(jié)束����。
此外,CS制定了專門的過渡條款��,以涵蓋MDR授予的6個(gè)月不足以完全實(shí)施CS的新適用要求和完成MDR下的適用程序的具體情況��。具體情況包括:
①公告機(jī)構(gòu)需要參與符合性評(píng)估程序
②制造商考慮在涉及公告機(jī)構(gòu)的符合性評(píng)估程序之后進(jìn)行臨床調(diào)查
③附錄XVI產(chǎn)品包含在根據(jù)MDR Article 120(2)不再有效的MDD證書中��。
對(duì)于根據(jù)MDR Article 120(2)獲得有效MDD證書的附錄XVI產(chǎn)品��,MDR Article 120(3)(3a)(3b)(3c)(3d)(3e)款中規(guī)定的過渡條款適用�。
4.對(duì)于公告機(jī)構(gòu)參與符合性評(píng)估且制造商決定進(jìn)行臨床調(diào)查的產(chǎn)品,CS規(guī)定的過渡期是什么��?是否有需要滿足的條件?
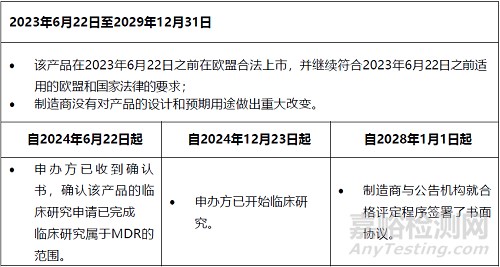
過渡期約為6.5年����,從2023年6月22日開始,到2029年12月31日結(jié)束����。
在過渡時(shí)期,需要滿足各種條件����。有些是在整個(gè)期間,而另一些則是在特定日期內(nèi)��。下表顯示了在過渡期內(nèi)產(chǎn)品繼續(xù)投放市場(chǎng)或投入使用所需滿足的每個(gè)條件�。
表1:CS第2(1)條規(guī)定的過渡條款的適用條件
MDD證書涵蓋的產(chǎn)品可以從問題6或7中描述的過渡期中受益��。
5.對(duì)于公告機(jī)構(gòu)參與符合性評(píng)估且制造商不進(jìn)行臨床調(diào)查的產(chǎn)品��,CS規(guī)定的過渡期是什么��?是否有需要滿足的條件��?
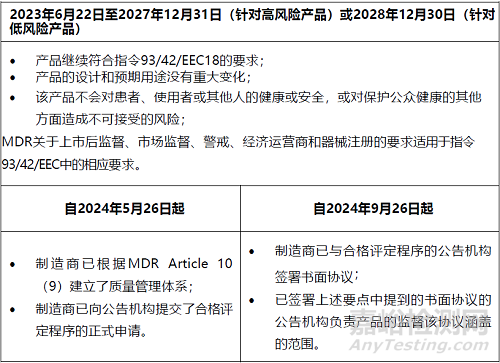
過渡期約為5.5年��,從2023年6月22日開始,到2028年12月31日結(jié)束�。
在過渡時(shí)期,需要滿足各種條件��。有些是在整個(gè)期間��,而另一些則是在特定日期內(nèi)��。下表顯示了在過渡期內(nèi)繼續(xù)將產(chǎn)品投放市場(chǎng)或投入使用所需滿足的每個(gè)條件�。
表2:根據(jù)CS第2(2)條的過渡條款的適用條件
MDD證書涵蓋的產(chǎn)品可以從問題6或7中描述的過渡期中受益。
6.MDD證書所涵蓋的附錄XVI產(chǎn)品的MDR中規(guī)定的過渡期是什么��?是否有需要滿足的條件�?
高風(fēng)險(xiǎn)產(chǎn)品(所有III類器械和IIb類植入式器械,縫合線�,吻合釘,牙科填充物��,正畸托槽��,牙冠��,螺釘�,楔子,板����,金屬絲�,針����,夾子和連接件除外)的期限于2027年12月31日結(jié)束,低風(fēng)險(xiǎn)產(chǎn)品(排除在高風(fēng)險(xiǎn)組之外的所有其他類別和器械)的期限至2028年12月30日結(jié)束��。
并非MDD證書涵蓋的所有產(chǎn)品都有資格從MDR制定的過渡條款中受益��,除非以下條件適用:
如果MDD證書從2017年5月25日起頒發(fā)��,在2021年5月26日仍然有效�,之后沒有被撤回,并且在2023年3月20日之前到期��,則只有滿足MDR Article 120(2)(a)或(b)點(diǎn)中規(guī)定的條件之一��,受保產(chǎn)品才能受益于MDR過渡條款��;
如果MDD證書從2017年5月25日起頒發(fā)��,在2021年5月26日仍然有效��,之后沒有被撤回�,并且在2023年3月20日之前沒有過期,則涵蓋的產(chǎn)品可以從MDR過渡條款中受益����。
MDR Article 120(3c)(3d)(3e)款規(guī)定了必須滿足的附加條件和要求,才能受益于并繼續(xù)受益于過渡條款����。關(guān)于這些具體條件的更多信息,請(qǐng)參閱關(guān)于實(shí)施條例(歐盟)2023/607的問答文件����。
7.MDD證書所涵蓋的附錄XVI產(chǎn)品的CS中規(guī)定的過渡期是什么?是否有需要滿足的條件����?
高風(fēng)險(xiǎn)產(chǎn)品(所有III類器械和IIb類植入式器械,縫合線�、吻合釘、補(bǔ)牙��、牙套��、牙冠��、螺釘�、楔塊��、板����、線����、針、夾子和連接器除外)的期限約為4.5年��,低風(fēng)險(xiǎn)產(chǎn)品(排除在高風(fēng)險(xiǎn)組外的所有其他類別和器械)的期限約為5.5年��。它從2023年6月22日開始��,到2027年12月31日或2028年12月30日結(jié)束�。
并非MDD證書涵蓋的所有產(chǎn)品都有資格從CS制定的過渡條款中受益。事實(shí)上����,只有當(dāng)MDD證書從2017年5月25日起頒發(fā),在2021年5月26日仍然有效����,之后沒有撤回����,在2023年3月20日之前到期����,并且不滿足第120(2)條第二款a)或b)點(diǎn)中規(guī)定的條件時(shí)����,這些規(guī)定才適用。
在過渡期間��,需要滿足額外的條件和要求�。下表列出了在過渡期內(nèi)繼續(xù)投放市場(chǎng)或投入使用產(chǎn)品所需滿足的每一個(gè)條件。
表3:根據(jù)CS第2(3)條的過渡條款的適用條件
為了確定條件和要求�,CS參考了MDR Article 120(3c)(3d)和(3e)款。經(jīng)法規(guī)(EU)2023/607修訂的MDR過渡條款的問答文件提供了額外的有用信息�。
必須注意的是,涵蓋受益于CS制定的過渡條款的產(chǎn)品的MDD證書的有效期不會(huì)延長(zhǎng)����。盡管如此,這些產(chǎn)品也可以在MDD證書到期日后投放市場(chǎng)或投入使用��,直到過渡期結(jié)束��。
8.CS中規(guī)定的MDD證書所涵蓋的附錄XVI產(chǎn)品的過渡期在2023年6月22日之前適用?是否有需要滿足的條件�?
MDD證書所涵蓋的附錄XVI產(chǎn)品的過渡期在CS中規(guī)定,之后由實(shí)施條例(EU)2023/1194對(duì)其進(jìn)行了修訂��。這些過渡條款在2022年12月22日至2023年6月21日期間仍然適用����。
在修訂前,CS訂明須符合的條件��,以便受惠及繼續(xù)受惠于過渡條文����。這些條件包括產(chǎn)品需要繼續(xù)符合MDD的要求,但有效MDD證書所涵蓋的要求除外�,該證書在2021年5月26日后到期;需要避免產(chǎn)品的設(shè)計(jì)和預(yù)期用途發(fā)生重大變化�;制造商需要與公告機(jī)構(gòu)簽署書面協(xié)議,以便進(jìn)行適當(dāng)?shù)谋O(jiān)督�。經(jīng)實(shí)施條例(EU)2023/1194修訂的CS中保留了這些條件。這些條件的兼容性確保了從2023年6月22日起順利過渡到適用的新制度�。
9.含有藥品的產(chǎn)品的過渡期是什么?
附錄XVI產(chǎn)品沒有具體的過渡條款����,如果這些產(chǎn)品包含一種可以單獨(dú)使用的物質(zhì)����,它將被視為2001/83/EC指令第1條第2點(diǎn)中定義的醫(yī)藥產(chǎn)品��。在這種情況下����,成員國(guó)根據(jù)指令2001/83/EC或EMA指定的主管機(jī)構(gòu)協(xié)商的210天的時(shí)間段必須被視為CS授予的過渡期的一部分��,以防公告機(jī)構(gòu)參與產(chǎn)品的符合性評(píng)估程序��。
10.兩用器械的過渡性規(guī)定是什么��?
對(duì)于具有醫(yī)療和非醫(yī)療預(yù)期用途的兩用器械�,必須同時(shí)滿足MDR和CS的適用要求。針對(duì)過渡條款��,對(duì)于醫(yī)療目的而言��,MDR Article 120條適用��,而對(duì)于非醫(yī)療目的��,CS適用����?�?紤]到器械必須同時(shí)滿足MDR和CS的適用要求����,如果這些要求不同����,例如在設(shè)定過渡期結(jié)束時(shí),應(yīng)考慮并滿足更嚴(yán)格的要求��。
11.制造商如何證明他們的產(chǎn)品從過渡期中受益����?
制造商應(yīng)能夠提供一份自我聲明,確認(rèn)符合從過渡條款中受益的條件��,并說明過渡期的結(jié)束日期��。一旦新條件適用并得到滿足��,應(yīng)立即更新自我聲明�。
自我聲明應(yīng)明確說明所涵蓋的產(chǎn)品,并可基于統(tǒng)一的模板�。
一旦與公告機(jī)構(gòu)簽署符合性評(píng)估書面協(xié)議的條件適用����,可通過公告機(jī)構(gòu)發(fā)布的“確認(rèn)函”提供額外證據(jù)����,說明收到制造商的符合性評(píng)估申請(qǐng)以及達(dá)成書面協(xié)議。此類確認(rèn)應(yīng)明確確定所涵蓋的產(chǎn)品����,可基于統(tǒng)一模板��,原則上無需額外費(fèi)用即可發(fā)布�。
如果MDD證書涵蓋了產(chǎn)品,則自我聲明和確認(rèn)函應(yīng)列出相關(guān)產(chǎn)品及其證書參考��。關(guān)于MDD證書所涵蓋產(chǎn)品的其他信息����,請(qǐng)參閱關(guān)于實(shí)施法規(guī)(EU)2023/607的問答文件(見問題7)。
12.在過渡期內(nèi)����,是否需要向市場(chǎng)提供產(chǎn)品的最后期限?
不需要�。將過渡期標(biāo)記在產(chǎn)品上的產(chǎn)品也可以在適用的過渡期結(jié)束后進(jìn)一步提供給市場(chǎng)�。
13.在過渡期內(nèi)����,公告機(jī)構(gòu)是否可以為MDR下的附錄XVI產(chǎn)品頒發(fā)證書?
可以����。公告機(jī)構(gòu)可在2023年6月22日(CS申請(qǐng)日期)起的過渡期內(nèi)為MDR下的附錄XVI產(chǎn)品頒發(fā)證書。在此之前����,MDR不適用于附錄XVI的產(chǎn)品,因此公告機(jī)構(gòu)無法頒發(fā)任何證書�。