藥學(xué)(Chemistry, Manufacturing and Controls��,化學(xué)�、生產(chǎn)和控制,簡稱CMC)研究���,包括藥物生產(chǎn)工藝研究�����、雜質(zhì)研究、質(zhì)量研究����、穩(wěn)定性研究、工藝驗證等方面內(nèi)容��,對非臨床和臨床研究試驗提供技術(shù)和物質(zhì)支持��,貫穿于藥物研發(fā)及生產(chǎn)的全生命周期,是藥品申報資料中非常重要的部分��。例如在進入臨床研究前����,化學(xué)部門主要研究化合物的理化性質(zhì)��、合成路線選擇�、起始原料確定����,工藝優(yōu)化、雜質(zhì)鑒定和控制策略等�����,同時要考慮到未來的生產(chǎn)�,是否能放大生產(chǎn)����?是否能工業(yè)化生產(chǎn)���?將來生產(chǎn)成本是否有可能降低?這是化學(xué)與生產(chǎn)的聯(lián)系���。而化學(xué)與控制的聯(lián)系源于2004年FDA最早提出QbD(質(zhì)量源于設(shè)計)概念,并被納入ICH質(zhì)量體系成為指導(dǎo)原則和指南����。
有數(shù)據(jù)表明,50%新分子實體第一次向FDA提交NDA申請遭到拒絕����,這當(dāng)中有11.3%的原因與CMC相關(guān);CMC研發(fā)平均約占生物制藥公司約50%的非臨床預(yù)算����,由此可見CMC策略的重要性����。
CMC的終極目標(biāo)是完成申報注冊和合規(guī)性要求,這兩條腿缺一不可����。
確保產(chǎn)品質(zhì)量符合法規(guī)要求。
確保產(chǎn)品的可靠和持續(xù)生產(chǎn)以避免短缺�����。
在平衡生產(chǎn)質(zhì)量和穩(wěn)定性的同時��,為產(chǎn)品收率制定目標(biāo)�。
降低生產(chǎn)過程風(fēng)險��,確保生產(chǎn)場所需要最低限度的維護和最低限度監(jiān)管要求��。
保持靈活性��,確保戰(zhàn)略能夠應(yīng)對多個地區(qū)監(jiān)管法規(guī)要求的差異。
2����、生物技術(shù)藥物CMC研發(fā)的挑戰(zhàn)在哪?
中國仿制藥的CMC已經(jīng)比較成熟����,而創(chuàng)新藥的CMC起步較晚��,研發(fā)具有較大的不確定性,特別是對于新療法�����、罕見適應(yīng)癥�、同類首創(chuàng)等引領(lǐng)性的創(chuàng)新藥,少有可參考的對象���,部分指導(dǎo)原則還在制訂中。尤其在原料��、制劑���、輔料包材��、質(zhì)量控制等各個環(huán)節(jié)極具挑戰(zhàn)�。
原料
雜質(zhì)未定義明確��,包括工藝雜質(zhì)����、制劑雜質(zhì)、容器中浸出雜質(zhì)或殘留溶劑等�;對原料藥的了解不夠充分�����;遺傳毒性研究不充分�;缺乏藥物與安全相關(guān)的臨床與臨床前關(guān)聯(lián)評價;方法及放行標(biāo)準(zhǔn)不適用等���。
制劑
處方組成中輔料的了解程度不夠���;方法及放行標(biāo)準(zhǔn)不適用��;沒有足夠的穩(wěn)定性數(shù)據(jù)支持臨床周期��;設(shè)備適用性問題��;包材相容性問題等。
輔料包材
對輔料包材缺乏說明�����;與藥物的相容性問題;標(biāo)準(zhǔn)問題(USP/NF;FDA非活性成分?jǐn)?shù)據(jù)庫)����,用CP標(biāo)準(zhǔn)可能會存在問題�;供應(yīng)商信息(Ⅲ期以后,供應(yīng)商改變后標(biāo)準(zhǔn)有沒有變)����;創(chuàng)新輔料的問題;動物性輔料來源問題(如瘋牛病風(fēng)險)�。
質(zhì)量研究和穩(wěn)定性
雜質(zhì)合理的限度;代謝產(chǎn)物等質(zhì)量控制結(jié)果是否與臨床結(jié)果結(jié)合��;穩(wěn)定性研究是否考慮到上市國家和地區(qū)的氣候�;儲藏條件和包裝是否考慮到主要目標(biāo)市場的氣候條件等����。
3、 做好CMC的秘訣是什么�?
策略一
充分了解生物技術(shù)藥物 (活性物質(zhì)�、原液到制劑) 的特點
充分了解生物技術(shù)藥物的特點是制定CMC策略的重要一步。每個產(chǎn)品不管是生化制品�����、生物制品還是單抗雙抗、ADC或者是細胞基因制品��,都是獨特的���,在同一類型里也不相似之處。但是每一個理想狀態(tài)���,都有一個質(zhì)量標(biāo)準(zhǔn),而我們的企業(yè)最好是做美國或歐洲的標(biāo)準(zhǔn)去實現(xiàn)全球國際化�,那么應(yīng)對國內(nèi)的標(biāo)準(zhǔn)就游刃有余了����。
策略二
必備條件-搭建一體化的CMC技術(shù)平臺 (或與CDMO合作)
1. 分析技術(shù)在產(chǎn)品開發(fā)生命周期中的應(yīng)用:分析的能力在CMC板塊被稱為工藝的眼睛和耳朵�,洞察黑匣子的未知,起到保駕護航的作用�。
2. 工藝開發(fā)到產(chǎn)品質(zhì)量的協(xié)同性:工藝決定產(chǎn)品��,產(chǎn)品質(zhì)量反饋工藝
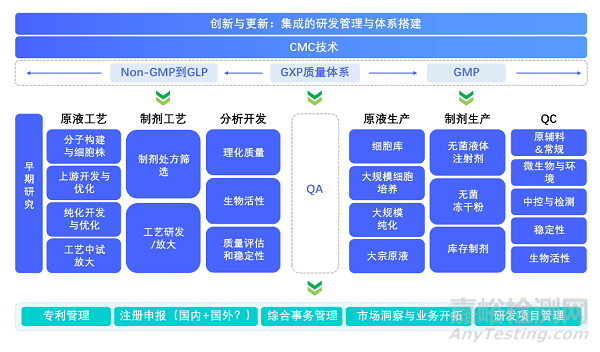
3. 建立Non-GMP到GMP下的CMC (工藝與質(zhì)控) 集成庫�,提高藥物研發(fā)和生產(chǎn)的效率和質(zhì)量一致性
4. 綜合過程到產(chǎn)品的分析和表征工具,利用技術(shù)作為其適當(dāng)?shù)脑O(shè)計。
圖1:集成的研發(fā)管理與體系搭建
策略三
做好產(chǎn)品實現(xiàn)路線與搭建完整高效GXP體系的平衡
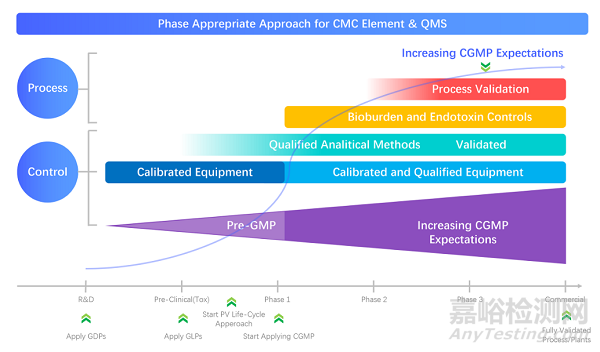
從藥物研發(fā)的每個階段對管理系統(tǒng)按邏輯結(jié)構(gòu)進行“分層切塊”����,定義過程順序和結(jié)構(gòu)�。為什么要GDP?為什么臨床前到啟動臨床需要GLP?為什么需要GEP?為什么要GCP?為什么臨床早期與后期要求略有不同?
為什么要GMP?為什么要GSP?確保每個工藝過程的數(shù)據(jù)的真實性,可靠性�����,可溯源��,可控性���,降低風(fēng)險增加的成功率。
圖2:CMC元件與質(zhì)量管理體系相適應(yīng)方法
策略四
工藝控制策略���,QbD中保證藥品質(zhì)量的直接武器
建立產(chǎn)品控制策略,是保證產(chǎn)品質(zhì)量符合目標(biāo)產(chǎn)品質(zhì)量屬性要求的必要途徑(其不限于QbD中)�,控制策略是針對所有產(chǎn)品的要求,如果設(shè)計空間被建立并批準(zhǔn)應(yīng)用�����,控制策略就為其提供了一種機制,可以確保生產(chǎn)工藝保持在設(shè)計空間所界定的范圍內(nèi)����。如果沒有適當(dāng)?shù)目刂撇呗?��,沒有適當(dāng)?shù)谋O(jiān)測和趨勢分析�,就有可能無法在常規(guī)基礎(chǔ)上提供高質(zhì)量的產(chǎn)品�,并且可能無法滿足監(jiān)管要求,以及缺乏對技術(shù)問題作出快速反應(yīng)的能力����。
策略五
Cross-Contamination Control Strategy 交叉污染控制策略
Contamination Control Strategy (CCS, 污染控制策略)這一概念首次出現(xiàn)于2017年的無菌附錄征求意見稿中����,是源于對當(dāng)前產(chǎn)品和工藝的理解����、用于確保工藝性能和產(chǎn)品質(zhì)量的一系列有計劃的措施,這些措施是針對微生物����、內(nèi)毒素/熱原和微粒的控制�����,一直是行業(yè)內(nèi)關(guān)注的熱點之一����。近些年生物技術(shù)藥物基本都是無菌制品�,除了工藝實現(xiàn)路線外,這也是合規(guī)性的要求����,污染的來源不僅來自產(chǎn)品和工藝,也來自非產(chǎn)品����。所以我們要最大限度地降低藥品生產(chǎn)過程中污染�、交叉污染以及混淆、差錯等風(fēng)險����,確保持續(xù)穩(wěn)定地生產(chǎn)出符合預(yù)定用途和注冊要求的藥品。
策略六
平臺技術(shù)不斷追求����、速度����、質(zhì)量��、成本的融合
毋庸諱言��,成功來自于速度����,靈活性�,成本和質(zhì)量,通過工藝優(yōu)化��、自動化和機器人技術(shù)�、過程分析和控制�、數(shù)據(jù)管理和分析以及質(zhì)量管理體系的應(yīng)用,可以提高生物技術(shù)藥物CMC的效率���,加快藥物的研發(fā)和生產(chǎn)過程�,為患者提供更好的治療選擇�。而我們應(yīng)了解CMC的所有指導(dǎo)方針和在CMC生命周期開發(fā)中的應(yīng)用�,使CMC技術(shù)平臺的能力準(zhǔn)備就緒以提高效率�。