1��、 從宏觀上解讀雜質(zhì)
1.1 雜質(zhì)與藥物不良反應(yīng)的關(guān)系
很多同仁都認為雜質(zhì)與藥物的不良反應(yīng)息息相關(guān),認為雜質(zhì)越小或越少���、臨床不良反應(yīng)發(fā)生幾率也就越小或越少����,進而在進行雜質(zhì)研究與控制時��,力求面面俱到�����、盡善盡美�����。
殊不知�����,引起藥物不良反應(yīng)的原因是多方面的�����,并不僅僅是藥物中的雜質(zhì)。人用藥品注冊技術(shù)要求國際協(xié)調(diào)會(ICH) 于2002年9 月12 日頒布了《療效--M4E(R1) 人用藥品注冊的通用技術(shù)文檔:模塊2 的臨床回顧和臨床概述與模塊5 :臨床研究報告》���。
其中闡述道:關(guān)于藥物的不良反應(yīng)���,常見的有關(guān)因素包括劑量�、單位劑量�、總劑量、給藥方案���、療程、人口統(tǒng)計學(xué)特征( 如年齡、性別��、種族)��、聯(lián)合用藥�、其他基礎(chǔ)特征( 如腎功能狀態(tài))、效能特性和藥物濃度等�����??梢姡幬锊涣挤磻?yīng)主要與主成分的不合理使用以及患者個人體質(zhì)差異相關(guān)��。不同給藥方式下雜質(zhì)與藥物不良反應(yīng)間的關(guān)系解讀如下����。
1.1.1 口服給藥
口服給藥是一 種較為安全的給藥方式��。但若用法用量不當(dāng)����、超出安全用藥濃度上限時�,將對人體帶來傷害��、產(chǎn)生不良反應(yīng) ( 如治療窗狹窄藥物常發(fā)生此情形)。
目前我國此類藥物的主要問題是:部分仿制藥質(zhì)量與原研藥存在較大差距���,主要是在患者體內(nèi)生物利用度的差異 �;生物利用度又與體外溶出行為密切相關(guān)����。
原國家食品藥品監(jiān)督管理總局(SFDA) 自2008 年起開展“國家藥品評價性抽驗”工作至今��,已發(fā)現(xiàn)國內(nèi)已上市的部分口服固體制劑體外多條溶出曲線與原研制劑有顯著性差異����。
1.1.2 靜脈滴注給藥
有同仁認為,靜脈滴注給藥方式已無生物利用度問題�����,此時不良反應(yīng)與雜質(zhì)密切相關(guān),故應(yīng)著重關(guān)注��。筆者認為這種認知是偏頗的�����。
此種給藥方式藥學(xué)管理與信息使得藥物直接進入封閉的血液循環(huán)系統(tǒng)中,當(dāng)外來物質(zhì)( 包括葡萄糖注射液����、氯化鈉注射液、藥物主成分���、少量雜質(zhì)、輔料和微量顆粒等)“一股腦兒地侵入”時���,其中呈現(xiàn)出的不良反應(yīng)強弱與患者的身體機能以及主成分的自身毒性及用法用量息息相關(guān)�����。
此種給藥方式帶來的不良反應(yīng)即便是小概率事件,但其發(fā)生率遠高于肌肉注射和口服給藥方式�����。
故世界衛(wèi)生組織(WHO) 早在多年前就已制訂了用藥要遵循“能不用就不用,能少用就不多用���;能口服不肌注,能肌注不輸液”的原則��。
然而過去的10多年間�����,我國臨床用藥大量使用靜脈滴注給藥方式�����, 使得臨床不良反應(yīng)發(fā)生率增高�����;并在2006 ~ 2007 年間集中爆發(fā)了幾起影響惡劣的藥害事件���,引起各方關(guān)注���。部分專家將其歸咎為僅是雜質(zhì)釋所為�。
其實��,此類制劑的質(zhì)量安全性風(fēng)險不僅僅在于雜質(zhì)�����,還與微生物����、熱原或細菌內(nèi)毒素�����、不溶性微粒和可見異物等密切相關(guān)。
1.2 雜質(zhì)與藥物質(zhì)量控制的關(guān)系
為最大限度地確保臨床安全性�����,ICH 在Q3 A和B 指導(dǎo)原則中設(shè)定了評估雜質(zhì)的“三條限”���,即報告限�����、鑒定限和質(zhì)控限���。
報告限:小于該限度的雜質(zhì),無關(guān)注價值,故無需積分。
鑒定限:籠統(tǒng)法( 主成分自身對照法或面積歸一化法) 測定結(jié)果不大于該限度的雜質(zhì)�,僅需報告測定結(jié)果,無需研究����、也無需鑒定結(jié)構(gòu)����,不會對臨床帶來安全性問題 ���;超過該限度的雜質(zhì)��,則需厘清化學(xué)結(jié)構(gòu)�。
質(zhì)控限(qualifi cation threshold�,也稱“界定限”):準(zhǔn)確法( 雜質(zhì)對照品法或主成分+ 校正因子法) 測定結(jié)果不大于限度時,無需深入研究���,該限度下的雜質(zhì)不會對臨床帶來安全性問題。對于貨架期內(nèi)含量超出質(zhì)控限的雜質(zhì)應(yīng)進行動物毒理研究�����,確定臨床使用時的安全限,且藥品中的該雜質(zhì)含量應(yīng)在效期內(nèi)不大于該限��,并將該限訂入質(zhì)量標(biāo)準(zhǔn)。這“三條限”為仿制藥研發(fā)中雜質(zhì)控制策略提供了科學(xué)合理的參考�����。
同時�����,人們還力圖通過雜質(zhì)控制來保證生產(chǎn)過程的可控性�����、批內(nèi)或批間品質(zhì)的均一性��、輔證主成分在貨架期內(nèi)的穩(wěn)定性等來滿足評價藥物質(zhì)量的需求。
1.3 發(fā)達國家向非發(fā)達國家釋放的“煙霧彈”
1.3.1 第一枚煙霧彈——雜質(zhì)
秉承制劑質(zhì)量標(biāo)準(zhǔn)僅關(guān)注降解雜質(zhì)的原則���,在前些年是合理的:經(jīng)研究當(dāng)“原料藥制成0 天制劑”和“0 天制劑在加速試驗6 個月、長期試驗6 個月或貨架期內(nèi)”�����,這2 個環(huán)節(jié)中雜質(zhì)都無變化��,在制劑的質(zhì)量標(biāo)準(zhǔn)中便無需制訂有關(guān)物質(zhì)檢查項����。
但近些年,這些標(biāo)準(zhǔn)中開始制訂并收載大量雜質(zhì)��。乍看起來甚是高標(biāo)準(zhǔn)、嚴(yán)要求���,但筆者認為這是在釋放“煙霧彈”����,目的是引仿制者誤入歧途�。
解讀如下案例:某一普通口服片劑進口質(zhì)量標(biāo)準(zhǔn)( 規(guī)格為0.125 ~ 1.0 mg) 中收載了12 個已知雜質(zhì)�����,并采用了極為復(fù)雜的色譜系統(tǒng)進行測定�,還引入校正因子逐一準(zhǔn)確計算���,制定了每一雜質(zhì)限度�。秉承上述原則��,該藥物是不可能在效期內(nèi)有12 個降解雜質(zhì)產(chǎn)生的�。
果然���,經(jīng)對數(shù)批貨架期內(nèi)原研制劑樣品予以檢測,絕大部分雜質(zhì)均未檢出( 報告限以下)�����,僅有1 ~ 2 個雜質(zhì)含量在報告限以上��、鑒定限以下��?�?闪钊诉z憾的是����,很多同仁唯進口質(zhì)量標(biāo)準(zhǔn)或國外藥典馬首是瞻�,花費大量資源設(shè)法獲得那12 個雜質(zhì),最終經(jīng)研究����,在仿制原料藥和仿制制劑中均是未檢出�����。
筆者推薦該品種的研發(fā)思路如下。
①測定3 批原研制劑�,經(jīng)剖析雜質(zhì)譜����,無含量不斷增加的雜質(zhì);
②測定3 批規(guī)?;a(chǎn)的仿制原料藥與仿制制劑樣品�����,無制劑鑒定限以上雜質(zhì)�����,且無含量不斷增加的雜質(zhì)����;
③根據(jù)以上研究結(jié)果���,最終質(zhì)量標(biāo)準(zhǔn)中無需制訂有關(guān)物質(zhì)檢查項。甚至可以采取更為大膽的做法——由于主成分規(guī)格很小���,且每日最多口服3 片,故雜質(zhì)與殘留溶劑均無需研究,只需在申報材料中闡明“經(jīng)推算這些物質(zhì)的每日最高攝入量均小于每日臨床安全攝入限度”即可���。
還有一進口外用涂抹皮膚的乳膏劑質(zhì)量標(biāo)準(zhǔn)�����,制訂了8 個已知雜質(zhì)���。本人認為這些均是原研企業(yè)對仿制者施放的霧彈���,以阻礙仿制進程��、迷惑研發(fā)方向�����。
據(jù)筆者所知����,目前全世界絕大多數(shù)原料藥已由發(fā)展中國家生產(chǎn)后出口至歐美國家�,歐美國家將這些雜質(zhì)含量極低的原料藥經(jīng)特殊處理后( 例如重結(jié)晶后制成目標(biāo)晶型�����、粒度分布、顆粒形狀���、比表面能等特性) 制成制劑,再銷往全世界獲取高額利潤�,其質(zhì)量毋庸置疑至于國外藥典原料藥項下羅列的眾多雜質(zhì)�����,且毫無保留地給出了結(jié)構(gòu)式�����,還可購得( 價格不菲)��,更是見仁見智�。
1.3.2 第二枚煙霧彈——溶出度試驗
各劑型皆有關(guān)鍵性評價指標(biāo)���,這在ICH Q6 文件( 規(guī)范:新原料藥和新藥制劑的測試方法和認可標(biāo)準(zhǔn):化學(xué)物質(zhì)) 和WHO 藥品標(biāo)準(zhǔn)專家委員會第43 次技術(shù)報告一書中均有闡述�。發(fā)達國家針對這些關(guān)鍵性評價指標(biāo)���,一者隱含( 僅在嚴(yán)格保密的、企業(yè)內(nèi)控質(zhì)量標(biāo)準(zhǔn)中才有)�����,二者即便公開�、也大多為寬松的試驗參數(shù)與限度范圍����。如對于口服固體制劑�����,最為核心的是溶出度試驗���。
筆者曾接觸過上百個原研制劑多條溶出曲線測定結(jié)果,發(fā)現(xiàn)相當(dāng)一部分國外藥典和進口質(zhì)量標(biāo)準(zhǔn)中的試驗參數(shù)都極為寬松�����、不具區(qū)分力( 如15 min 已溶出85%以上或未采用關(guān)鍵溶出介質(zhì))。蓋因該試驗太重要����,故發(fā)達國家在制訂ICH Q 系列質(zhì)量管理文件時都未有專門論述��,唯《日本溶出曲線數(shù)據(jù)庫》收載的實驗條件較具區(qū)分力�����。
因生物等效性(BE) 試驗僅采用年輕男性作為受試者有其局限性��,日本自20 世紀(jì)90 年代起就十分重視體外溶出度試驗�。在無法采用各種人群大標(biāo)本試驗的前提下���,只能通過對體外溶出度試驗的嚴(yán)格要求來促使仿制制劑內(nèi)在品質(zhì)趨近原研制劑�����。
為此�,日本在《仿制藥生物等效性試驗指導(dǎo)原則》中制訂了詳盡的溶出度試驗研究比對要 求。同時����,日本官方已建立起700 多個品種的原研制劑4 條溶出曲線數(shù)據(jù)庫���,并予以公開��,該項工作還在不斷進行中���。
而歐美的公開資料中大多宣稱:體內(nèi)生物利用度試驗才具有最終決定性����,不太強調(diào)體外溶出度試驗��。但通過解讀他們公開文獻中的溶出度試驗參數(shù),發(fā)現(xiàn)多數(shù)不具區(qū)分力��、甚至干脆不公開���。
如英國藥典收載的制劑很少,有些難溶性口服固體制劑竟沒有溶出度試驗����,甚至沒有1 個緩控釋制劑品種有釋放度試驗。如按此種不具區(qū)分力的實驗條件去研制仿制制劑�����,則多半會出現(xiàn)“部分仿制藥對于部分患者安全無效”的結(jié)果�����。
因此�,只有依靠科學(xué)客觀的評價手段�����,才能做出與原研制劑內(nèi)在品質(zhì)無限趨近的高品質(zhì)仿制藥來。
1.3.3 第三枚煙霧彈——潛在基因毒性雜質(zhì)
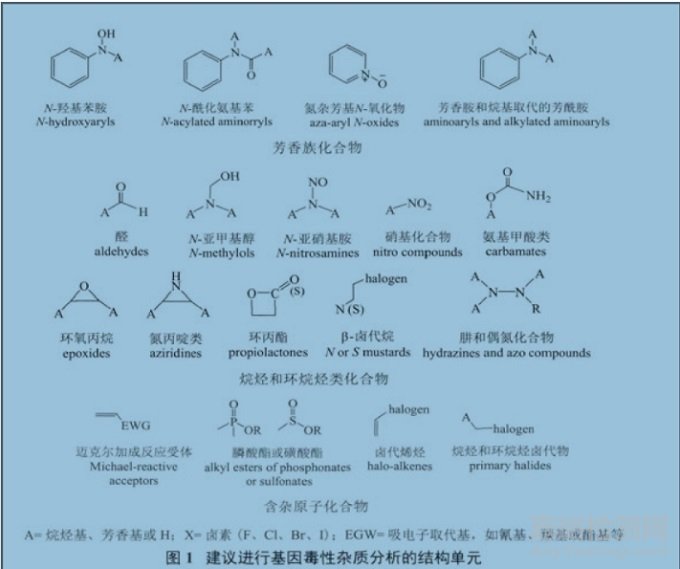
其實����,只要觀測仿制原料藥的起始物����、副產(chǎn)物�����、試劑�、配位體���、催化劑等是否具備文獻報道的“基因毒性雜質(zhì)官能團”,并針對規(guī)?���;a(chǎn)的仿制原料藥3 批樣品中檢出的鑒定限( 0.10% ) 以上特有雜質(zhì)( 即原研制劑中不存在)���,如具備這些結(jié)構(gòu)式( 見圖1)����,再進行相應(yīng)研究����。今后一定還會有其他“煙霧彈”發(fā)射過來��,如近期興起的“金屬雜質(zhì)研究”等�����。
1.3.4 應(yīng)對策略
⑴針對進口質(zhì)量標(biāo)準(zhǔn):相關(guān)藥品檢驗機構(gòu)進行復(fù)核時,應(yīng)要求企業(yè)提供詳盡的檢測法驗證資料��,著重審閱質(zhì)量標(biāo)準(zhǔn)中的各項試驗參數(shù)是如何建立的,關(guān)注其邏輯推導(dǎo)過程�,是經(jīng)怎樣的研究與試驗結(jié)果確定的。
如未盡詳細�����,應(yīng)要求對方持續(xù)提供���。如溶出度試驗���,為何申報中制訂了100 r/min 高轉(zhuǎn)速和該溶出介質(zhì)?是否研究過50 和75 r/min 溶出行為��,以及其他介質(zhì)的溶出情況后綜合考慮確定�?是否有故意放寬、讓自我產(chǎn)品永遠合格的嫌疑���?又比如有關(guān)物質(zhì)����,為何訂入這么多雜質(zhì)和如此低的限度���,制訂的依據(jù)是否充分等。
⑵針對公開的各國藥典與文獻資料:切忌照搬照抄、盲目迷信����。我國藥品審評中心(CDE) 早在2003 年就已提出“仿產(chǎn)品不是仿標(biāo)準(zhǔn)”的指導(dǎo)思想�,就是希冀同仁在具體研制時能獨立思考、冷靜分析�。該宗旨中的“標(biāo)準(zhǔn)”不僅僅指國內(nèi)質(zhì)量標(biāo)準(zhǔn)��,也包括國外標(biāo)準(zhǔn)及文獻。
總之�,無論如何都應(yīng)獲取至少3 批原研制劑����,深度剖析其關(guān)鍵質(zhì)量特性參數(shù)后再來指導(dǎo)仿制藥的開發(fā)����,以及制訂質(zhì)量標(biāo)準(zhǔn)等事宜�����,這才是研發(fā)的根本出發(fā)點(FDA 仿制藥辦公室. “質(zhì)量源于設(shè)計”理念應(yīng)用于仿制藥申報[M] . 北京大學(xué)藥物信息與工程研究中心譯, 2012)�����。
2��、從微觀上解讀雜質(zhì)
以上闡述并非強調(diào)不研究雜質(zhì)�,而是希望在進行仿制藥研制時能夠把握好“度”��。下面以既有質(zhì)量標(biāo)準(zhǔn)存在的前提下,詳述六類仿制藥研發(fā)思路���。
2.1 雜質(zhì)譜的測定與研究對象
該理念的提出富有針對性�����,即通過測得原研制劑雜質(zhì)譜來客觀合理地控制仿制原料藥和仿制制劑中雜質(zhì)被允許存在的程度��。
邏輯樹如下:原研制劑雜質(zhì)譜→ 仿制原料藥雜質(zhì)譜→ 仿制制劑雜質(zhì)譜需強調(diào)的是��,無需測得原研原料藥雜質(zhì)譜( 實際上也難以獲得樣品)���,一者與臨床無關(guān),二者其往往與仿制原料藥合成路徑殊途同歸��。
如此�,國外藥典收載的原料藥質(zhì)量標(biāo)準(zhǔn)項下大量已知雜質(zhì)也就無需全部獲得并逐一研究�,最多僅研究其中主成分降解產(chǎn)生的雜質(zhì)( 以下簡稱“降解雜質(zhì)”)��,因這些降解雜質(zhì)在仿制品中也往往存在����。
2.2 雜質(zhì)譜測定法:色譜條件建立過程
既然要進行以上3 種來源樣品的雜質(zhì)譜比較���,就應(yīng)在同一色譜條件下予以測定,才具可比性��。由于是六類仿制藥�����,故色譜條件的建立往往可參考和借鑒既有制劑或原料藥質(zhì)量標(biāo)準(zhǔn)中的色譜條件( 以下簡稱“既有標(biāo)準(zhǔn)”)。建立過程如下���。
2.2.1 用既有標(biāo)準(zhǔn)中羅列的所有已知雜質(zhì)來驗證色譜條件的系統(tǒng)適用性
很多同仁認為這一步很重要���,所以為了驗證各已知雜質(zhì)的彼此分離度以及與主成分峰的分離度���,花巨資購買來或自制出所有雜質(zhì)對照品���。
但筆者認為該步驗證必要性并不強����,因這些已知雜質(zhì)大多僅與原研原料藥的合成路徑相關(guān)��,而與仿制品無關(guān),在原研制劑和仿制品中很多均是未檢出( 報告限以下)���。
筆者建議的應(yīng)對方案如下����。①由于既有標(biāo)準(zhǔn)已具備相當(dāng)?shù)臋?quán)威性��,故可認為已具備良好的耐受性,無需再獲取羅列的所有雜質(zhì)予以驗證����,直接沿用既有標(biāo)準(zhǔn)色譜條件��,即可認為能分離檢測出既有標(biāo)準(zhǔn)中的所有雜質(zhì)�。
雖說制劑質(zhì)量標(biāo)準(zhǔn)僅針對降解雜質(zhì)���,但通常該色譜條件的建立也要確保原料藥中的合成雜質(zhì)不干擾降解雜質(zhì)的測定。因此�,這些標(biāo)準(zhǔn)本身就已具備較強的檢測能力���。
②對既有標(biāo)準(zhǔn)的色譜條件進行微調(diào),通常是減少流動相中有機相比例或延長梯度洗脫時間�,使所有色譜峰保留時間延長��。此法通常更有利于各物質(zhì)間的分離����。此時����,也無需再取對照品驗證��。
③厘清既有標(biāo)準(zhǔn)中與主成分最難分離的1 ~ 2個雜質(zhì),隨后僅驗證該雜質(zhì)峰與主成分峰的分離即可�����。至于其他雜質(zhì)間能否有效分離���,只要在檢測各樣品雜質(zhì)譜時均未檢出��,即無需再深入研究。即便檢出�����,只要這些雜質(zhì)不是需針對性準(zhǔn)確測定的降解雜質(zhì)����,也無需再深入研究�,因峰重合更提高了對仿制藥的質(zhì)控要求����。以上3 種做法研究者可根據(jù)品種具體情形酌情遴選。
2.2.2 所建立的色譜條件應(yīng)能分離檢測出仿制原料藥中的目標(biāo)雜質(zhì)
采用“2.2.1”項下所建立的色譜條件驗證:
①分離檢測仿制原料藥合成步驟各中間體和起始物等與主成分峰的分離度,因為這些物質(zhì)最易殘留于產(chǎn)品中;驗證時所配制的系統(tǒng)適用性試驗溶液應(yīng)是主成分濃度為100%��、各雜質(zhì)濃度約1.0% ���。
②采用原料藥精制前的粗品予以驗證��。
③采用存在于仿制品中的針對性目標(biāo)雜質(zhì)予以驗證。經(jīng)過上述步驟所建立的色譜條件通常應(yīng)為:采用普通粒徑25 cm 長色譜柱���、流速1.0 ml/min 前提下��,主成分峰保留時間不小于15 min���,測定3 ~ 4 倍保留時間至60 ~ 90 min 結(jié)束;只要溶液穩(wěn)定性良好�����,測定時應(yīng)盡可能采用自動進樣設(shè)備���、以充分利用下班后時間來提高檢測效能。
同時���,無需擔(dān)心由于保留時間長�����、部分含量較低的雜質(zhì)峰難以積分出�����,此時只要將積分參數(shù)中的斜率設(shè)置得小些�����、峰寬設(shè)置得大些便不會有漏檢( 最小峰面積按報告限設(shè)置)�。
2.2.3 研究勿苛求完美
很多研發(fā)人員力求檢測出仿制品中可能存在的所有潛在雜質(zhì)���,其實大可不必。關(guān)于研究邏輯思路與著眼點��,在ICH Q3A 和B 指導(dǎo)原則中早已闡明:秉承“逆向分析”思路—— 即從檢測規(guī)?��;a(chǎn)的3 批仿制原料藥和仿制制劑樣品入手�,獲得報告限以上雜質(zhì)譜����;
隨后與“正向分析”結(jié)合( 通常僅選取合成中間體和起始物料���,因為這些雜質(zhì)最易殘留于規(guī)模化生產(chǎn)的終產(chǎn)品中)��,如2 種分析所得雜質(zhì)相對應(yīng)��,研究結(jié)束����;如存在未對應(yīng)雜質(zhì)���,僅針對原料藥鑒定限以上的雜質(zhì)才考慮厘清來源�����、適度研究。
關(guān)于是否存在“漏檢雜質(zhì)”����,可采用以下3 法予以驗證。
①對于包裹于主成分峰的含量較大或不增加雜質(zhì)�����,一般可通過二極管陣列檢測器(DAD)探明��。
②對于“逸出”于所建色譜條件以外的含量較大或不增加雜質(zhì),則可通過至少兩法測定主成分含量���、觀測結(jié)果是否“殊途同歸”的辦法予以探明,或是在連續(xù)測定中在其后樣品中被檢出�����。
③對于含量不斷增加的雜質(zhì)�����,自會在穩(wěn)定性考核( 加速和長期) 試驗中“主成分含量下降量與總雜質(zhì)增加量間相輔相成性( 以下簡稱相輔相成性)”上體現(xiàn)出來,此時再著手亦不遲�����。實際工作中��,出現(xiàn)以上3 種情形的概率均不大。
總之�����,我們應(yīng)客觀理性地認知到“任何檢測法都不是萬能”的���,即便有漏檢雜質(zhì),只要這些雜質(zhì)含量在制劑鑒定限或質(zhì)控限以下��,臨床應(yīng)用時引起不良反應(yīng)的可能性就不大�����。
2.3 檢測各樣品雜質(zhì)譜
采用“2.2”項下建立的色譜條件分別測定以下各樣品�。
2.3.1 原研制劑雜質(zhì)譜
一者可通過測定至少3 批不同貨架期時間點的樣品( 應(yīng)有1 批臨近效期) �����;二者可采用1 批樣品���,對其進行至少6 個月加速試驗測得( 加速試驗的時長根據(jù)效期相應(yīng)制訂)��。無需采用強破壞試驗����,因?qū)嶋H情況根本不存在����。隨后厘清“不斷增加的降解雜質(zhì)”和“不增加雜質(zhì)”���。
2.3.2 測得仿制原料藥雜質(zhì)譜
一般通過測定至少3 批規(guī)模化生產(chǎn)樣品和加速試驗6 個月或長期試驗N 個月樣品獲得����,厘清“不斷增加的降解雜質(zhì)”和“不增加雜質(zhì)”。
2.3.3 測得仿制制劑雜質(zhì)譜
同“2.3.2”項下操作�����。
這里需強調(diào)的是,測定以上各樣品雜質(zhì)譜時��,均應(yīng)嚴(yán)格按照ICH 設(shè)定的原料藥報告限(0.05% )予以積分( 考慮到雜質(zhì)譜的可比連貫性����,制劑積分時也建議依照該限)�。
但遺憾的是,有部分研究人員積分時將最小峰面積設(shè)定得很小����,導(dǎo)致小于報告限的大量雜質(zhì)被積分出��,隨后為了研究����、又將Y 軸設(shè)置得也很小、視野放得很大進行觀測�����。對于仿制品中含量大于原料藥鑒定限的雜質(zhì)建議厘清化學(xué)結(jié)構(gòu)與來源。
2.4 對仿制原料藥或仿制制劑中雜質(zhì)譜的控制要求
2.4.1 針對仿制制劑與原研制劑共有的降解雜質(zhì)要求
此類雜質(zhì)在仿制制劑中的降解速度不得大于原研制劑�����,由此效期才能不短于原研制劑( 一般此類雜質(zhì)臨近效期時含量會超出制劑質(zhì)控限)���。
以往可通過縮短仿制制劑效期使降解雜質(zhì)符合質(zhì)量標(biāo)準(zhǔn)限度��,但現(xiàn)今各國紛紛提高了仿制藥研發(fā)要求,其中一點就是“效期不得短于原研制劑”��。降解速度的表達建議采用作圖法,即以時間(月份) 為橫坐標(biāo)����,雜質(zhì)含量為縱坐標(biāo)�����,線性回歸計算得斜率,仿制制劑斜率不大于原研制劑即可�����,由此便可推斷出未來目標(biāo)時間點仿制制劑中的降解雜質(zhì)符合限度要求。
因此�����,在以原研制劑為對比的前提下�����,仿制制劑進行6 個月加速試驗也完全可考慮遞交“暫定效期長于2 年”的申請,只是此時建議長期試驗增加或直接采用中間試驗[30 ℃����、相對濕度(RH)65% ] 予以考察���。此類雜質(zhì)在質(zhì)量標(biāo)準(zhǔn)中通常需采用準(zhǔn)確法測定�����。
2.4.2 針對仿制制劑與原研制劑共有的���、含量不增加的雜質(zhì)��。
此類雜質(zhì)通常為原料藥中合成工藝雜質(zhì)�����、起始物等���。具體要求如下���。
①當(dāng)原研制劑中該雜質(zhì)含量大于制劑鑒定限時�����,仿制制劑中該雜質(zhì)含量應(yīng)不大于原研制劑���。
②當(dāng)原研制劑中該雜質(zhì)含量小于制劑鑒定限時���,仿制制劑中該雜質(zhì)含量可大于原研制劑,但必須仍不大于制劑鑒定限����。此類雜質(zhì)檢測時采用籠統(tǒng)法即可�。如用準(zhǔn)確法測定,對應(yīng)限度可相應(yīng)改為制劑質(zhì)控限��。
2.4.3 針對仿制品中的特有雜質(zhì)
由于CDE 對雜質(zhì)要求較為嚴(yán)格�����,故建議厘清來源、鑒定結(jié)構(gòu)�����,并確認不具備潛在基因毒性雜質(zhì)官能團。一類為含量不變化雜質(zhì)����,來源同“2.4.2”項。此時�����,籠統(tǒng)法測定結(jié)果不大于制劑鑒定限,或準(zhǔn)確法測定結(jié)果不大于制劑質(zhì)控限��,即可不必再做深入研究���。
另一類為含量不斷增加的新增降解雜質(zhì),依然是效期內(nèi)滿足以上要求即可���。一旦籠統(tǒng)法測定結(jié)果超過鑒定限�����,就需準(zhǔn)確測定:獲得雜質(zhì)對照品�、確證其結(jié)構(gòu)����、測得純度值��,計算校正因子等����。
2.4.4 雜質(zhì)總量
參照既有標(biāo)準(zhǔn)擬定���。此時,仿制制劑只要符合既有標(biāo)準(zhǔn)�、實際含量即便高于原研制劑亦無妨����。因該限度值是由原研企業(yè)或國外藥典規(guī)定,已經(jīng)臨床充分論證�����。
2.4.5 仿制制劑與原研制劑的質(zhì)量對比
業(yè)內(nèi)普遍存在“雜質(zhì)種類或量一致、甚至雜質(zhì)量少于原研制劑���,仿制藥質(zhì)量就與原研藥一致�����、甚至超越”的思維模式�����,其實��,雜質(zhì)含量只要在規(guī)定限度下就沒有可比性���。
3�����、對研發(fā)熱點的概念解讀
3.1 客觀理解強破壞試驗和影響因素試驗
探求藥物內(nèi)在穩(wěn)定性的手段由弱到強依次為:①長期試驗( 包括中間試驗) ��;②加速試驗;③影響因素試驗��;④強破壞試驗�。通常情況下藥物是不可能遭遇到③和④情形的。之所以進行���,是期望通過較為激烈的外界刺激來洞悉藥物易受何條件影響、發(fā)生降解或質(zhì)變�,從而在藥物生產(chǎn)、包裝��、貯藏�����、運輸?shù)拳h(huán)節(jié)規(guī)避該條件���,以保證藥物在效期內(nèi)的質(zhì)量穩(wěn)定性�����。
針對①和②試驗,既要洞悉藥物隨時間推移時關(guān)鍵指標(biāo)是否有變化,還要關(guān)注若發(fā)生變化�,是否呈現(xiàn)相輔相成性���。若非,說明有較大雜質(zhì)漏檢�����,建立的有關(guān)物質(zhì)檢測法需進一步完善,此時才考慮通過③和④手段去尋找那些“丟失的雜質(zhì)”���。若是��,即便有漏檢雜質(zhì),含量也應(yīng)在制劑鑒定限以下����。
因此���,上述③和④產(chǎn)生的雜質(zhì)在實際樣品中一般不會存在�,也就無需研究這些降解雜質(zhì),僅驗證分離度即可���,以保證樣品遭遇不可知極端條件時��,即便產(chǎn)生雜質(zhì)也能被檢出�。很多同仁針對該實驗所產(chǎn)生的雜質(zhì)做了大量研究��,但最終結(jié)論幾乎沒有推翻已建立色譜條件的��。
其實��,只要保證主成分峰保留時間在15 min 后,且適度破壞( 使雜質(zhì)產(chǎn)生5%~ 15% )��,該實驗則可順利完成��。至于需驗證“破壞后的物料平衡”,該專業(yè)認知與要求至今未在任何國家級指導(dǎo)原則上發(fā)布。筆者認為����,持有該觀點的同仁是與“①和②試驗中的相輔相成性”混淆了,故不應(yīng)強求���。
3.2 舉足輕重的加速試驗
由于長期試驗較為耗時,故一般采用加速試驗���。該實驗在驗證輔料相容性�、成品采用何種包裝更經(jīng)濟實用等眾多方面均極為實用�����。為減小誤差��、更準(zhǔn)確測定主成分含量變化情況以窺探是否有降解����,強烈建議含量測定法中的溶液濃度設(shè)定得低一些�,一者有利于與相鄰雜質(zhì)峰的分離,再者主成分峰形變“瘦”����、峰面積變小,更能提高測定精密度、提升準(zhǔn)確性���。
3.3 主成分與輔料的相容性研究
該試驗?zāi)康氖翘角笾鞒煞忠资芎屋o料影響導(dǎo)致降解,但絕非試驗結(jié)果不理想就剔除該輔料�����,因所采用的試驗條件可能與實際情況不符�,只是“大膽假設(shè)、小心求證”�����,只有當(dāng)嘗試用該處方進行加速試驗后��,若發(fā)生雜質(zhì)超標(biāo)����、不符合規(guī)定或不滿足控制策略時���,才考慮更改制劑工藝或是摒棄該輔料��。
3.4 方法學(xué)驗證
方法學(xué)驗證分為兩部分內(nèi)容:①測定法各參數(shù)的邏輯推導(dǎo)過程與對試驗結(jié)果的分析論述����,即測定法各參數(shù)是如何確定的?②確定后的方法學(xué)驗證�,這只是驗證方法執(zhí)行時的適用性��。
前者是驗證的核心內(nèi)容��,后者僅在極個別情形時才會出現(xiàn)問題����。而如今很多研發(fā)者未能充分理解以上含義��,對于第一部分內(nèi)容��,在申報材料中輕描淡寫或照抄既有標(biāo)準(zhǔn)�;而對后一部分內(nèi)容做了大量工作���。如溶出度試驗方法學(xué)驗證分為3 部分:第一部分為各參數(shù)的確立過程��,應(yīng)論證裝置�、轉(zhuǎn)速�����、溶出介質(zhì)、溶出體積����、取樣時間點�、溶出限度等參數(shù)的邏輯推導(dǎo)過程�����;
第二部分為樣品處理方式的驗證,如自動取樣裝置是否對樣品測定有干擾��、過濾是否會導(dǎo)致主成分損失��、過濾多少體積濾膜才至飽和等���;
第三部分為測定法的驗證����,如采用UV 法測定時輔料是否有干擾,以及通常所需進行的那些驗證內(nèi)容( 如線性���、精密度等)��。
這其中最為核心的是第一部分����,如采用了不科學(xué)的100 r/min 高轉(zhuǎn)速���,那所有試驗與驗證就沒有意義���。一般而言,分析方法的建立包括分離檢測條件的篩選與優(yōu)化以及方法驗證兩方面。
其中����,方法驗證是在檢測方法確定后開展的,其目的是證明采用的方法適用于相應(yīng)檢測要求���。檢測方法的篩選優(yōu)化研究不能代替方法的驗證工作����,盡管二者的部分研究內(nèi)容有交叉。所謂“交叉”�,筆者以有關(guān)物質(zhì)測定方法學(xué)驗證中前一部分的“供試品溶液濃度應(yīng)如何確定”與后一部分“最低檢出限�����、最低定量限”的關(guān)聯(lián)性來詮釋����,列表如下( 表1)����。
可知�����,最低檢出限和最低定量限的真正作用是用來推導(dǎo)供試品溶液濃度的設(shè)定�����,因此試驗結(jié)束后應(yīng)給出“相當(dāng)于供試品溶液濃度的X%”�。如此,在今后檢測中可確保即便最低檢出限有所升高��,也能保證至少有1 000 ~ 2 000 倍的落差( 報告限要求),從而對雜質(zhì)檢測的靈敏度不會帶來任何影響�。
3.5 歸一化法的妙用
當(dāng)供試品溶液稀釋100 倍呈線性時( 誤差在2%以內(nèi)),雜質(zhì)含量采用主成分自身對照法和歸一化法的測定結(jié)果便無顯著性差異����,此時建議質(zhì)量標(biāo)準(zhǔn)中仍采用前者��,但研發(fā)中的大量樣品測定和今后企業(yè)的內(nèi)控標(biāo)準(zhǔn)均可采用后者。
4����、 討論
4.1 相輔相成性的數(shù)值多少為宜
關(guān)于加速和長期試驗中“主成分含量下降量與總雜質(zhì)增加量間的相輔相成性”多少為宜�����,筆者查閱了大量文獻����,均未明確指明,ICH 指導(dǎo)原則中只提出實驗者酌情確定���。
筆者依據(jù)經(jīng)驗和試驗誤差,建議“以不超過該品種規(guī)格所對應(yīng)的制劑鑒定限3倍”為宜�,如主成分每日最高給藥量0.01 ~ 2 g�,對應(yīng)鑒定限為0.2%����,則建議不超過±0.6%�����。之所以是鑒定限、而非質(zhì)控限,蓋因很多雜質(zhì)的測定均可采用籠統(tǒng)法�����。
4.2 ICH 指導(dǎo)原則中對原料藥和制劑雜質(zhì)控制的“厚此薄彼”性
“2.4.3”項下仿制品中特有雜質(zhì)的控制策略是按照ICH Q3 指導(dǎo)原則制訂的,該指導(dǎo)原則對原料藥要求過于嚴(yán)格��。通覽各國藥典和進口的原料藥質(zhì)量標(biāo)準(zhǔn)�����,其中不乏有“未鑒定雜質(zhì)按籠統(tǒng)法測定����、結(jié)果不得過0.1% ( 有效數(shù)字較0.10%少保留一位���,如此實測值0.14%也可以) 或0.2%”的設(shè)定案例。
因此����,筆者強烈建議:秉承臨床使用制劑、而非原料藥的原則���,針對仿制品中特有雜質(zhì),無論原料藥還是制劑�����,均以制劑限度予以要求�,便可極大程度地減少在原料藥開發(fā)上的資金投入與時間成本�。此處,也懇請CDE 老師們思忖定奪�,從而引導(dǎo)眾人更為客觀理性地把握好雜質(zhì)研究與控制的“度”���。